Peixe-boi-da-amazônia
O peixe-boi-da-amazônia (português brasileiro) ou peixe-boi-da-amazónia (português europeu) (nome científico: Trichechus inunguis), também chamado popularmente como peixe-boi-amazônico (português brasileiro) ou peixe-boi-amazónico (português europeu),[3] guaraguá,[4] manati-da-amazônia (português brasileiro) ou manati-da-amazónia (português europeu), manati-amazônico (português brasileiro) ou manati-amazónico (português europeu), manatim-da-amazônia (português brasileiro) ou manatim-da-amazónia (português europeu)[5][6] ou manatim-amazônico (português brasileiro) ou manatim-amazónico (português europeu),[7] é um mamífero da família dos triquequídeos (Trichechidae) que é encontrado em rios e lagos da bacia do rio Amazonas.
| Peixe-boi-da-amazônia | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Peixe-boi-da-amazônia num selo postal de 1979
| |||||||||||||||
| Estado de conservação | |||||||||||||||
 Vulnerável (IUCN 3.1) [2] | |||||||||||||||
| Classificação científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| Trichechus inunguis[1] (Natterer, 1883) | |||||||||||||||
| Distribuição geográfica | |||||||||||||||
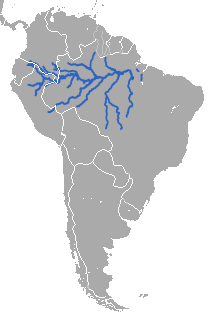 | |||||||||||||||
Etimologia editar
Guaraguá é um termo genérico para se referir aos peixes-boi, mas sua origem é controversa. De acordo com o Dicionário Histórico das Palavras Portuguesas de Origem Tupi (DHPT), deriva do tupi ïgwara'gwa. Teodoro Sampaio, em O Tupi na Geografia Nacional (TupGN), alega que deriva de guara-guara no sentido de "comilão". Foi registrado em 1587 com goaragoá e em cerca de 1631 como guaragua.[8] Manati, ou sua variante manatim, tem provável origem caribe e foi difundido pelo espanhol manatí. Foi registrado em 1853 como manahi.[9] Por sua vez, seu nome científico Trichechus advém do grego e significa "ter cabelos", enquanto iunguis significa" sem unhas".[10]
Taxonomia e sistemática editar
Através de datação é possível afirmar que os antepassados dos animais da ordem dos sirênios tiveram sua origem no Eoceno, no qual sua distribuição e diversidade eram superiores, incluindo até mesmo indivíduos carnívoros.[11] A ordem dos sirênios (Sirenia) é atualmente representada por duas famílias com dois gêneros vivos e cinco espécies. O T. inunguis é um dos três representantes da família dos triquequídeos (Trichechidae), juntamente com o peixe-boi-marinho (Trichechus manatus) e o peixe-boi-africano (Trichechus senegalensis), e foi oficialmente identificado no táxon por Johann Natterer em 1883.[12] Inicialmente os peixes-boi foram classificados por Lineu juntamente com outros mamíferos devido a seu peculiar método de locomoção e ausência de incisivos, criando assim o grupo denominado Bruta que incluía os elefantes, bichos-preguiça, pangolins e tamanduás.[11] Seus parentes mais próximos atualmente são os elefantes e hiracoides (Hyracoidea), sendo classificado como penungulado junto com eles em 1945 pelo paleontólogo George Simpson.[13]
Análises filogenéticas discordam sobre a melhor forma de representar a cladística das três espécies do gênero Trichechus, visto que alguns estudos mostram que entre as espécies de peixe-boi ainda existentes, o peixe-boi-da-amazônia representa a espécie mais basal. Sendo assim, T. manatus e T. senegalensis seriam duas espécies provavelmente derivadas do mesmo ancestral marinho. Essa mesma proposta dita que as espécies marinhas sejam monofiléticas, o que implica numa separação do peixe-boi-da-amazônia há muito tempo.[14] Da mesma forma, há especulações acerca de uma relação entre o peixe-boi-da-amazônia e o peixe-boi-africano, embora não haja sinapomorfias morfológicas apoiando tal hipótese.[15] O cladograma ilustra as relações filogenéticas entre as espécies de peixe-boi viventes.
| Sirenia |
| |||||||||||||||||||||
Descrição editar
As faixas de peso e tamanho corporal observadas do peixe-boi-da-amazônia são 7,5–346 quilos (17–763 libras) e 76,0–225 centímetros (2 pés 5,9 polegadas – 7 pés 4,6 polegadas) para machos cativos, 8,1–379 quilos (18–836 libras) e 71,0 –266 centímetros (2 pés 4,0 polegadas – 8 pés 8,7 polegadas) para fêmeas em cativeiro e 120,0–270 quilos (264,6–595,2 libras) e 162,0–230 centímetros (5 pés 3,8 polegadas – 7 pés 6,6 polegadas) para peixes-boi de vida livre, respectivamente. O peso real máximo do peixe-boi-da-amazônia relatado é de 379 quilos (836 libras). Os bezerros da espécie nascem pesando 10–15 quilos (22–33 libras) e 85–105 centímetros (33–41 polegadas) de comprimento.[16] Aumenta em comprimento aproximadamente 1,6-2,0 milímetros por dia. Esse comprimento é medido ao longo da curvatura do corpo, de modo que o comprimento absoluto pode diferir entre os indivíduos. Quando bezerros, ganham em média um quilo por semana.[17]
Os peixes-boi-da-amazônia são grandes mamíferos de forma cilíndrica, com membros anteriores modificados em nadadeiras, sem membros posteriores livres e a parte traseira do corpo na forma de um remo achatado, arredondado e horizontal. As nadadeiras flexíveis são usadas para ajudar no movimento sobre o fundo, arranhar, tocar e até mesmo abraçar outros peixes-boi, mover comida e limpar a boca.[18] Dentre suas características marcantes está a ausência de unhas nas nadadeiras peitorais (membros anteriores),[19] a presença de duas mamas próximas às axilas e manchas brancas na região ventral da maioria dos indivíduos adultos, mesmo tendo a pele variando predominantemente de cinza a preto.[20][21] Sua pele é ondeada e enrugada, com dobras profundas ao redor da cabeça, na junção das nadadeiras e na base da cauda, a qual também possui espessura entre oito e 16 milímetros coberta por pelos finos, sendo mais numerosos nas nadadeiras. Tem lábios de textura grossa e com numerosas cerdas queratinizadas, mais rígidas na região interna dos lábios e direcionadas ventralmente.[22][23][24] O lábio superior é modificado numa grande superfície eriçada, profundamente dividida. Pode mover cada lábio independentemente durante a alimentação.[18]
Tal espécie animal é classificada como selenodonte, tendo em vista a fórmula dental , sendo seus dentes molares paralelos à margem da língua, característico de herbívoros, à maceração de fibras duras.[23] Ademais, ao nascerem possuem incisivos que permanecem submersos na gengiva, logo não são funcionais. Tendo em vista os dentes molares, são continuamente substituídos (polifiodontes) horizontalmente da porção caudal da mandíbula à porção rostral ao longo da vida, uma característica única entre os mamíferos. Apenas o parente vivo mais próximo dos sirênios, os elefantes, mostram característica semelhante de substituição de dentes, mas os elefantes têm um conjunto limitado desses dentes de substituição. À medida que os dentes migram rostralmente no peixe-boi, as raízes serão reabsorvidas e o esmalte fino se desgastará até que o dente finalmente caia. Chamados de dentes da bochecha, a diferenciação dos dentes do peixe-boi em molares e pré-molares não ocorreu, e os peixes-boi também não possuem incisivos ou caninos. Esses dentes migram a uma taxa de cerca de 1–2 milímetros por mês, com base nas taxas de desgaste e mastigação.[25] Além disso, as espécies do gênero Trichechus contam com aproximadamente cinquenta vértebras agrupadas em: seis cervicais, dezessete torácicas, três lombares e vinte e quatro caudais.[23] Ossos pélvicos são ausentes.[22]
A escápula do peixe-boi-da-amazônia é estreita, formando a cintura peitoral,[20] o esterno constitui-se de um único osso e por um processo lateral está dirigido para trás.[23] Compondo o membro anterior, ou seja, a nadadeira peitoral, está o úmero que nesses animais é fino e leve,[20] ao contrário de outras espécies de peixe-boi, em que ele é pesado, tendo 22,3 centímetros de comprimento. Conectados a esses ossos, estão outros curtos e quase que dos mesmo tamanho, o rádio e a ulna, com os quais quatro e um elemento que constituem o carpo estão articulados, respectivamente.[23] Conectados ao carpo estão cinco metacarpos, que diferentemente de outras espécies do gênero Trichechus, são mais compridas e como dito anteriormente, em suas extremidades as unhas estão ausentes. Seu crânio na fase adulta podem medir 360 milímetro. Os ossos nasais tem forma de discos losângicos medindo de três a seis milímetros de grossura, estendidos posteriormente, enquanto que os ossos temporais são direcionados lateralmente.[20] Algumas diferenças entre o crânio do peixe-boi-da-amazônia e do peixe-boi-africano podem ser citadas: o forame parietal está ausente no peixe-boi-da-amazônia, o qual também possui uma sutura sagital pouco desenvolvida e o forame magno estreito, quando comparado ao peixe-boi-africano.[23]
O canal nasal e a laringe formam um tubo contínuo até os pulmões, os quais são longos e cilíndricos, enquanto que o diafragma estende-se horizontalmente atrás dos rins, próximo a terceira costela indo até a pelve.[23][22] Cabe também dizer que o coração, pulmões e rins se encontram numa câmara superior, e numa inferior a bexiga, fígado, estômago e intestino, o qual tem aproximadamente 15 metros.[22] A temperatura corporal é instável variando entre 33 e 37 ºC.[26] Com relação a genética, seu cariótipo é constituído de cinquenta e seis cromossomos.[20] O peixe-boi-da-amazônia apresenta diferenças entre o macho e a fêmea, considerando sua forma corporal, exceto em seu tamanho.[17] Nas fêmeas a abertura urogenital se encontra na região ventral, próxima e anterior ao ânus. Essa abertura está ligada à vagina por uma estrutura denominada vestíbulo, canal conectado ao trato reprodutivo e urinário. Tanto à vagina quanto o vestíbulo possuem dobras que aumentam o tamanho dessas estruturas durante o acasalamento e, após a remoção do pênis, diminuem, controlando a entrada de água no útero.[27] Os machos possuem testículos achatados, estendendo-se da massa muscular pélvica até a base do abdome, não alterando de tamanho, sendo a cópula dependente da glande.[22]
Além disso, o peixe-boi-da-amazônia tem um grau muito pequeno de deflexão rostral (30,4°), que pode ser usado como uma indicação de onde na coluna d'água o animal se alimenta. Um pequeno grau de deflexão significa que a extremidade do focinho é mais reta em relação à porção caudal da mandíbula. Animais com um maior grau de deflexão, como o dugongo (Dugong dugon) em cerca de 70° de deflexão, são espécies mais bentônicas, alimentam-se do fundo do mar e têm focinhos que apontam quase completamente para o ventre. Apenas o peixe-boi-africado tem deflexão rostral menor de cerca de 25,8°. Acredita-se que isso maximize a eficiência da alimentação. Um pequeno grau de deflexão rostral permite que os peixes-boi-da-amazônia se alimentem mais efetivamente na superfície da água, onde grande parte de sua comida é encontrada.[28]
Ecologia editar
O peixe-boi-da-amazônia é o único sirênio que vive exclusivamente em habitat de água doce.[16] A espécie depende de mudanças na circulação periférica para seu principal mecanismo de termorregulação, usando esfíncteres para desviar o fluxo sanguíneo de áreas do corpo em contato próximo com a água. Eles também contam com gordura subcutânea para reduzir a perda de calor.[26] Têm narinas, não respiradouros como outros mamíferos aquáticos, que fecham quando estão debaixo d'água para manter a água fora e abrem quando estão acima da água para respirar.[29] Embora possam permanecer debaixo d'água por longos períodos, é comum subir à superfície para respirar a cada cinco minutos.[30][31] A submersão mais longa documentada de um espécime em cativeiro é de 14 minutos.[32]
Os peixes-boi-da-amazônia fazem movimentos sazonais sincronizados com o regime de cheias da bacia do rio Amazonas. Eles são encontrados em florestas inundadas e prados durante a estação das cheias, quando a comida é abundante.[33] Tem o menor grau de deflexão rostral (25° a 41°) entre os sirênios, uma adaptação para se alimentar mais perto da superfície da água.[34] É noturno e diurno e vive sua vida quase inteiramente debaixo d'água. Apenas suas narinas se projetam da superfície da água enquanto procura vegetação no fundo de rios e lagos.[35] Os peixes-boi da Amazônia e das Índias Ocidentais são os únicos peixes-boi conhecidos por vocalizar. Foram observados vocalizando sozinhos e com outros indivíduos, particularmente entre fêmeas e seus filhotes.[36]
Há uma carência de informações em relação ao comportamento e do peixe-boi-da-amazônia em vida livre. Isso pode ser atribuído às águas turvas em que vivem, mas principalmente a seus hábitos crípticos e arredios.[17] Apesar dos raros registros, são considerados animais com pouca interação entre si, com exceção das épocas reprodutivas e do cuidado parental duradouro entre mãe e filhote (em torno de dois anos), sendo que a mãe pode carregar o filhote nas costas ou abraçado junto ao corpo.[37] Embora as informações sejam insuficientes, nas áreas de forrageamento já foram avistados grupos de quatro a oito indivíduos, como também um único espécime.[38] Em cativeiro há relatos de que indivíduos foram vistos se abraçando, nadando e circulando pelo tanque juntos, além de se envolvendo em brincadeiras sexuais.[37][20]
Reprodução e ciclo de vida editar
O peixe-boi-da-amazônia se reproduz sazonalmente, tendo longo período reprodutivo que está intimamente relacionado às estações chuvosas da região amazônica. Quando o nível da água dos rios se eleva, inicia-se a cópula, entre os meses de dezembro e junho,[39][40] com cerca de 63% entre fevereiro e maio, durante uma época de aumento do nível dos rios em sua região natal.[41] Tal comportamento ocorre em águas profundas, quando o macho bate sua cauda na região genital da fêmea, como sinal para que relaxe os músculos e permita a introdução do pênis, no momento em que ela está mais receptiva, o qual dura em média de 20 a 27 dias, conforme estudos realizados em cativeiro.[42] De maneira geral, o período de gestação dos sirênios é de aproximadamente 12 a 14 meses,[43] no entanto, para o peixe-boi-da-amazônia estima-se que seu período seja de 11 a 12 meses, gerando um filhote entre os meses de fevereiro e maio, tendo baixa taxa reprodutiva.[42][41]
Ademais, as cheias na bacia Amazônica proporcionam abundância de vegetais aquáticos e semiaquáticos, tendo em vista a importância nutricional às fêmeas que tem de investir alta quantidade de energia durante a gestação e também no período de lactação, à criação de seu filhote, que serão mantidos até o período com baixo nível de água nos rios.[41] Embora a maturação sexual ocorra por volta de cinco a 10 anos, a relação mãe-filho perdura por no mínimo dois anos, permanecendo até um próximo nascimento, sendo a única interação duradoura entre os indivíduos, tendo em vista o seu hábito relativamente solitário.[22][44] Dois indivíduos viveram 12,5 anos em cativeiro.[18] Indivíduos selvagens vivem cerca de 30 anos.[35]
Alimentação editar
O peixe-boi-da-amazônia é um herbívoro não ruminante, que alimenta-se de gramíneas predominantemente aquáticas, principalmente emergentes, podendo consumir em pequenas quantidades algumas espécies terrestres, presentes nas margens dos rios. Sua alimentação é mais restrita e seletiva em épocas de cheia, porém se torna mais diversa com a menor disponibilidade dos alimentos preferenciais.[39] Se alimenta de uma variedade de macrófitas aquáticas, incluindo aroides (especialmente Pistia, também conhecida como "alface d'água"[35][45]), gramíneas, Utricularia, antóceros, ninfeáceas (Nymphaeaceae) e, particularmente, jacintos-de-água (Pontederia crassipes).[46] Também são conhecidos por comer frutos de palmeira que caem na água.[35] Segundo análises estomacais feitas em 1981, 96% das amostras continham a gramínea Paspalum repens e a macrófita canarana capim-angola (Echinochloa polystachya), sugerindo que estão entre as mais consumidas.[47]
A quantidade vegetal ingerida corresponde a cerca de 8% de seu peso corporal por dia, sendo que 45 a 70% do que é consumido é absorvido pelo organismo para transformação em energia. Possui também importante função na ciclagem de nutrientes do ecossistema, visto que seus excrementos contém compostos nitrogenados em abundância, o que auxilia na manutenção da produção primária, como o desenvolvimento de fitoplânctons e crescimento de macrófitas, por exemplo.[39][40] Por manter uma dieta herbívora, tem processo digestivo pós-gástrico semelhante ao do cavalo.[34] Durante a estação seca de julho a agosto, quando os níveis de água começam a cair, algumas populações ficam restritas às partes profundas de grandes lagos, onde geralmente permanecem até o final da estação seca em março. Acredita-se que jejue durante esse período, suas grandes reservas de gordura e baixas taxas metabólicas – apenas 36% da taxa metabólica normal dos mamíferos placentários – permitindo que sobrevivam por até sete meses com pouca ou nenhuma comida.[33]
População e distribuição editar
Em 1977, a contagem da população do peixe-boi-da-amazônia foi estimada em cerca de 10 mil. A partir de agora, a contagem total da população é indeterminada, no entanto, a tendência da população parece estar diminuindo. Estão distribuídos principalmente por toda a bacia do Amazonas no norte da América do Sul, desde a ilha de Marajó, no Brasil, até a Colômbia, Peru e Equador. São ocasionalmente encontrados sobrepostos ao peixe-boi-marinho ao longo da costa do Brasil.[33] Ocorre na maior parte da drenagem do Amazonas, desde as cabeceiras, na Colômbia, Equador e Peru até a foz do Amazonas (perto da ilha de Marajó) no Brasil, em cerca de sete milhões de quilômetros quadrados. No entanto, sua distribuição é irregular, concentrando-se em áreas de floresta alagada rica em nutrientes, que abrange cerca de 300 mil quilômetros quadrados; também são encontrados em águas calmas e rasas, longe de assentamentos humanos.[2]
É completamente aquático e nunca sai da água.[33] É o único peixe-boi que ocorre exclusivamente em ambientes de água doce. Prefere lagos remansos, arcos marginais e lagoas com profundas conexões com grandes rios e abundante vegetação aquática.[48] São principalmente solitários, mas às vezes se reúnem em pequenos grupos de até oito indivíduos.[44] Se envolvem em longos movimentos sazonais, movendo-se de áreas alagadas durante a estação chuvosa para corpos d'água profundos durante a estação seca.[2] Predadores naturais incluem onças-pintadas (Panthera onca), tubarões e crocodilos.[35]
Aspectos históricos e culturais editar
Apesar da alta taxa de preservação que se encontra atualmente no bioma amazônico, este ambiente passou por apropriação de seus recursos naturais de forma insustentável, impostas por políticas públicas inadequadas e ultrapassadas, característicos da época.[49] Nessa significável apropriação e uso de diversos recursos pertencentes à Amazônia, também se encontra a interação com diferentes tipos de animais silvestres ali presentes.[50] De início, por volta de 1850, o peixe-boi-da-amazônia fora utilizado pelos colonos para fins alimentares, tendo valorização formidável de sua carne cozida em sua própria banha, que é chamada de mixira, seguido do seu couro. Quase um século depois, por volta de 1930, o preço do couro do peixe-boi-da-amazônia fora mais alto por uma faixa de tempo pela intensa utilização desse recurso nas indústrias pelo Brasil e mundo, auxiliando na confecção de produtos como exemplo de polias, mangueiras, correias de transmissão, entre outros fins.[38]
Na década de 1960, mais especificamente em 1967, fora criada a Lei de Proteção à Fauna Silvestre no Brasil (Lei N.° 5.197) que, em outras palavras, proibia, majoritariamente, a caça, pesca e venda de animais silvestres naturais do Brasil, sendo considerada a primeira lei de proteção efetiva ao peixe-boi-da-amazônia por atingi-lo diretamente. Nas décadas posteriores foi redobrada a atenção em relação ao peixe-boi-da-amazônia por conta do decaimento no número de indivíduos na bacia amazônica, sendo em 1982 considerada espécie vulnerável pela União Internacional para a Conservação da Natureza (UICN / IUCN) em sua Lista Vermelha. Já ameaçado de extinção, o Brasil decretou mais leis de proteção à fauna nativa na década de 1990.[50]
O peixe-boi-da-amazônia possui enorme importância cultural na região, não só por ser fonte de alimento local que perpetuou muitas gerações da população ribeirinha e que hoje vem sendo estimulada a não consumir mais esse tipo de carne, mas também participa de muitos mitos e lendas na Amazônia sendo a sua existência importante à etnoconservação desses aspectos regionalmente.[51] Muitas dessas lendas remetem ao surgimento do peixe-boi-da-amazônia. Numa delas, denominada "A festa da moça nova", se destaca como ritual de iniciação feminina que acontece quando a menina menstrua pela primeira vez:[52] Certa vez, numa dessas festas, o pajé da tribo desconfiou que a menina já estava namorando um rapaz da tribo e como castigo, durante a festa, mandou que ambos mergulhassem no rio e jogou sobre eles duas talas de canarana enfeitiçadas, e quando o casal emergiu já haviam se transformado em peixes-boi.[51] Dentre dezenas de outras crenças que circulam na região, se encontra a crença de que a carne do peixe-boi possui poderes afrodisíacos e, além disso, capaz de curar diversas enfermidades que atingem o ser humano, sendo bastante vendida em feiras regionais.[51]
Ameaças e conservação editar
Ameaças editar
No planeta, habitou-se 36 espécies registradas de sirênios,[10] porém atualmente existem apenas quatro espécies (consideradas vulneráveis de extinção pela UICN), incluindo o peixe-boi-da-amazônia.[2] Desde 1542, a espécie tem sofrido com a caça na Amazônia.[53] Inicialmente, sua carne (mixira) era destinada somente para subsistência das tribos indígenas presentes na região. No entanto, com a chegada da indústria de couro (1935 a 1954), a espécie sofreu com caças descontroladas, alcançando em torno de quatro a sete mil peixes-boi mortos por ano. Estima-se que mais de 140 mil peixes-boi foram mortos.[2] O couro era utilizado como material para produção de couro mais resistente.[54] As caças deixaram de ser frequente a partir de 1954, quando o couro sintético começou a chegar no mercado. As caças, então, deixaram de ser para extração de couro e voltaram para subsistência.[17]
O consumo de mixira é comum na Amazônia, sendo a principal fonte de proteína da população ribeirinha. Fêmeas prenhas ou paridas são alvos preferenciais dos caçadores pois fornecem, além do filhote, maior quantidade banha para consumo. Essa prática é uma das ameaças enfrentadas pela espécie nas últimas décadas.[10] Em 1986, estimou-se que os níveis de caça no Equador eram insustentáveis e que ela desapareceria deste país dentro de 10 a 15 anos.[46] Apesar das leis contra a caça em vigor, a caça continua ocorrendo mesmo em áreas protegidas. Os arpões tradicionais são a arma mais comum usada contra os peixes-boi, mas no Equador também são conhecidos por serem capturados em armadilhas para peixes Arapaima. Entre 2011 e 2015, 195 peixes-boi foram mortos para consumo numa única região do Brasil. Em outra região, 460 foram mortos numa área protegida entre 2004 e 2014.[2] No Peru, experimentaram grande parte de seu declínio devido à caça por populações humanas para obtenção de carne, gordura, pele e outros materiais. Essa caça é realizada com arpões, redes de emalhar e armadilhas. Grande parte dessa caça ocorre nos lagos e riachos próximos à Reserva Nacional Pacaia-Samiria, no nordeste do país.[32]
Outra ameaça contra os peixes-boi é a destruição e degradação ambiental, causadas pelo aumento de tráfegos de grandes cargueiros e pelas atividades petroquímicas (extração e transporte de óleo e gás).[2] O setor hidroviário está sendo bastante intensificado em decorrência de aumento da ocupação humana e, com isso, maior procura pela proteína animal. Além disso, existem outras ameaças que também afetam diretamente o peixe-boi: atividades impactantes das mineradoras e do garimpo (a liberação indiscriminada de mercúrio); a contaminação por agrotóxicos e fertilizantes; afogamento acidental em redes de pesca comercial; degradação da vegetação pela erosão do solo resultante do desmatamento; e os programas agropecuários em larga escala, como o plantio de soja na Amazônia e a criação de búfalos em áreas de várzea. Em síntese, as ameaças contra o peixe-boi-da-amazônia são: caça indiscriminada e comercial, caça de subsistência, alteração e destruição dos habitats, emalhes, colisões com embarcações, ingestão de lixo, poluição sonora, mudanças climáticas, doenças e risco de problemas genético.[10][33]
Conservação editar
Não há planos nacionais de manejo do peixe-boi-da-amazônia, exceto na Colômbia. Em 2008, o Instituto Nacional de Pesquisas da Amazônia (INPA) cuidava de 34 peixes-boi cativos e o Centro de Preservação e Pesquisa de Mamíferos Aquáticos (CPPMA) cuidava de 31.[2] O peixe-boi é protegido pela lei peruana desde 1973, por meio do Decreto Supremo 934-73-AG, que proíbe a caça e o uso comercial.[32] Em 2007, foi classificado como em perigo na Lista de espécies de flora e fauna ameaçadas de extinção do Estado do Pará;[55] como vulnerável na Portaria MMA N.º 444 de 17 de dezembro de 2014;[56] em 2018, como vulnerável no Livro Vermelho da Fauna Brasileira Ameaçada de Extinção do Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio);[57] e em 2022, como vulnerável no anexo dois (mamíferos) da Lista Oficial da Fauna Brasileira Ameaçada de Extinção da Portaria MMA N.º 148, de 7 de junho de 2022.[58][59] Em 2013, foi incluído no anexo I da Convenção sobre o Comércio Internacional das Espécies Silvestres Ameaçadas de Extinção (CITES), que trata de espécies ameaçadas de extinção.[60]
Há várias instituições ligadas à conservação de mamíferos aquáticos que possuem iniciativas de cuidados de filhotes órfãos em decorrência de caça ilegal. O Laboratório de Mamíferos Aquáticos (LMA/INPA), por exemplo, desenvolveu leite com fórmula específica para esses filhotes. Outras instituições além do LMA, como Centro de Pesquisas e Preservação dos Mamíferos Aquáticos (CPPMA/Manaus Energia S.A.) e Centro de Mamíferos Aquáticos (CMA/ICMBio), atuaram no resgate e reabilitação de filhotes órfãos, somando ao todo 70 indivíduos abrigados. O Instituto de Desenvolvimento Sustentável Mamirauá (IDSM) também teve essa iniciativa, porém abrigou os órfãos em tanque flutuante no ambiente natural, com a participação da comunidade local. Quando os indivíduos chegam à fase de subadultos, são reintroduzidos na natureza; como em 2007, o CMA realizou soltura de um macho e uma fêmea subadultos no entorno de Santarém (Pará), a fêmea foi monitorada. Outro caso é a reintrodução monitorada de dois machos pelo INPA (Instituto de Pesquisa Amazônica) em 2008.[10] O caso de maior destaque pelo número de indivíduos soltos aconteceu em 2019, graças ao CMA, INPA e AMPA (Associação Amigos do Peixe-Boi). Essa soltura foi feita com 12 indivíduos na Reserva de Desenvolvimento Sustentável (RDS) Pigaçu-Purus, onde teve recepção da comunidade local.[61][62]
Além da reabilitação de filhotes, outra medida que é tomada em prol à conservação dos peixes-boi é a parceria entre centros de pesquisa e unidades de conservação (UCs). Centros de pesquisas (como CMA, LMA e outros) são essenciais porque fornecem informações sobre peixes-boi-da-Amazônia (consideradas espécies-bandeira em certas UCs), e as unidades de conservação, por sua vez, utilizam esses conhecimentos aplicando nos manejos necessários para a conservação desses animais. A Reserva Extrativista de Tapajós-Arapiuns, por exemplo, é uma área que, graças à sua parceria com CMA, é relevante na preservação do peixe-boi-da-amazônia. O apoio da comunidade local é a parte mais importante do processo, como aponta Luna e colaboradores:[63][10]
| “ | A comunidade de Anumã, localizada à margem oeste do rio Tapajós, aderiu à causa de maneira plena, graças ao empenho da equipe coordenada pelo CMA/ICMBio, que conseguiu sensibilizar a comunidade de maneira a envolvê-la no processo. Hoje todos em Anumã sabem a importância de preservar a natureza, colaboram com a unidade de conservação e com as atividades do CMA/ICMBio. A comunidade é a parte mais importante do processo de gestão. | ” |
Referências
- ↑ Shoshani, Jeheskel (2005). «Trichechus inunguis». In: Wilson, D. E.; Reeder, D. M. Mammal Species of the World: A Taxonomic and Geographic Reference 3.ª ed. Baltimore, Marilândia: Imprensa da Universidade Johns Hopkins. p. 93. ISBN 0-801-88221-4. OCLC 62265494. Consultado em 15 de abril de 2023
- ↑ a b c d e f g h Marmontel, M.; de Souza, D.; Kendall, S. (2016). «Trichechus inunguis». Lista Vermelha de Espécies Ameaçadas. 2016: e.T22102A43793736. doi:10.2305/IUCN.UK.2016-2.RLTS.T22102A43793736.en . Consultado em 11 de novembro de 2021
- ↑ «Conservação do peixe-boi-amazônico». Instituto de Pesquisas Ecológicas (IPE). Consultado em 7 de maio de 2023. Cópia arquivada em 19 de março de 2022
- ↑ Ferreira, Aurélio Buarque de Holanda (1986). Novo dicionário da língua portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 873
- ↑ Ferreira, Aurélio Buarque de Holanda (1986). Novo dicionário da língua portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 1296
- ↑ Osorio, Giorgina. Enciclopedia Vida Na Terra - Mamiferos Marinhos. Sintra: Euroimpala. p. 52
- ↑ Almaça, Carlos (1998). Baleias, focas e peixes-bois na História Natural Portuguesa (PDF). Lisboa: Fundação para a Ciência e Tecnologia, Museu Bocage, Museu Nacional de História Natural. Consultado em 7 de abril de 2023. Cópia arquivada (PDF) em 7 de maio de 2023
- ↑ Grande Dicionário Houaiss, verbete guaraguá
- ↑ Grande Dicionário Houaiss, verbete manati e manatim
- ↑ a b c d e f Plano de Ação Nacional para Conservação dos Sirênios (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 2011. p. 79. Consultado em 6 de maio de 2023. Cópia arquivada (PDF) em 6 de maio de 2023
- ↑ a b Marsh, Helene; O'Shea, Thomas J.; Reynolds III, John E. (2012). Ecology and Conservation of the Sirenia: Dugongs and Manatees. Nova Iorque: Imprensa da Universidade de Cambrígia. pp. 521p. Consultado em 6 de maio de 2023
- ↑ «Trichechus inunguis (Natterer, 1883)». Integrated Taxonomic Information System (ITIS). Consultado em 6 de maio de 2023. Cópia arquivada em 6 de maio de 2023
- ↑ Tabuce, Rodolphe; Asher, Robert J.; Lehmann, Thomas (2008). «Afrotherian mammals: a review of current data». Mammalia. Consultado em 6 de maio de 2023
- ↑ Vianna, Juliana A.; Bonde, Robert K.; Caballero, Susana; Giraldo, Juan Pablo; Lima, Régis P.; Clark, Annmarie; Marmontel, Míriam; Morales‐Vela, Benjamín; Souza, Maria José De; Parr, Leslee; Rodríguez‐Lopez, Marta A. (2006). «Phylogeography, phylogeny and hybridization in trichechid sirenians: implications for manatee conservation». Molecular Ecology (em inglês). 15 (2): 433–447. ISSN 1365-294X. PMID 16448411. doi:10.1111/j.1365-294X.2005.02771.x. Consultado em 15 de abril de 2023
- ↑ Domning, Daryl P. (maio de 1982). «Evolution of manatees: a speculative history» (PDF). Journal of Palentology. 56 (3): 599-619. Consultado em 6 de maio de 2023. Cópia arquivada (PDF) em 10 de fevereiro de 2010
- ↑ a b Amaral, Rodrigo S.; Silva, VeraVera M. F. da; Rosas, Fernando César Weber Rosas (27 de outubro de 2010). «Body weight/length relationship and mass estimation using morphometric measurements in Amazonian manatees Trichechus inunguis (Mammalia: Sirenia)». Marine Biodiversity Records. 3 (e105). 4 páginas. doi:10.1017/s1755267210000886
- ↑ a b c d Rosas, Fernando Cesar Weber (1994). «Biology, conservation and status of the Amazonian Manatee Trichechus inunguis». Mammal Review. 24 (2): 49–59. doi:10.1111/j.1365-2907.1994.tb00134.x. Consultado em 6 de maio de 2023. Cópia arquivada em 13 de abril de 2021
- ↑ a b c «Animal Info - Amazonian Manatee». Animal Info. Animal Info. Consultado em 6 de maio de 2023. Cópia arquivada em 3 de fevereiro de 2023
- ↑ «Manatees». Canisius Ambassadors for Conservation, Institute for the Study of Human-Animal Relations. Consultado em 6 de maio de 2023. Cópia arquivada em 22 de outubro de 2019
- ↑ a b c d e f Husar, S. L. (1977). «Trichechus inunguis». Mammalian Species (72): 01-04
- ↑ Ronald, K.; Selley, L. J.; Amoroso, E. C. (1978). «Biological Synopsis of the Manatee». International Development Research Centre (IDRC). Consultado em 6 de maio de 2023
- ↑ a b c d e f Barrett, O. W. (agosto de 1935). «Notes concerning Manatees and Dugongs». Journal of Mammalogy. 16 (3): 216–220. Consultado em 7 de maio de 2023. Cópia arquivada em 23 de dezembro de 2022
- ↑ a b c d e f g Quiring, D. P.; Harlan, C. F. (maio de 1953). «On the anatomy of the Manatee». Journal of Mammalogy. 34 (2): 192-203. Consultado em 6 de maio de 2023. Cópia arquivada em 10 de março de 2022
- ↑ Phillips, Craig (1964). The Captive Sea: Life Behind the Scenes of the Great Modern Oceanariums. Sudbury, Massachussetes: Chilton Books. Consultado em 6 de maio de 2023
- ↑ Domning, D. P.; Hayek, L. C. (1984). «Horizontal tooth replacement in the Amazonian Manatee (Trichechus inunguis)». Mammalia. Consultado em 6 de maio de 2023
- ↑ a b Gallivan, G. J.; Beste, R. C.; Kanwisher, J. W. (1983). «Temperature regulation on the Amazonian Manatee Trichechus inunguis». Physiological Zoology. 56 (2). Consultado em 6 de maio de 2023. Cópia arquivada em 6 de maio de 2023
- ↑ RODRIGUES, F. R. (27 de março de 2008). «Reproductive Anatomy of the Female Amazonian Manatee Trichechus inunguis Natterer, 1883 (Mammalia: Sirenia)». Reproductive Biology. Consultado em 6 de maio de 2023. Cópia arquivada em 4 de setembro de 2022
- ↑ Domning, D. P.; Morgan, G. S.; Ray, C. E. (1982). «North American Eocene Sea Cowe (Mammalia: Sirenia)» (PDF). Smithsonian Contributions to Paleobiology (52): 1–69. doi:10.5479/si.00810266.52.1. Consultado em 7 de maio de 2023. Cópia arquivada (PDF) em 12 de março de 2022
- ↑ «Facts about Manatees». Manatee World. 2014. Consultado em 8 de dezembro de 2014. Cópia arquivada em 7 de abril de 2023
- ↑ «Manatee Trichechus». National Geographic. 11 de novembro de 2010. Consultado em 8 de dezembro de 2014. Cópia arquivada em 1 de fevereiro de 2023
- ↑ Gallivan, G. J.; Best, R. C. (1980). «Metabolism and Respiration of the Amazonian Manatee (Trichechus inunguis)». Physiological Zoology. 53 (3): 245–253. JSTOR 30155787. doi:10.1086/physzool.53.3.30155787. Consultado em 7 de maio de 2023
- ↑ a b c Reeves, Randall R.; Leatherwood, Stephen; Jefferson, Thomas A.; Curry, Barbara E.; Henningsen, Thomas. «Amazonian Manatees, Tricheus inunguis, In Peru: Distribution, Exploitation, and Conservation Status» (PDF). Consultado em 20 de outubro de 2014
- ↑ a b c d e «Amazonian manatee distribution and population». Sociedade Zoológica de Londres. Consultado em 7 de maio de 2023
- ↑ a b Pazin-Guterres, Michelle (2014). «Feeding Ecology of the Amazonian Manatee (Trichechus inunguis) in the Mamirauá and Amanã Sustainable Development Reserves, Brazil». Aquatic Mammals. 40 (2): 139–149. doi:10.1578/AM.40.2.2014.139. Consultado em 7 de maio de 2023
- ↑ a b c d e Gorog, Antonia (1999). «Trichechus inunguis». Animal Diversity Web. Museu de Zoologia da Universidade de Michigão. Consultado em 9 de abril de 2014. Cópia arquivada em 26 de abril de 2023
- ↑ Bullock, Theodore H.; Domning, Daryl P.; Best, Robin C. (1980). «Evoked Brain Potentials Demonstrate Hearing in a Manatee (Trichechus inunguis)». Journal of Mammalogy. 61 (1): 130–133. JSTOR 1379969. doi:10.2307/1379969. Consultado em 7 de abril de 2023. Cópia arquivada em 18 de dezembro de 2022
- ↑ a b Mohr, Erna (1957). Sirenen oder Seekühe. Vitemberga: Die Neue Brehm-Bücherei. p. 61. Consultado em 7 de maio de 2023
- ↑ a b Pereira, Munes (1944). «O Peixe-boi da Amazônia». Rio de Janeiro. Boletim do Ministério da Agricultura. 33: 21-95
- ↑ a b c Best, R. C. (março de 1981). «Foods and feeding habits of wild and captive Sirenia». Mammal Review. 11 (1): 3-29. Consultado em 7 de maio de 2023. Cópia arquivada em 27 de março de 2022
- ↑ a b Best, R. C. (1984). «The aquatic mammals and reptiles of the Amazon». Monographiae Biologicae. Consultado em 7 de maio de 2023
- ↑ a b c Best, R. C. (1982). «Seasonal breeding in the Amazonian Manatee, Trichechus inunguis (Mammalia: Sirenia)». Biotropica. 14 (01): 76-78. Consultado em 7 de maio de 2023
- ↑ a b Nascimento, Cláudia Carvalho do (2004). Avaliação da função reprodutiva de fêmeas de Peixe-boi da Amazônia (Trichechus inunguis Natterer, 1883), mantidas em cativeiro, por meio da extração e dosagem de esteróides fecais (PDF) (Dissertação de Mestrado). Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo. Consultado em 7 de maio de 2023. Cópia arquivada (PDF) em 26 de julho de 2020
- ↑ Hartman, D. S. (1971). Behaviour and ecology of the Florida manatee, Trichechus maniatus latirostris (Harlan), at Crystal River, Citrus Country (Tese de Douturado). Ítaca, Nova Iorque: Universidade Cornell. pp. 1–285
- ↑ a b «Amazonian Manatee». The Animal Files. Consultado em 24 de outubro de 2014. Cópia arquivada em 8 de março de 2022
- ↑ «Amazon manatee». WWF - World Wide Fund For Nature. 2017. Consultado em 29 de março de 2018. Cópia arquivada em 6 de maio de 2016
- ↑ a b Timm, Robert M.; Albuja, Luis; Clauson, Barbara L. (1986). «Ecology, Distribution, Harvest, and Conservation of the Amazonian Manatee Trichechus inunguis in Ecuador». Biotropica. 18 (2): 150–156. JSTOR 2388757. doi:10.2307/2388757. Consultado em 7 de maio de 2023
- ↑ Colares, Ioni G.; Colares, Elton P. (2002). «Food Plants Eaten by Amazonian Manatees (Trichechus inunguis, Mammalia: Sirenia)». Brazilian Archives of Biology and Technology. 45 (1). Consultado em 7 de maio de 2023
- ↑ «Images and movies of the Amazonian manatee (Trichechus inunguis)». ARKive. Cópia arquivada em 24 de abril de 2022
- ↑ Freitas, Marcílio de (2003). «A Ilusão da Sustentabilidade». Manaus: Editora da Universidade Federal do Amazonas (EDUA)
- ↑ a b Zaniolo, G. F. (2006). Etnoconhecimento do peixe-boi amazônico Trichechus inunguis (Natterer, 1883) pelos pescadores de Novo Airão, Amazonas, Brasil (PDF) (Dissertação de Mestrado em Ciências do Ambiente e Sustentabilidade na Amazônia). Amazonas: PPG/ CASA, da Universidade Federal do Amazonas. Consultado em 7 de maio de 2023. Cópia arquivada (PDF) em 7 de maio de 2023
- ↑ a b c Anaissi, C. B. (2019). Peixe-boi da Amazônia - Lendas, mitos e crenças como meios para etnoconservação (PDF) (Trabalho de Conclusão de Curso). Florianópolis: Universidade Federal de Santa Catarina. Cópia arquivada (PDF) em 7 de maio de 2023
- ↑ Filho, E. T. M. (2015). A Festa da Moça Nova: Ritual de iniciação feminina dos índios Ticuna (PDF) (Tese de Doutorado em Antropologia). São Paulo: Faculdade de Filosofia, Letras e Ciências Humanas, Departamento de Antropologia, Universidade de São Paulo. Cópia arquivada (PDF) em 26 de fevereiro de 2022
- ↑ Sioli, Harald (1984). The Amazon: Limnology and Landscape Ecology of a Mighty Tropical River and Its Basin. Berlim: Springer Science & Business Media. pp. 371–412. Consultado em 7 de maio de 2023. Cópia arquivada em 28 de julho de 2021
- ↑ Domning, Daryl (1 de fevereiro de 1982). «Commercial Exploitation of Manatees Trichechus in Brazil c. 1785-1973». Biological Conservation. 22 (2): 101-126. Consultado em 7 de maio de 2023
- ↑ Extinção Zero. Está é a nossa meta (PDF). Belém: Conservação Internacional - Brasil; Museu Paraense Emílio Goeldi; Secretaria do Estado de Meio Ambiente, Governo do Estado do Pará. 2007. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 2 de maio de 2022
- ↑ «PORTARIA N.º 444, de 17 de dezembro de 2014» (PDF). Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente (MMA). Consultado em 24 de julho de 2021. Cópia arquivada (PDF) em 12 de julho de 2022
- ↑ «Livro Vermelho da Fauna Brasileira Ameaçada de Extinção» (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 2018. Consultado em 3 de maio de 2022. Cópia arquivada (PDF) em 3 de maio de 2018
- ↑ «Portaria MMA N.º 148, de 7 de junho de 2022» (PDF). Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente (MMA). Consultado em 14 de abril de 2023. Cópia arquivada (PDF) em 1 de março de 2023
- ↑ «Trichechus inunguis (Natterer, 1883)». Sistema de Informação sobre a Biodiversidade Brasileira (SiBBr). Consultado em 7 de maio de 2023. Cópia arquivada em 7 de maio de 2023
- ↑ «Instrução Normativa MMA N.º 01, de 15 de abril de 2014» (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 15 de abril de 2014. Cópia arquivada (PDF) em 26 de outubro de 2022
- ↑ «CMA participa da soltura de 12 peixes-bois amazônicos». Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 3 de abril de 2019. Consultado em 7 de maio de 2023. Cópia arquivada em 4 de dezembro de 2019
- ↑ «Com apoio da Sema, RDS Piagaçu-Purus recebe maior soltura de peixes-bois da Amazônia». Governo do Estado do Amazonas. 25 de março de 2019. Consultado em 7 de maio de 2023. Cópia arquivada em 4 de dezembro de 2019
- ↑ «Resex Tapajós-Arapiuns». Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. Consultado em 7 de maio de 2023. Cópia arquivada em 16 de setembro de 2020
Ligações externas editar
- «Centro Nacional de Pesquisa e Conservação de Mamíferos Aquáticos». Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio). Consultado em 6 de maio de 2023. Cópia arquivada em 4 de dezembro de 2022
- «Plano de Ação Nacional para a Conservação de Mamíferos Aquáticos Amazônicos». Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio). Consultado em 6 de maio de 2023. Cópia arquivada em 21 de janeiro de 2022
