Pentraxinas
As pentraxinas, também conhecidas como pentaxinas, são uma família conservada evolutivamente de proteínas caracterizadas por um domínio proteico de pentraxina. As proteínas da família da pentraxina são envolvidas em respostas imune agudas.[1] Elas são conhecidas como proteínas de fase aguda (APP) por mais de um século.[2]
| Família das pentraxinas | |
|---|---|
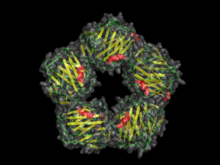
| CRP drawn from PDB 1B09 | |
| Indicadores | |
| Símbolo | Pentraxina |
| Pfam | PF00354 |
| InterPro | IPR001759 |
| SCOP | 1sac |
| Estruturas PDB disponíveis: 1limD:32-237 2a3wF:26-219 2a3xH:26-219 1lgnC:26-219 2a3yD:26-219 1gykA:26-219 1sacC:26-219 1hasB:29-222 1crvE:25-220 1lj7D:25-220 1b09C:25-220 1gnhA:25-220 | |
Estrutura editar
As pentranias são caracterizadas pela dependência de cálcio para ligação e uma estrutura chama em inglês de "flattened β-jellyroll", semelhante à de lectinas de legumes.[3] O nome "pentraxina" é derivado das palavras gregas para 5 (penta) e frutas silvestres (ragos), devido a simetria radial de 5 monômeros formando um anel de 95Å de diâmetro e 35Å de profundidade nos primeiros membros identificados. As pentraxinas "curtas" incluem o componente amiloide sérico P (SAP) e a proteína C reativa (CRP).As pentraxinas "longas" incluem PTX3 (uma molécula modulada por citocinas) e diversas pentraxinas neuronais.
Membros da família editar
3 dos principais membtros da família são proteínas séricas: a proteína C reativa (CRP),[4] o componente amiloide sérico P (SAP),[5] e a proteína de fêmea (FP).[6] A proteína PTX3 (ou TSG-14) é uma proteína induzida por citocina homóloga à CRP, mas sem função conhecida.
Proteína C-reativa editar
A proteína C reativa é expressa durante a fase aguda de resposta ao dano tissular ou inflamação em mamíferos. A proteína assemelha-se a anticorpos e executa diversas funções associadas com a defesa do hospedeiro: promoção de aglutinação, inchaço da capsula bacteriana e fagocitose, além de ativar a via cássica do complemento através da sua ligação dependente de cálcio à fosfocolina.[4] CRPs já foram sequenciadas em um invertebrado, Limulus polyphemus, onde constituem parte normal da hemolinfa
Componente amiloide sérico P editar
Componente amiloide sérico P é uma proteína de vertebrados idêntica às formas tissulares do componente amiloide P. Ele é encontrado em todos os tipos de depósitos amiloides, na mebrana basal glomerular e em fibra elásticas nos vasos sanguíneos. SAP liga-seà diversos ligantes de lipoproteínas de forma dependente de cálcio e foi sugerido que, em mamíferos, isso pode ter implicações importantes na aterosclerose e na amiloidose..[5]
Proteína de fêmea de hamster editar
A proteína de fêmea de hamster é homóloga ao SAP e é encontrada em Mesocricetus auratus (Hamster sírio). A concentração dessa proteína é alterada por esteroides sexuais.[6]
Sistema nervoso editar
Pentraxinas expressas no sistema nervoso são as pentraxinas neurais I (NPTXI) e II (NPTXII).[7] NPTXI e NPTXII são homólogas e podem coexistir em uma mesma espécie. Sugere-se que ambas as proteínas medeiem a captação de macromoléculas sinápticas e participem da plasticidade sináptica. A apexina, uma proteína espermática acrossomal, é um homólogo de NPTXII encontrada em Cavia porcellus (Porquinho-da-índia).[8]
Humano editar
Genes humanos codificando proteínas que contém esse domínio incluem:
- APCS
- CRP
- GPR144
- NPTX1; NPTX2; NPTXR
- PTX3
- SVEP1
Referências
- ↑ Gewurz H, Zhang XH, Lint TF (1995). «Structure and function of the pentraxins». Curr. Opin. Immunol. 7 (1): 54–64. PMID 7772283. doi:10.1016/0952-7915(95)80029-8
- ↑ Martinez de la Torre, Y; Fabbri, M (1 de maio de 2010). «Evolution of the pentraxin family: the new entry PTX4.». Journal of immunology. 184 (9): 5055-64. PMID 20357257. doi:10.4049/jimmunol.0901672
- ↑ Emsley J, White HE, O'Hara BP, Oliva G, Srinivasan N, Tickle IJ, Blundell TL, Pepys MB, Wood SP (janeiro de 1994). «Structure of pentameric human serum amyloid P component». Nature. 367 (6461): 338–45. PMID 8114934. doi:10.1038/367338a0
- ↑ a b Romero IR, Morris C, Rodriguez M, Mold C, Du Clos TW (1998). «Inflammatory potential of C-reactive protein complexes compared to immune complexes». Clin. Immunol. Immunopathol. 87 (2): 155–162. PMID 9614930. doi:10.1006/clin.1997.4516
- ↑ a b Yutani C, Shimokado K, Li XA (1998). «Serum amyloid P component associates with high density lipoprotein as well as very low density lipoprotein but not with low density lipoprotein». Biochem. Biophys. Res. Commun. 244 (1): 249–252. PMID 9514915. doi:10.1006/bbrc.1998.8248
- ↑ a b Coe JE, Ross MJ (1997). «Electrophoretic polymorphism of a hamster pentraxin, female protein (amyloid P component)». Scand. J. Immunol. 46 (2): 180–182. PMID 9583999. doi:10.1046/j.1365-3083.1997.d01-109.x
- ↑ Perin MS, Omeis IA, Hsu YC (1996). «Mouse and human neuronal pentraxin 1 (NPTX1): conservation, genomic structure, and chromosomal localization». Genomics. 36 (3): 543–545. PMID 8884281. doi:10.1006/geno.1996.0503
- ↑ Reid MS, Blobel CP (1994). «Apexin, an acrosomal pentaxin». J. Biol. Chem. 269 (51): 32615–32620. PMID 7798266