Zwitterion
Zwitterion, do alemão "zwitter" (híbrido), "sal interno" ou "íon dipolar" é um composto químico eletricamente neutro, mas que possui cargas opostas em diferentes átomos. O termo é mais utilizado em compostos que apresentam essa cargas em átomos não-adjacentes.[1] Podem se comportar como ácidos ou bases, portanto são anfóteros.

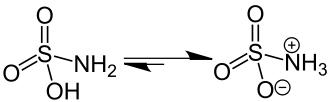
Os aminoácidos, por exemplo, se comportam como ácido por causa do grupo carboxila (-COOH) e como bases por causa do grupo amina (NH2). Isso possibilita a reação da parte ácida com a parte básica, gerando um sal. Como ela se dá no mesmo composto, o sal formado é chamado de "sal interno".[2]
Amino ácidos editar
O equilíbrio é estabelecido em duas etapas. Em um estágio, um próton é transferido do grupo carboxila para uma molécula de água.
- H
2N(R)CO
2H + H
2O H
2N(R)CO–
2 + H
3O+
No outro estágio, um próton é transferido do íon hidrônio para o grupo amina.
- H
2N(R)CO–
2 + H
3O+
H
3N+
(R)CO–
2 + H
2O
No geral, a reação é uma reação de isomerização.
- H
2N(R)CO
2H H
3N+
(R)CO–
2
A razão das concentrações das duas espécies em solução é independente do pH, pois é igual ao valor da constante de equilíbrio K para a reação de isomerização.
[X] representa a concentração de compostos químicos X em equilíbrio. Foi sugerido, com base em analises teóricas que o zwitterion se estabiliza em solução aquosa por ligações de hidrogênio com moléculas de água como solventes.[3]
Usando o zwitter ion de histidina como exemplo, uma interação ânion-ânion do tipo ânion carboxilato-tetróxido foi descoberta pela primeira vez.[4]
Exemplos editar
Ver também editar
Referências
- ↑ IUPAC Gold Book. (em inglês)
- ↑ portalmodulo.com
- ↑ Jensen, Jan H.; Gordon, Mark S. (1995). «On the Number of Water Molecules Necessary to Stabilize the Glycine Zwitterion». Journal of the American Chemical Society. 117 (31): 8159–8170. doi:10.1021/ja00136a013
- ↑ Novikov, Anton P.; Safonov, Alexey V.; German, Konstantin E.; Grigoriev, Mikhail S. (1 de dezembro de 2023). «What kind of interactions we may get moving from zwitter to "dritter" ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate». CrystEngComm (em inglês). ISSN 1466-8033. doi:10.1039/D3CE01164J. Consultado em 9 de dezembro de 2023