Glicina
| Glicina Alerta sobre risco à saúde[1] | |
|---|---|
|
|
|
|
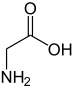
| Nome IUPAC | Glicina Ácido 2-aminoacético |
| Outros nomes | Ácido aminoetanóico |
| Identificadores | |
| Abreviação | Gly, G |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C2H5NO2 |
| Massa molar | 75.06 g mol-1 |
| Aparência | sólido branco |
| Densidade | 1,1607 g/cm3 |
| Ponto de fusão |
233 °C (decomposição) |
| Solubilidade em água | 25 g/100 mL |
| Solubilidade | solúvel em etanol, piridina insolúvel em éter |
| Acidez (pKa) | 2,32 |
| Riscos associados | |
| LD50 | 2600 mg/kg (ratos, oral) |
| Compostos relacionados | |
| Aminoácidos relacionados | Alanina (2-amino-propanoico) Beta-alanina (3-amino-propanoico) Alfa-fenilglicina Sarcosina (N-metil glicina) |
| Compostos relacionados | Ácido carbâmico (NH2COOH) Ácido glicólico (hidroxiacético) Etanolamina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A glicina (do grego glykos, "doce", nome devido ao seu sabor adocicado[2]) é um dos aminoácidos codificados pelo código genético, sendo, portanto, um dos componentes das proteínas dos seres vivos. É codificado pelos codões GGU, GGC, GGA e GGG[3].
Devido à sua simplicidade estrutural, este aminoácido tende a ser conservado evolucionariamente em proteínas como o citocromo c, a mioglobina e a hemoglobina. A glicina é o único aminoácido que não apresenta actividade óptica. A maioria das proteínas possui pequenas quantidades de glicina; o colagénio é uma excepção de nota, constituindo a glicina cerca de um terço da sua estrutura primária. A presença de glicina inibe a formação de alfa-hélices mas facilita a formação de folhas-beta na estrutura secundária de proteínas, por ser um aminoácido que apresenta um alto grau de flexibilidade quando integrado numa cadeia polipeptídica.[2]
Apesar de ser um aminoácido apolar, a sua cadeia lateral (um átomo de hidrogênio) é demasiado curta para participar em interações hidrofóbicas.[2] No entanto, a glicina pode, em determinadas enzimas como a piruvato:formato liase, ser convertida a radical glicilo através da retirada desse átomo de hidrogênio, sendo este radical importante para a catálise enzimática, embora instável e destruído na presença de O2.
Biossíntese
editarA glicina não é um aminoácido essencial na dieta humana, já que é sintetizado pelo organismo a partir do aminoácido serina numa reacção catalisada pela enzima serina hidroximetiltransferase:[2]
- HO2CCH(NH2)CH2OH + H2-folato → HO2CCH2NH2 + CH2-folato + H2O
Função fisiológica
editarComo intermediário biossintético
editarA glicina serve de precursor a diversas espécies químicas. O ácido aminolevulínico, precursor chave das porfirinas, é sintetizado in vivo a partir de glicina e succinil-coenzima A. A glicina fornece também o bloco C2N central a todas as purinas. Uma das vias de degradação do aminoácido treonina passa pela sua conversão a glicina, embora esta via metabólica seja relativamente pouco importante no metabolismo humano. É ainda precursor na via biossintética da fosfocreatina.
A degradação da glicina segue três vias principais:
- Pode ser degradada a piruvato, seguindo a reacção inversa da sua biossíntese (ou seja, conversão a serina e então conversão desta a piruvato).
- Especialmente em animais, a glicina pode ser oxidada a CO2, NH4+ e um grupo metileno pela enzima glicina sintase.
- Pode ser oxidada e desaminada a glioxilato pela enzima D-aminoácido oxidase, sendo o glioxilato posteriormente reduzido a oxalato.
Como neurotransmissor
editarA glicina é um neurotransmissor inibitório no sistema nervoso central, especialmente a nível da medula espinal, tronco cerebral e retina. Quando receptores de glicina são activados, o ânion cloreto entra no neurônio através de receptores ionotrópicos, causando um potencial pós-sináptico inibitório. A estricnina actua como antagonista nos receptores ionotrópicos de glicina. A glicina é, junto com o glutamato, um co-agonista de receptores NMDA; esta ação facilita a actividade excitatória dos receptores glutaminérgicos, em contraste com a atividade inibitória da glicina.
A dose letal de glicina administrada oralmente, em ratos, é de 7930 mg/kg[4], causando morte usualmente por hiperexcitabilidade.
Como elemento estrutural
editarAlém de ser um aminoácido importante na formação de colagénio, é essencial na formação da camada de peptidoglicano na parede celular de bactérias Gram-positivas, ao formar um pentapéptido (pentaglicina) que ajuda na ligação entre resíduos de ácido N-acetilmurâmico. A pentaglicina está ausente nas bactérias Gram-negativas.
A glutationa, tripéptido essencial na manutenção do equilíbrio redox intracelular, tem na sua constituição glicina.
Na fotorrespiração
editarAs mitocôndrias de plantas apresentam uma via alternativa de respiração, a fotorrespiração, em que a glicina é convertida a serina através da seguinte reacção, catalisada pela enzima glicina descarboxilase:
- 2 Gly + NAD+ → Ser + CO2 + NH3 + NADH + H+,
tornando-se esta a principal fonte de NADH mitocondrial para posterior produção de ATP. Esta reacção faz parte do grupo estrutural do RNA ciclo do glicolato.
Detectada num cometa
editarA glicina foi descoberta na atmosfera do cometa Júpiter 67P/Churyumov-Gerasimenko, pela sonda europeia Rosetta.[5]
Referências
- ↑ Merck Index, 11th Edition, 4386.
- ↑ a b c d Nelson 2004.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. «Nomenclature and Symbolism for Amino Acids and Peptides». Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado em 17 de maio de 2007
- ↑ «Safety (MSDS) data for glycine». The Physical and Theoretical Chemistry Laboratory Oxford University. 2005. Consultado em 1 de novembro de 2006. Arquivado do original em 20 de outubro de 2007
- ↑ «Detetado num cometa aminoácido essencial para a vida»
- DAWSON, R.M.C.; ELLIOTT, D.C.; ELLIOTT, W.H.; JONES, K.M., Data for Biochemical Research, 3rd ed., pp. 1–31 (1986)
Bibliografia
editar- Nelson, David L; Cox, Michael M (2004). Lehninger Principles of Biochemistry 4 ed. [S.l.]: W.H.Freeman. ISBN 978-0-7167-4339-2
- Wagner, A.F; Frey, M.; Neugebauer, F.A.; Schäfer, W.; Knappe, J (1992). The free radical in pyruvate formate-lyase is located on glycine-734. 89(3):996-1000. [S.l.]: Proc. Natl. Acad. Sci. U.S.A.
Ligações externas
editar- «Glicina» (em inglês)
- «Computational Chemistry Wiki» (em inglês)
- «Sistema de clivagem da glicina» (em inglês)