Cânfora
| Cânfora Alerta sobre risco à saúde[1][2] | |
|---|---|
| |
| |
| Nome IUPAC | 1,7,7-Trimethylbicyclo[2.2.1]heptan-2-one |
| Nome sistemático | 1,7,7-Trimethylbicyclo[2.2.1]heptan-2-one |
| Outros nomes | 2-Bornanone; Bornan-2-one; 2-Camphanone; Formosa |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| DrugBank | DB01744 |
| ChemSpider | |
| KEGG | |
| MeSH | |
| ChEBI | |
| Número RTECS | EX1225000 |
| SMILES |
|
| InChI | 1/C10H16O/c1-9(2)7-4-5-10(9,3)8(11)6-7/h7H,4-6H2,1-3H3
|
| Referência Beilstein | 1907611 |
| Referência Gmelin | 83275 |
| 3DMet | |
| Propriedades | |
| Fórmula química | C10H16O |
| Massa molar | 152.23 g mol-1 |
| Aparência | Branco, com cristais translucentes |
| Odor | fragrante e penetrante |
| Densidade | 0.992 g cm−3 |
| Ponto de fusão |
175-177 °C, 271 K, -112 °F |
| Ponto de ebulição |
209 °C, 482 K, 408 °F |
| Solubilidade em água | 1.2 g dm−3 |
| Solubilidade em acetona | ~2500 g dm−3 |
| Solubilidade em ácido acético | ~2000 g dm−3 |
| Solubilidade em dietil éter | ~2000 g dm−3 |
| Solubilidade em clorofórmio | ~1000 g dm−3 |
| Solubilidade em etanol | ~1000 g dm−3 |
| log P | 2.089 |
| Pressão de vapor | 4 mmHg (a 70 °C) |
| Rotação quiral [α]D | +44.1° |
| Susceptibilidade magnética | -103·10−6 cm3/mol |
| Farmacologia | |
| Código ATC | C01 |
| Riscos associados | |
| Classificação UE | |
| NFPA 704 | |
| Frases R | R11 R22 R36/37/38 |
| Frases S | S16 S26 |
| Limites de explosividade | 0.6%-3.5%[3] |
| EUA Limite de exposição permissível (PEL) |
TWA 2 mg/m3[3] |
| LD50 | 1310 mg/kg (oral, rato)[4] |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
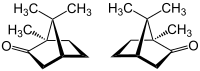
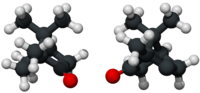
Cânfora é uma substância cerosa, semi-sólida ou parcialmente cristalina, branca ou translúcida, inflamável, com um forte e penetrante odor acre.[3][5] É um terpenoide com a fórmula química C10H16O, historicamente extraído da árvore Cinnamomum camphora (a canforeira), mas presentemente maioritariamente obtido por síntese química. A molécula é quiral, com dois possíveis enantiómeros, como mostrado nos diagramas estruturais no quadro anexo. A estrutura à esquerda é o estereoisómero que ocorre naturalmente (forma R), enquanto o oposto é mostrada à direita (forma S). A cânfora é utilizada para fins medicinais (especialmente em medicina tradicional), como repelente de insectos e animais, pelo seu aroma como ingrediente em cosméticos, na preparação de fluidos de embalsamamento e como base para a produção de outros compostos. Nalgumas regiões, especialmente na Índia, é utilizado como ingrediente para acentuar o sabor de alguns alimentos e em cerimónias religiosas.

Norcânfora (ou norcamphor) é um derivado sintético da cânfora com os três grupos metilo substituídos por hidrogénio.
Origem editar
Fontes naturais editar
A cânfora é um terpenoide que ocorre naturalmente na seiva e nos tecidos de diversas plantas, aparentemente como uma defesa contra o ataque por insectos e, nalguns casos, eventualmente como defesas vegetais contra a herbivoria.
O composto é abundante na madeira da canforeira, a espécie Cinnamomum camphora, uma grande árvore perenifólia nativa do sueste da Ásia (particularmente de Samatra e Bornéu, mas presente na Indochina e sueste da China). Embora a canforeira tenha sido historicamente a principal fonte de cânfora natural, outras espécies são igualmente ricas, ou mesmo mais ricas, neste composto. Entre as espécies historicamente usadas para produção de cânfora estão diversas espécies da família Lauraceae, com destaque para Ocotea usambarensis, e as pertencentes ao género Dryobalanops (árvores kapur), da família Dipterocarpaceae, um grupo de grandes árvores madeireiras da região indo-malaia.
O óleo de alecrim, extraído das folhas de alecrim (a espécie Rosmarinus officinalis), da família Lamiaceae, contém 10 a 20% de cânfora,[6] enquanto os óleos essenciais extraídos das folhas de espécies do género Heterotheca (Asteraceae) apenas contém 2 a 5% de cânfora.[7] Outro grupo de plantas ricas em cânfora, embora em teores mais baixos que as anteriores, é constituído pelas espécies do género Ocimum, a que pertence o manjericão, especialmente as espécies Ocimum kilimanscharicum (africana, mas cultivada na Ásia) e algumas variedades asiáticas de Ocimum basilicum.[8]
A cânfora pode ser sinteticamente produzida a partir do óleo de terebintina, um líquido obtido por destilação da resina de coníferas.
Síntese editar
Nos finais do século XIX era sabido que o ácido nítrico oxida a cânfora em ácido canfórico. Em 1896 Albin Haller publicou um artigo demonstrando a possibilidade da síntese parcial da cânfora,[9] seguido por outro, em colaboração com Gustave Blanc, publicando uma semi-síntese de cânfora a partir de ácido canfórico.[10] Embora tivessem demonstrado a estrutura do composto, não foram capazes de provar indiscutivelmente que a síntese tinha sido conseguida.
A primeira síntese total completa de ácido canfórico foi publicada por Gustaf Komppa em 1903. Os seus composto de partida foram oxalato de dietilo e ácido 3,3-dimetilpentanóico, que reagiram por via da condensação de Claisen produzindo o ácido dicetocanfórico. A metilação com iodeto de metilo e um complexo procedimento de redução permitiu produzir ácido canfórico. William Perkin publicou pouco tempo depois outro método de síntese.
Anteriormente, alguns compostos orgânicos (como a ureia) tinham sido sintetizados em laboratório como prova de conceito, sem interesse comercial e sem procura de industrialização dos métodos. Contudo, a cânfora por ser um produto natural escasso e com forte procura mundial era particularmente atractiva para produção industrial. Gustaf Komppa percebeu isso e iniciou a produção industrial de cânfora em Tainionkoski, Finlândia, em 1907, num processo de síntese industrial pioneiro.
A cânfora pode ser produzida a partir de alfa-pineno, composto que é abundante nos óleos derivados das resinas de múltiplas espécies de coníferas e pode ser destilado a partir da terebintina produzida como produto secundário dos processos de polpação química. Utilizando ácido acético como solvente e com catálise por um ácido forte, o alfa-pineno sofre facilmente uma reacção de rearranjo para canfeno, o qual, por sua vez, sofre um rearranjo de Wagner-Meerwein para o catião de isobornilo, que é capturado pelo acetato para produzir acetato de isobornilo. A hidrólise do isoborneol, seguido por oxidação, produz uma mistura racémica de cânfora. Em contraste, a cânfora ocorre naturalmente como D-cânfora, o enantiómero R do composto.
História editar
O vocábulo «cânfora» deriva do latim medieval camfora, por sua vez derivado do árabe al-kafur, termo com origem no sânscrito, कर्पूरम् / karpūram.[11] A cânfora era bem conhecida na Índia durante o período védico. O termo sânscrito provavelmente tem origem no antigo idioma malaio, no qual a cânfora era designada por kapur Barus, expressão que significa "giz de Barus", pois naquele tempo era aos comerciantes malaios que os comerciantes indianos compravam a cânfora, os quais a designavam por kapur, "giz", devido à sua coloração esbranquiçada. Barus era o nome de um antigo porto situado na costa oeste da ilha de Sumatra, próximo da moderna cidade de Sibolga,[12] de donde os comerciantes traziam aquele produto. O porto de Barus era o local onde se concentrava o comércio da cânfora extraída da madeira de Cinnamomum camphora, a canforeira, árvore que era abundante naquela região. Mesmo na actualidade, naquela região e em boa parte da Indonésia, as bolas aromáticas de naftaleno e as bolas de naftalina são designadas por kapur Barus.
O moderno estudo químico da cânfora foi iniciado por Nicolas-Théodore de Saussure, continuado posteriormente por Justus von Liebig, Jean-Baptiste Dumas e Théophile-Jules Pelouze. Foi Pelouze quem obteve pela primeira vez a cânfora sintética, obtida em 1840 oxidando a cânfora do Bornéu. Marcellin Berthelot conseguiu a síntese pela oxidação do canfeno em 1859, determinando a sua composição química.
A primeira síntese integral da cânfora, a partir de compostos simples, foi conseguida por Gustav Komppa em 1903. Previamente alguns compostos orgânicos (como a ureia) tinham sido sintetizados em laboratório como prova conceptual, mas a cânfora era um produto natural escasso e com uma grande procura em todo o mundo, pelo que Komppa iniciou a sua produção industrial em Tainionkoski (Finlândia) em 1907, sendo a primeira síntese totalmente industrial de um produto vegetal.
O produto conhecido por noralcanfor é um derivado da cânfora por substituição dos três grupos metilo por hidrogénio.
Química editar
Biossíntese editar
A biossíntese da cânfora tem como base o pirofosfato de geranil, via ciclização do pirofosfato de linaloil para pirofosfato de bornil, seguido por hidrólise para borneol e oxidação para cânfora.
Reacções típicas editar
A cânfora apresenta as seguintes reacções típicas:
- oxidação com ácido nítrico,
- conversão para isonitrosocânfora.
A cânfora também pode ser reduzida para isoborneol usando borohidreto de sódio.
Em 1998, um grupo de investigadores trabalhando na Indian Association for the Cultivation of Science, Kolkata, prepararam um filme fino de diamante usando cânfora como precursor para deposição química em fase vapor.[13]
Em 2007, nanotubos de carbono foram sintetizados com sucesso usando vapor de cânfora num processo de deposição química em fase vapor.[14]
Usos editar
As propriedades químicas e bioquímicas da cânfora, aliadas à capacidade de rápida sublimação, dão a este composto utilizações diversificadas. Os usos modernos da cânfora são múltiplos: para além dos usos farmacológicos, é utilizada como plastificante do nitrato de celulose em explosivos e em pirotecnia, como repelente de traças, como substância antimicrobiana e como bálsamo. Os cristais de cânfora são usados para prevenir os danos provocado por insectos nas colecções de insectos e em herbários. Uma forma de gel anticomichão comum utiliza cânfora como princípio activo. A cânfora é rapidamente absorvida pela pele, produzindo uma sensação de resfriamento similar à do mentol e actua como um anestésico local leve e como antimicrobiano. Pode ser administrado em pequenas quantidades (50 mg) para sintomas de fatiga e sintomas cardíacos menores.
É usado como saborizante de doces na Índia e na Europa.
No ritual pūja de origem hindu, é utilizada para acender o fogo que finaliza a cerimónia.
É utilizado em forma de pastilhas ou geles como repelente de animais, geralmente domésticos, como cães e gatos, que costumam marcar o seu território, já que cânfora nas zonas de marcação do território, se favorece o seu afastamento da zona.
A cânfora possui acção rubefaciente, antipruriginosa, antisséptica e ligeiramente analgésica. O produto é em geram empregue sob a forma de linimentos, soluções alcoólicas (sob o nome de álcool canforado) e unguentos e pomadas, como revulsivo em dores articulares, musculares, neuralgias e outras afecções similares.
Administrado por via sistémica apresenta propriedades irritantes e carminativas, utilizando-se como um expectorante suave. A cânfora é muito utilizada em fórmulas para descongestão nasal, ainda que a sua eficácia seja duvidosa.
O uso de óleos canforados está desaconselhado, por ser potencialmente tóxico (aumenta a absorção da cânfora). Foi também utilizado como estimulante e como sedante, por via interna. Segundo o Comité para la Revisión de Medicamentos (Espanha), a cânfora não deve ser incluída na composição de preparados destinados ao tratamento de transtornos hepáticos e biliares, cálculos biliares, cólicas, alterações renais, infecções do tracto urinário ou cálculos uretrais. O seu emprego por via parenteral ou em irrigação não é aconselhável, devido aos efeitos adversos.[15]
Referências editar
- ↑ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, USA, 1960
- ↑ Handbook of Chemistry and Physics, CRC Press, Ann Arbor, Michigan, USA
- ↑ a b c "NIOSH Pocket Guide to Chemical Hazards #0096". National Institute for Occupational Safety and Health (NIOSH).
- ↑ «Camphor (synthetic)». National Institute for Occupational Safety and Health (NIOSH). 4 de dezembro de 2014. Consultado em 19 de Fevereiro de 2015
- ↑ Mann JC, Hobbs JB, Banthorpe DV, Harborne JB (1994). Natural products: their chemistry and biological significance. Harlow, Essex, England: Longman Scientific & Technical. pp. 309–11. ISBN 0-582-06009-5
- ↑ «Rosemary». Drugs.com. Consultado em 23 de julho de 2016
- ↑ Lincoln, D.E., B.M. Lawrence. 1984. The volatile constituents of camphorweed, Heterotheca subaxillaris. Phytochemistry 23(4):933-934
- ↑ Thomas DeBaggio, Arthur O. Tucker, The Encyclopedia of Herbs: A Comprehensive Reference to Herbs of Flavor and Fragrance. Timber Press, 2009.
- ↑ Albin Haller, "Sur la transformation de l'acide camphorique droit em camphre droit; synthese partielle du camphre". Comptes rendus, 1896, 122 pp. 446-452.
- ↑ Albin Haller, Gustave Blanc, "Sur la transformation de l'acide campholique au moyen de l'acide camphorique". Comptes rendus, 1900, 130, pp. 376-378.
- ↑ Camphor at the Online Etymology Dictionary
- ↑ Drakard, Jane (1989). «An Indian Ocean Port: Sources for the Earlier History of Barus». Archipel. 37: 53–82. doi:10.3406/arch.1989.2562. Consultado em 9 de outubro de 2015
- ↑ Chakrabarti K, Chakrabarti R, Chattopadhyay KK, Chaudhuri S, Pal AK (1998). «Nano-diamond films produced from CVD of camphor». Diam Relat Mater. 7 (6): 845–52. Bibcode:1998DRM.....7..845C. doi:10.1016/S0925-9635(97)00312-9
- ↑ Kumar M, Ando Y (2007). «Carbon Nanotubes from Camphor: An Environment-Friendly Nanotechnology». J Phys Conf Ser. 61: 643–6. Bibcode:2007JPhCS..61..643K. doi:10.1088/1742-6596/61/1/129
- ↑ Ficha Técnica: Alcanfor - Cristal Sintético.
