Cloreto de césio
| Cloreto de césio Alerta sobre risco à saúde | |
|---|---|

| |

| |
| |
| Outros nomes | Cesium chloride |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Propriedades | |
| Fórmula molecular | CsCl |
| Massa molar | 168.36 g/mol |
| Aparência | branco sólido |
| Densidade | 3,97 g·cm-3[1] |
| Ponto de fusão |
646 °C[1] |
| Ponto de ebulição |
1382 °C[1] |
| Solubilidade em água | muito solúvel (1860 g·l-1 a 20 °C)[1] |
| Estrutura | |
| Estrutura cristalina | see text |
| Geometria de coordenação |
cubico simples |
| Riscos associados | |
| LD50 | 2004 mg·kg-1[1] |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de césio Brometo de césio Iodeto de césio |
| Outros catiões/cátions | Cloreto de potássio Cloreto de rubídio Cloreto de bário |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O Cloreto de césio é um sal formado pelo cloro e o Césio, é o composto inorgânico com a fórmula de CsCl. Este sólido incolor é uma importante fonte de iões de césio em uma variedade de aplicações de nicho. Sua estrutura cristalina forma um tipo estrutural importante, onde cada íon de césio é coordenado por 8 íons de cloro. cloreto de césio dissolve-se em água. de cloreto de césio ocorre naturalmente como impurezas em carnalita (até 0,002%), silvinita e kainite. Menos de 20 toneladas de CsCl é produzido anualmente no mundo, principalmente a partir de um polucita mineral portadores de césio.[2]
Cloreto de césio é amplamente utilizado em medicina estrutura centrifugação isopícnica para a separação de vários tipos de DNA. É um reagente em química analítica, em que é usado para identificar os íons pela cor e morfologia do precipitado. Quando enriquecido com isótopos radioativos, tais como 137CsCl ou 131CsCl, cloreto de césio é utilizado em aplicações de medicina nuclear, tais como o tratamento de cancro e de diagnóstico de infarte do miocárdio. Outra forma de tratamento do câncer foi estudada usando não-radioativo convencional CsCl. Considerando que o cloreto de césio convencional tem uma toxicidade bastante baixa para o homem e animais, sob a forma radioativa facilmente contamina o meio ambiente devido à elevada solubilidade de CsCl em água. A disseminação de 137Cs em pó a partir de um recipiente de 93 gramas em 1987, em Goiânia, Brasil, resultou em um dos piores acidentes de derramamento de radiação, matando quatro diretamente e afetando mais de 100.000 pessoas.
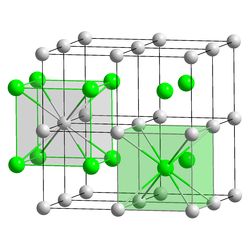
Estrutura editar
A estrutura de cloreto de césio não adota uma rede cúbica de corpo centrado com uma base de oito átomos, onde ambos os átomos estão compartilhados com oito células unitárias, e consequentemente seu numero de coordenação é 8, Pois esse é o número de átomos vizinhos que estão em contato direto com o átomo central ( Césio). Os átomos de cloro encontram-se sobre os pontos da rede com as arestas do cubo, enquanto que os átomos de césio encontram-se nos furos no centro dos cubos.[3] Quando ambos os ions são semelhantes em tamanho (Cs+ raio iônico, 174 pm para este número de coordenação, Cl- 181 pm) a estrutura de CsCl é adotada, quando eles são diferentes (Na+ iônico raio de 102 pm, Cl- 181 pm) a estrutura de cloreto de sódio é adotada. Após aquecimento até acima de 450 °C, a estrutura de cloreto de césio normal (α-CsCl) converte para a forma β-CsCl com a estrutura de sal gema (grupo espacial Fm3m).
Reações editar
O cloreto de césio dissocia-se completamente após dissolução em água, e os catiões Cs+ são solvatados em solução diluída. O CsCl converte-se em sulfato de césio quando aquecido em ácido sulfúrico concentrado ou aquecido com hidrogeno-sulfato de césio a 550-700 ° C[4]:
- 2CsCl + H2SO4 → Cs2SO4 + 2HCl
- CsCl + CsHSO4 → Cs2SO4 + HCl
O cloreto de césio forma uma variedade de sais duplos com outros cloretos. Os exemplos incluem 2CsCl. BaCl2,[5] 2CsCl. CuCl2, CsCl2.CuCl e CsCl.LiCl,[6] e com compostos inter-halogenados:
CsCl + ICl3 → Cs[ICl4]
Ocorrência e produção editar
O cloreto de césio ocorre naturalmente como uma impureza nos minerais de haleto carnallite (KMgCl3 · 6H2O com até 0,002% CsCl),[7] sylvite (KCl) e kainite (MgSO4 · KCl · 3H2O),[8] e em águas minerais. Por exemplo, a água de Bad Dürkheim spa, que foi usada isoladamente de césio, continha cerca de 0,17 mg / L de CsCl.[9] Nenhum destes minerais é comercialmente importante.
Na escala industrial, o CsCl é produzido a partir da polucite mineral, que é pulverizada e tratada com ácido clorídrico a temperatura elevada. O extracto é tratado com cloreto de antimónio, monocloreto de iodo ou cloreto de cério (IV) para dar o sal duplo fracamente solúvel:[10]
CsCl + SbCl3 → CsSbCl4
O tratamento do dobro com sulfureto de hidrogênio dá CsCl:[10]
2 CsSbCl4 + 3 H2S → 2 CsCl + Sb2S3 + 8 HCl
CsCl de alta pureza é também produzido a partir de Cs[ICl2] (e Cs[ICl4]) por decomposição térmica:
Cs[ICl2] → 2CsCl + ICl
Somente cerca de 20 toneladas de compostos de césio, com grande contribuição da CsCl, foram produzidas anualmente nos anos 1970[11] e 2000 no mundo inteiro.[12] O cloreto de césio enriquecido com césio-137 para aplicações de terapia de radiação é produzido em uma única instalação Mayak na Região Ural da Rússia[13] e é vendido internacionalmente através de um revendedor britânico. O sal é sintetizado a 200 ° C devido à sua natureza higroscópica e selado num recipiente de aço em forma de dedal que é então encerrado num outro invólucro de aço. A vedação é necessária para proteger o sal da umidade.[14]
Métodos de laboratório editar
No laboratório, o CsCl pode ser obtido por tratamento de hidróxido de césio, carbonato, bicarbonato de césio ou sulfeto de césio com ácido clorídrico:
CsOH + HCl → CsCl + H2O
Cs2CO3 + 2 HCl → 2 CsCl + 2 H2O + CO2
Usos editar
Medicina editar
A Sociedade Americana do Câncer afirma que "as evidências científicas disponíveis não suportam alegações de que os suplementos não radioativos de cloreto de césio têm algum efeito sobre os tumores".[15] Tem sido associado à morte de mais de 50 pacientes, quando foi usado como parte de Um tratamento do câncer cientificamente não validado.[16]
Medicina nuclear e radiografia editar
O cloreto de césio, composto de radioisótopos como o 137CsCl eo 131CsCl,[17][18]é utilizado na medicina nuclear, incluindo o tratamento do câncer (braquiterapia) e o diagnóstico de infarto do miocárdio.[19][20] Na produção de fontes radioativas, é normal escolher uma forma química do radioisótopo que não seja prontamente dispersa no ambiente em caso de acidente. Por exemplo, os geradores radiotérmicos (RTGs) usam frequentemente titanato de estrôncio, que é insolúvel em água. No entanto, para fontes de teleterapia, a densidade radioativa (Ci em um determinado volume) precisa ser muito alta, o que não é possível com compostos de césio insolúveis conhecidos. Um recipiente em forma de dedal de cloreto de césio radioactivo proporciona a fonte activa.
Aplicações diversas editar
O cloreto de césio é usado na preparação de vidros eletricamente condutores[18][21] e telas de tubos de raios catódicos.[22] Em conjunção com gases raros CsCl é usado como em lâmpadas excimer:[23][24] uma fonte de descarga de gás de luz ultravioleta que usa, por exemplo, eletricamente excitado XeCl moléculas excimer. Outros usos incluem a ativação de eletrodos na soldagem,[25] fabricação de água mineral, cerveja[26] e lamas de perfuração,[27] repelentes[28] e soldas de alta temperatura. Os cristais únicos de CsCl de alta qualidade têm uma ampla faixa de transparência de UV para infravermelho e, portanto, foram usados para cuvetes, prismas e janelas em espectrômetros ópticos;[22] este uso foi descontinuado com o desenvolvimento de materiais menos higroscópicos.
CsCl é um inibidor potente de canais HCN, que carregam a corrente h em células excitáveis, como neurônios. [55] Pode, portanto, ser útil como uma ferramenta em experimentos de eletrofisiologia em neurociência.
Bibliografia editar
- ↑ a b c d e Catálogo da Merck Cloreto de césio acessado em 19. Januar 2011
- ↑ a b Greenwood, Norman (1997). Chemistry of the Elements. Earnshaw: Alan
- ↑ Wells, A.F. (1984). Structural Inorganic Chemistry. Oxford Science Publications: [s.n.]
- ↑ Lidin, R. A; Molochko V.; Andreeva, L. L. A. (2000). Химические свойства неорганических веществ (3 ed.). Moscow: Khimiya. p. 49. ISBN 5-7245-1163-0.
- ↑ Knunyants, I. L, ed. (1988). "Бария хлорид". Химическая энциклопедия. 1. Moscow: Soviet Encyclopedia. p. 463.
- ↑ National Research Council (U.S.). Office of Critical Tables, ed. (1962). Consolidated Index of Selected Property Values: Physical Chemistry and Thermodynamics (Publication 976 ed.). Washington, D.C.: National Academy of Science. p. 271.
- ↑ Knunyants, I. L, ed. (1998). "Цезий". Химическая энциклопедия (Chemical encyclopedia). 5. Moscow: Soviet Encyclopedia. pp. 654–656. ISBN 5-85270-310-9.
- ↑ Plyushev, pp. 210–211
- ↑ Plyushev, p. 206
- ↑ a b "Cesium and Cesium Compounds". Kirk-Othmer Encyclopedia of Chemical Technology. 5 (4th ed.). New York: John Wiley & Sons. 1994. pp. 375–376.
- ↑ Manfred Bick and Horst Prinz "Cesium and Cesium Compounds" in Ullmann’s Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_153 Vol. A6, pp. 153–156.
- ↑ Halka M.; Nordstrom B. (2010). Alkali and Alkaline Earth Metals. Infobase Publishing. p. 52. ISBN 978-0-8160-7369-6.
- ↑ Enrique Lima "Cesium: Radionuclide" in Encyclopedia of Inorganic Chemistry, 2006, Wiley-VCH, Weinheim. doi:10.1002/0470862106.ia712
- ↑ National Research Council (U.S.). Committee on Radiation Source Use and Replacement; Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 28–. ISBN 978-0-309-11014-3.
- ↑ "Cesium Chloride". Complementary and Alternative Medicine: Herbs, Vitamins, and Minerals. American Cancer Society. 30 November 2008. Retrieved 2011-05-13.
- ↑ Wood, Leonie. "'Cured' cancer patients died, court told". The Sydney Morning Herald. 20 November 2010.
- ↑ Alikbaeva LA, ed. (2005). "11.1. Источники радиоактивных загрязнений". Новый справочник химика и технолога (in Russian). 11. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. St. Petersburg. ISBN 5-98371-025-7.
- ↑ a b Cesium. Mineral Commodity Summaries January 2010. U.S. Geological Survey
- ↑ Carrea, JR; Gleason, G; Shaw, J; Krontz, B (1964). "The direct diagnosis of myocardial infarction by photoscanning after administration of cesium-131" (PDF). American Heart Journal. 68 (5): 627–36. doi:10.1016/0002-8703(64)90271-6. PMID 14222401.
- ↑ McGeehan, John T. (1968). "Cesium 131 Photoscan: Aid in the Diagnosis of Myocardial Infarction". JAMA: The Journal of the American Medical Association. 204 (7): 585. doi:10.1001/jama.1968.03140200025006.
- ↑ Missing or empty
|title=(help) - ↑ a b Missing or empty
|title=(help) - ↑ Klenovskii, M.S.; Kel’man, V.A.; Zhmenyak, Yu.V.; Shpenik, Yu.O. (2010). "Electric-discharge UV radiation source based on a Xe-CsCl vapor-gas mixture". Technical Physics. 55 (5): 709–714. doi:10.1134/S1063784210050178.
- ↑ Klenovskii, M.S.; Kel’man, V.A.; Zhmenyak, Yu.V.; Shpenik, Yu.O. (2013). "Luminescence of XeCl* and XeBr* exciplex molecules initiated by a longitudinal pulsed discharge in a three-component mixture of Xe with CsCl and CsBr vapors". Optics and Spectroscopy. 114 (2): 197–204. doi:10.1134/S0030400X13010141.
- ↑ "Тугоплавкие и химически активные металлы". Migatronic. Retrieved 2011-02-24.
- ↑ Morris, Ch. G., ed. (1992). "Cesium chloride". Academic Press Dictionary of Science and Technology. San Diego: Academic Press. p. 395. ISBN 0-12-200400-0.
- ↑ "Cesium Chloride MSDS" (pdf). Cesium Fine Chemicals. Cabot Corporation. Retrieved 2011-04-11.
- ↑ Qureshi J. A.; Buschman L. L.; Throne J. E.; Whaley P. M.; Ramaswamy S. B. (2004). "Rubidium Chloride and Cesium Chloride Sprayed on Maize Plants and Evaluated for Marking Diatraea grandiosella (Lepidoptera: Crambidae) in Mark–Recapture Dispersal Studies". Environmental Entomology. 33(4): 930–940. doi:10.1603/0046-225X-33.4.930.