Endossimbionte
Um endossimbionte ou endobionte[1] é qualquer organismo que vive dentro do corpo ou das células de outro organismo, na maioria das vezes, embora nem sempre, em uma relação mutualística. (O termo endossimbiose vem do grego: ἔνδον endon "dentro", σύν syn "junto" e βίωσις biosis "vivendo"). Exemplos são as bactérias fixadoras de nitrogênio (chamadas rizóbios), que vivem nos nódulos das raízes das leguminosas, as algas unicelulares dentro dos corais que constroem recifes e os endossimbiontes bacterianos que fornecem nutrientes essenciais aos insetos.[2][3]
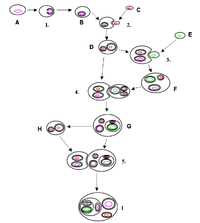
A história por trás do conceito de endossimbiose tem origem nos postulados da teoria endossimbiótica. A teoria endossimbiótica (simbiogênese) defende a noção de que as bactérias vivem exclusivamente em organismos eucarióticos depois de serem engolidas por eles. Isso é popular com o conceito de desenvolvimento de organelas observado em eucariotos. Dois tipos principais de organelas em células eucarióticas, as mitocôndrias e os plastídios, como os cloroplastos, são considerados obtidos de endossimbiontes bacterianos.[4]
Há dois tipos principais de transmissão de simbiontes. Na transmissão horizontal, cada nova geração adquire simbiontes de vida livre do ambiente. Um exemplo são as bactérias fixadoras de nitrogênio em certas raízes de plantas. A transmissão vertical ocorre quando o simbionte é transferido diretamente do pai para a prole.[5][6] Um exemplo são os simbiontes do pulgão da ervilha. Além disso, é possível que ambos estejam envolvidos em uma transmissão de modo misto, em que os simbiontes são transferidos verticalmente por alguma geração antes que ocorra uma mudança de hospedeiro e novos simbiontes sejam adquiridos horizontalmente do ambiente.[7][8][9] Outros exemplos incluem os simbiontes nutricionais de Wigglesworthia das moscas tsé-tsé ou em esponjas.[10] Quando um simbionte atinge esse estágio, ele começa a se assemelhar a uma organela celular, semelhante às mitocôndrias ou aos cloroplastos.
Muitos exemplos de endossimbiose são obrigatórios, ou seja, o endossimbionte ou o hospedeiro não podem sobreviver sem o outro, como os vermes marinhos sem vísceras do gênero Riftia, que obtêm nutrição de suas bactérias endossimbióticas. Os exemplos mais comuns de endossimbiose obrigatória são as mitocôndrias e os cloroplastos. Alguns parasitas humanos, por exemplo, Wuchereria bancrofti e Mansonella perstans, prosperam em seus hospedeiros intermediários de insetos por causa de uma endossimbiose obrigatória com Wolbachia spp.[11] Ambos podem ser eliminados dos hospedeiros por meio de tratamentos que têm como alvo essa bactéria.[12] Entretanto, nem todas as endossimbioses são obrigatórias e algumas endossimbioses podem ser prejudiciais a qualquer um dos organismos envolvidos.
A origem: Simbiogênese e transmissão de simbiontes editar
Simbiogênese e organelas editar
A simbiogênese explica as origens dos eucariotos, cujas células contêm dois tipos principais de organelas: mitocôndrias e cloroplastos. A teoria propõe que essas organelas evoluíram a partir de certos tipos de bactérias que as células eucarióticas engoliram por meio da fagocitose. Essas células e as bactérias aprisionadas em seu interior entraram em uma relação endossimbiótica, o que significa que as bactérias fixaram residência e passaram a viver exclusivamente dentro das células eucarióticas.[13][14][15][16]
Diversas espécies de insetos têm endossimbiontes em diferentes estágios da simbiogênese. Um tema comum da simbiogênese envolve a redução do genoma a apenas genes essenciais para o genoma coletivo do hospedeiro e do simbionte.[17] Um exemplo notável disso é o fracionamento do genoma Hodgkinia das cigarras Magicicada. Como o ciclo de vida da cigarra leva anos no subsolo, a seleção natural nas populações de endossimbiontes é relaxada por muitas gerações bacterianas. Isso permite que os genomas dos simbiontes se diversifiquem no hospedeiro durante anos, com apenas períodos pontuais de seleção quando as cigarras se reproduzem. Como resultado, o genoma ancestral da Hodgkinia dividiu-se em três grupos de endossimbiontes primários, cada um codificando apenas uma fração dos genes essenciais para a simbiose - um exemplo de equilíbrio pontuado que produz linhagens distintas do simbionte. O hospedeiro agora requer todos os três subgrupos de simbiontes, cada um com genomas degradados que não possuem a maioria dos genes essenciais para a viabilidade bacteriana.[18]
Transmissão de simbiontes editar
A transmissão simbionte é o processo em que o hospedeiro em uma relação simbiótica entre dois organismos adquire um organismo (interna ou externamente) que serve como seu simbionte. A maioria dos simbiontes é obrigatória (precisa do hospedeiro para sobreviver) ou facultativa (não precisa necessariamente do hospedeiro para sobreviver).[19] Muitas instâncias de endossimbiose são obrigatórias, ou seja, o endossimbionte ou o hospedeiro não podem sobreviver sem o outro, como os vermes marinhos sem vísceras do gênero Riftia, que obtêm nutrição de suas bactérias endossimbióticas. Os exemplos mais comuns de endossimbiose obrigatória são as mitocôndrias e os cloroplastos. Alguns parasitas humanos, por exemplo, Wuchereria bancrofti e Mansonella perstans, prosperam em seus hospedeiros intermediários de insetos por causa de uma endossimbiose obrigatória com Wolbachia spp.[11] Ambos podem ser eliminados dos hospedeiros por meio de tratamentos que têm como alvo essa bactéria.[20]
A transmissão horizontal (lateral), vertical e de modo misto (híbrido de horizontal e vertical) são os três caminhos para a transferência de simbiontes. A transferência horizontal de simbiontes (transmissão horizontal) é um processo em que um hospedeiro adquire um simbionte facultativo do ambiente ou de outro hospedeiro.[19] A simbiose rizobios-leguminosas (endossimbiose bactéria-planta) é um excelente exemplo de transmissão horizontal de simbiontes.[21] A relação simbiótica entre rizobios e leguminosas é importante para processos como a formação de nódulos radiculares. Ela começa com os flavonóides liberados pela planta hospedeira (leguminosa), o que faz com que a espécie de rizóbio (endossimbionte) ative seus genes nod.[21] Esses genes nod geram sinais de lipooligossacarídeos que a leguminosa (hospedeira) detecta, levando assim à formação de nódulos radiculares.[22] Esse processo leva a outros processos exclusivos, como a fixação de nitrogênio nas plantas.[21] A vantagem evolutiva de tal interação permite a troca genética entre os dois organismos envolvidos, aumentando a propensão a novas funções, como visto na interação planta-bactéria (formação de holobiontes).[23]
Na transmissão vertical, os simbiontes geralmente têm um genoma reduzido e não são mais capazes de sobreviver por conta própria. Como resultado, o simbionte depende do hospedeiro, resultando em uma relação co-dependente altamente íntima. Por exemplo, os simbiontes do pulgão da ervilha perderam genes de moléculas essenciais e agora dependem do hospedeiro para fornecer nutrientes. Em troca, os simbiontes sintetizam aminoácidos essenciais para o hospedeiro do pulgão.[22] Outros exemplos incluem os simbiontes nutricionais Wigglesworthia das moscas tsé-tsé ou em esponjas.[9] Quando um simbionte atinge esse estágio, ele começa a se assemelhar a uma organela celular, semelhante à mitocôndria ou aos cloroplastos. As consequências evolutivas fazem com que o hospedeiro e o simbionte sejam dependentes e formem um holobionte e, no caso de um gargalo, uma diminuição na diversidade do simbionte pode afetar negativamente as interações hospedeiro-simbionte, quando mutações deletérias se acumulam ao longo do tempo.[24]
Endossimbiontes bacterianos de invertebrados editar
Os exemplos mais bem estudados de endossimbiose são conhecidos de invertebrados. Essas simbioses afetam organismos com impacto global, incluindo o Symbiodinium dos corais ou a Wolbachia dos insetos. Muitos insetos pragas agrícolas e vetores de doenças humanas têm relações íntimas com endossimbiontes primários.[25]
Insetos editar
Os cientistas classificam os endossimbiontes de insetos em duas grandes categorias: "primários" e "secundários". Os endossimbiontes primários (às vezes chamados de endossimbiontes P) estão associados a seus hospedeiros insetos há muitos milhões de anos (de 10 a várias centenas de milhões de anos em alguns casos). Eles formam associações obrigatórias (veja abaixo) e apresentam coespeciação com seus hospedeiros insetos. Os endossimbiontes secundários exibem uma associação desenvolvida mais recentemente, às vezes são transferidos horizontalmente entre hospedeiros, vivem na hemolinfa dos insetos (não em bacteriócitos especializados, veja abaixo) e não são obrigatórios.[26]
Primários editar
Entre os endossimbiontes primários de insetos, os mais bem estudados são o pulgão da ervilha (Acyrthosiphon pisum) e seu endossimbionte Buchnera sp. APS,[22][27] a mosca tsé-tsé Glossina morsitans morsitans e seu endossimbionte Wigglesworthia glossinidia brevipalpis e os protistas endossimbióticos nos cupins inferiores. Assim como na endossimbiose em outros insetos, a simbiose é obrigatória, pois nem a bactéria nem o inseto são viáveis sem o outro. Os cientistas não conseguiram cultivar a bactéria em condições de laboratório fora do inseto. Com dietas especiais enriquecidas nutricionalmente, os insetos podem sobreviver, mas não são saudáveis e, na melhor das hipóteses, sobrevivem apenas algumas gerações.
Em alguns grupos de insetos, esses endossimbiontes vivem em células especializadas de insetos chamadas bacteriócitos (também chamadas de micetócitos) e são transmitidos pela mãe, ou seja, a mãe transmite seus endossimbiontes para a prole. Em alguns casos, as bactérias são transmitidas no ovo, como na Buchnera; em outros, como na Wigglesworthia, elas são transmitidas via leite para o embrião do inseto em desenvolvimento. Nos cupins, os endossimbiontes residem nas vísceras e são transmitidos por meio de trofalaxia entre os membros da colônia.[28]
Acredita-se que os endossimbiontes primários ajudem o hospedeiro fornecendo nutrientes que o hospedeiro não pode obter por si mesmo ou metabolizando os resíduos de insetos em formas mais seguras. Por exemplo, a suposta função primária da Buchnera é sintetizar aminoácidos essenciais que o pulgão não pode adquirir em sua dieta natural de seiva vegetal. Da mesma forma, presume-se que a função principal da Wigglesworthia seja sintetizar vitaminas que a mosca tsé-tsé não obtém do sangue que ingere. Nos cupins inferiores, os protistas endossimbióticos desempenham um papel importante na digestão de materiais lignocelulósicos que constituem a maior parte da dieta dos cupins.
As bactérias se beneficiam da exposição reduzida a predadores e da concorrência de outras espécies bacterianas, do amplo suprimento de nutrientes e da relativa estabilidade ambiental dentro do hospedeiro.
O sequenciamento do genoma revela que os endossimbiontes bacterianos obrigatórios de insetos estão entre os menores genomas bacterianos conhecidos e perderam muitos genes que são comumente encontrados em bactérias intimamente relacionadas. Várias teorias foram apresentadas para explicar a perda de genes. Presume-se que alguns desses genes não sejam necessários no ambiente da célula hospedeira do inseto. Uma teoria complementar sugere que o número relativamente pequeno de bactérias dentro de cada inseto diminui a eficiência da seleção natural em "expurgar" mutações deletérias e pequenas mutações da população, resultando em uma perda de genes ao longo de muitos milhões de anos. Uma pesquisa na qual uma filogenia paralela de bactérias e insetos foi inferida apoia a crença de que os endossimbiontes primários são transferidos apenas verticalmente (ou seja, da mãe) e não horizontalmente (ou seja, escapando do hospedeiro e entrando em um novo hospedeiro).[29][30]
O ataque aos endossimbiontes bacterianos obrigatórios pode ser uma forma de controlar seus insetos hospedeiros, muitos dos quais são pragas ou portadores de doenças humanas. Por exemplo, os pulgões são pragas das plantações e a mosca tsé-tsé carrega o organismo Trypanosoma brucei, que causa a doença do sono africana.[31] Outras motivações para seu estudo envolvem a compreensão das origens das simbioses em geral, como um substituto para a compreensão, por exemplo, de como os cloroplastos ou as mitocôndrias se tornaram simbiontes obrigatórios de eucariotos ou plantas.
Secundário editar
Sabe-se que o pulgão da ervilha (Acyrthosiphon pisum) contém pelo menos três endossimbiontes secundários, Hamiltonella defensa, Regiella insecticola e Serratia symbiotica. Hamiltonella defensa defende seu hospedeiro pulgão das vespas parasitoides.[32] Essa simbiose defensiva melhora a sobrevivência dos pulgões, que perderam alguns elementos da resposta imune dos insetos.[33]
Um dos simbiontes defensivos mais bem compreendidos é a bactéria espiral Spiroplasma poulsonii. A Spiroplasma sp. pode ser manipuladora reprodutiva, mas também simbionte defensiva das moscas Drosophila. Na Drosophila neotestacea, a S. poulsonii se espalhou pela América do Norte devido à sua capacidade de defender seu hospedeiro contra parasitas nematoides.[34] Essa defesa é mediada por toxinas chamadas "proteínas inativadoras de ribossomos" que atacam a maquinaria molecular dos parasitas invasores.[35][36] Essas toxinas da Spiroplasma representam um dos primeiros exemplos de uma simbiose defensiva com uma compreensão mecanicista da simbiose defensiva entre um endossimbionte de inseto e seu hospedeiro.[37]
O Sodalis glossinidius é um endossimbionte secundário das moscas tsé-tsé que vive inter e intracelularmente em vários tecidos do hospedeiro, incluindo o intestino médio e a hemolinfa. Estudos filogenéticos não indicaram uma correlação entre a evolução da Sodalis e da mosca tsé-tsé.[38] No entanto, ao contrário do simbionte primário da mosca tsé-tsé, Wigglesworthia, a Sodalis foi cultivada in vitro.[39]
Muitos outros insetos têm endossimbiontes secundários que não foram analisados aqui.[17][40]
Das formigas editar
O endossimbionte mais bem estudado das formigas são as bactérias do gênero Blochmannia, que são o endossimbionte primário das formigas Camponotus. Em 2018, um novo simbionte associado às formigas foi descoberto nas formigas Cardiocondyla. Esse simbionte foi denominado Candidatus Westeberhardia Cardiocondylae e também se acredita que seja um simbionte primário.[41]
De invertebrados marinhos editar
Os endossimbiontes extracelulares também estão representados em todas as quatro classes existentes de Echinodermata (Crinoidea, Ophiuroidea, Echinoidea e Holothuroidea). Pouco se sabe sobre a natureza da associação (modo de infecção, transmissão, requisitos metabólicos, etc.), mas a análise filogenética indica que esses simbiontes pertencem à classe Alphaproteobacteria, relacionando-os a Rhizobium e Thiobacillus. Outros estudos indicam que essas bactérias subcuticulares podem ser abundantes em seus hospedeiros e amplamente distribuídas entre os equinodermos em geral.[42]
Alguns oligoquetas marinhos (por exemplo, Olavius algarvensis e Inanidrillus spp.) têm endossimbiontes extracelulares obrigatórios que preenchem todo o corpo do hospedeiro. Esses vermes marinhos dependem nutricionalmente de suas bactérias quimioautotróficas simbióticas, sem nenhum sistema digestivo ou excretor (sem intestino, boca ou nefrídios).[43]
A lesma-do-mar Elysia chlorotica vive em uma relação endossimbiótica com a alga Vaucheria litorea, e a água-viva Mastigias tem uma relação semelhante com uma alga. A E. chlorotica forma essa relação intracelularmente com os cloroplastos das algas. Esses cloroplastos mantêm suas capacidades e estruturas fotossintéticas por vários meses depois de serem levados para as células da lesma.[44]
O animal muito simples Trichoplax tem dois endossimbiontes bacterianos. Uma delas é chamada Ruthmannia e vive dentro das células digestivas do animal. A outra é a Grellia, que vive permanentemente dentro do retículo endoplasmático (RE) do Trichoplax, o primeiro simbionte conhecido a fazer isso.[45]
Paracatenula é um platelminto que viveu em simbiose com uma bactéria endossimbiótica por 500 milhões de anos. A bactéria, que perdeu grande parte de seu genoma como simbionte, produz numerosas vesículas pequenas, semelhantes a gotículas, que fornecem ao hospedeiro todos os nutrientes de que ele precisa.[46]
Endossimbiontes dinoflagelados editar
Os endossimbiontes dinoflagelados do gênero Symbiodinium, comumente conhecidos como zooxantelas, são encontrados em corais, moluscos (especialmente moluscos gigantes, o Tridacna), esponjas e foraminíferos unicelulares. Esses endossimbiontes impulsionam a formação de recifes de coral capturando a luz solar e fornecendo aos seus hospedeiros energia para a deposição de carbonato.[47]
Anteriormente considerada uma única espécie, as evidências filogenéticas moleculares das últimas duas décadas mostraram que há uma grande diversidade no Symbiodinium. Em alguns casos, há especificidade entre o hospedeiro e o clado de Symbiodinium. Mais frequentemente, porém, há uma distribuição ecológica do Symbiodinium, com os simbiontes alternando entre hospedeiros com aparente facilidade. Quando os recifes sofrem estresse ambiental, essa distribuição de simbiontes está relacionada ao padrão observado de branqueamento e recuperação dos corais. Assim, a distribuição do Symbiodinium nos recifes de coral e sua função no branqueamento dos corais representa um dos problemas atuais mais complexos e interessantes na ecologia dos recifes.[47]
Endossimbiontes bacterianos de fitoplâncton editar
Em ambientes marinhos, os endossimbiontes bacterianos foram descobertos mais recentemente.[48][49][50][51] Essas relações endossimbióticas são especialmente predominantes em regiões oligotróficas ou pobres em nutrientes do oceano, como a do Atlântico Norte.[48][49][50][52] Nessas águas oligotróficas, o crescimento celular de fitoplânctons maiores, como o das diatomáceas, é limitado por baixas concentrações de nitrato.[53] As bactérias endossimbióticas fixam nitrogênio para seus hospedeiros diatomáceos e, por sua vez, recebem carbono orgânico da fotossíntese.[52] Essas simbioses desempenham um papel importante no ciclo global de carbono em regiões oligotróficas.[49][50][54]
Uma simbiose conhecida entre a diatomácea Hemialus spp. e a cianobactéria Richelia intracellularis foi encontrada no Atlântico Norte, no Mediterrâneo e no Oceano Pacífico.[48][49][55] O endossimbionte Richelia é encontrado na frústula da diatomácea Hemiaulus spp,[56] Uma pesquisa realizada por Foster et al. (2011) mediu a fixação de nitrogênio pela cianobactéria hospedeira R. intracellularis bem acima das necessidades intracelulares e descobriu que a cianobactéria provavelmente estava fixando o excesso de nitrogênio para as células do hospedeiro Hemiaulus.[53] Além disso, o crescimento celular tanto do hospedeiro quanto do simbionte foi muito maior do que o da R. intracellularis de vida livre ou do Hemiaulus spp. sem simbionte.[53] A simbiose Hemaiulus-Richelia não é obrigatória, especialmente em áreas com excesso de nitrogênio (repletas de nitrogênio).[48]
A R. intracellularis também é encontrada em Rhizosolenia spp, Uma diatomácea encontrada em oceanos oligotróficos.[50][52][53] Em comparação com o hospedeiro Hemaiulus, a endossimbiose com a Rhizosolenia é muito mais consistente, e a R. intracellularis é geralmente encontrada na Rhizosolenia.[48] Existem algumas Rhizosolenia assimbióticas (que ocorrem sem um endossimbionte), mas parece haver mecanismos que limitam o crescimento desses organismos em condições de baixo teor de nutrientes.[57] A divisão celular tanto para o hospedeiro diatomáceo quanto para o simbionte cianobacteriano pode ser desacoplada e os mecanismos para a passagem de simbiontes bacterianos para as células filhas durante a divisão celular ainda são relativamente desconhecidos.[57]
Outras endossimbioses com fixadores de nitrogênio em oceanos abertos incluem Calothrix em Chaetoceros spp. e UNCY-A em microalga primnesiófito.[58] A hipótese é que a endossimbiose Chaetoceros-Calothrix seja mais recente, já que o genoma do Calothrix está geralmente intacto. Enquanto outras espécies, como a do simbionte UNCY-A e Richelia, têm genomas reduzidos.[56] Essa redução no tamanho do genoma ocorre nas vias do metabolismo do nitrogênio, indicando que as espécies de endossimbiontes estão gerando nitrogênio para seus hospedeiros e perdendo a capacidade de usar esse nitrogênio de forma independente.[56] Essa redução do endossimbionte no tamanho do genoma pode ser uma etapa que ocorreu na evolução das organelas.[58]
Endossimbiontes bacterianos de protistas editar
O Mixotricha paradoxa é um protozoário que não possui mitocôndrias. Entretanto, bactérias esféricas vivem dentro da célula e desempenham a função das mitocôndrias. A Mixotricha também tem três outras espécies de simbiontes que vivem na superfície da célula.
Paramecium bursaria, uma espécie de ciliado, tem uma relação simbiótica mutualística com uma alga verde chamada Zoochlorella. As algas vivem dentro da célula, no citoplasma.[59]
A Platyophrya chlorelligera é um ciliado de água doce que abriga a Chlorella, que realiza a fotossíntese.[60][61]
Strombidium purpureum, um ciliado marinho que usa bactérias endossimbióticas púrpuras não sulfurosas para a fotossíntese anoxigênica.[62][63]
Paulinella chromatophora é um ameboide de água doce que recentemente (em termos evolutivamente) assumiu uma cianobactéria como endossimbionte.
Muitos foraminíferos são hospedeiros de vários tipos de algas, como algas vermelhas, diatomáceas, dinoflagelados e clorofitas.[64] Esses endossimbiontes podem ser transmitidos verticalmente para a próxima geração por meio da reprodução assexuada do hospedeiro, mas como os endossimbiontes são maiores do que os gametas dos foraminíferos, eles precisam adquirir novas algas novamente após a reprodução sexuada.[65]
Várias espécies de radiolários têm simbiontes fotossintéticos. Em algumas espécies, o hospedeiro às vezes digere as algas para manter sua população em um nível constante.[66]
O Hatena arenicola é um protista flagelado com um aparato alimentar complicado que se alimenta de outros micróbios. Mas quando ele engolfa uma alga verde do gênero Nephroselmis, o aparelho de alimentação desaparece e ele se torna fotossintético. Durante a mitose, a alga é transferida para apenas uma das duas células, e a célula sem a alga precisa iniciar o ciclo novamente.
Em 1966, o biólogo Kwang W. Jeon descobriu que uma cepa de laboratório da Amoeba proteus havia sido infectada por bactérias que viviam dentro dos vacúolos citoplasmáticos.[67] Essa infecção matou todos os protistas, exceto alguns indivíduos. Após o equivalente a 40 gerações de hospedeiros, os dois organismos gradualmente se tornaram mutuamente interdependentes. Ao longo de muitos anos de estudo, foi confirmado que ocorreu uma troca genética entre os procariontes e os protistas.[68][69][70]
Endossimbiontes bacterianos de vertebrados editar
A salamandra malhada (Ambystoma maculatum) vive em uma relação com a alga Oophila amblystomatis, que cresce nas caixas de ovos.[71]
Endossimbiontes bacterianos de plantas editar
As plantas são eucariotos fotossintéticos diversos com uma grande variedade de morfologias celulares e estilos de vida. As plantas são consideradas um dos produtores primários. As plantas, assim como todos os eucariotos fotossintéticos, dependem de uma organela intracelular conhecida como plastídeo ou cloroplasto (no caso de plantas e algas verdes). O cloroplasto é derivado de uma endossimbiose primária de cianobactérias há mais de um bilhão de anos. A cianobactéria de vida livre fotossintética e oxigênica foi engolida e mantida por um protista heterotrófico e acabou evoluindo para a organela intracelular atual ao longo de muitos anos.[72]
As simbioses de plantas podem ser categorizadas em epífitas, endofíticas e micorrízicas. A categoria micorrízica é usada somente para fungos. A relação de endossimbiose entre plantas e endossimbiontes também pode ser categorizada em benéfica, mutualística, neutra e patogênica.[73][74] Normalmente, a maioria dos estudos relacionados a simbioses de plantas ou endossimbiontes de plantas, como bactérias ou fungos endofíticos, concentra-se em uma única categoria ou espécie para entender melhor os processos e as funções biológicas, uma de cada vez. Mas essa abordagem não está ajudando a entender as complexas interações endossimbióticas e as funções biológicas no habitat natural.[75] Os microrganismos que vivem em associação como endossimbiontes com as plantas podem aumentar a produtividade primária das plantas produzindo ou capturando os recursos limitantes.[76] Esses endossimbiontes também podem aumentar a produtividade das plantas pela produção de metabólitos tóxicos que ajudam na defesa das plantas contra herbívoros.[77] No entanto, a função e o potencial dos microrganismos nas regulamentações da comunidade têm sido negligenciados há muito tempo, talvez devido ao tamanho microscópico e ao estilo de vida invisível.[78] Teoricamente, todas as plantas vasculares abrigam endossimbiontes (por exemplo, fungos e bactérias). Esses endossimbiontes colonizam as células e os tecidos das plantas predominantemente, mas não exclusivamente. Os endossimbiontes de plantas podem ser categorizados em diferentes tipos com base na função, relação e localização.
Os endossimbiontes de plantas, também chamados de endófitos, incluem bactérias, fungos, vírus, protozoários e até microalgas. Os endófitos ajudam as plantas em processos biológicos, como crescimento e desenvolvimento, absorção de nutrientes e defesa contra estresses bióticos e abióticos, como seca, salinidade, calor e herbívoros.[79]
Fungos como endossimbiontes de plantas editar
Todas as plantas vasculares têm endófitos fúngicos e bacterianos ou endossimbiontes que colonizam predominantemente, mas não exclusivamente, as raízes. Os endossimbiontes fúngicos podem ser encontrados em todos os tecidos da planta e, com base em sua localização na planta, os endossimbiontes fúngicos podem ser definidos de várias maneiras, como fungos que vivem nos tecidos da planta acima do solo são denominados endófitos, enquanto os fungos que vivem abaixo do solo (raízes) são conhecidos como micorrízicos, mas os fungos micorrízicos também têm nomes diferentes com base em sua localização dentro da raiz, que são ecto, endo, arbuscular, ericoide etc. Além disso, os endossimbiontes fúngicos que vivem nas raízes e estendem suas hifas extrarradiculares para a rizosfera externa são conhecidos como ectendossimbiontes.[80][81]
Fungos micorrízicos arbusculares (FMA) editar
Entre os endossimbiontes microbianos de plantas, os fungos micorrízicos arbusculares ou FMA são o grupo mais diversificado. Com algumas exceções da família Ericaceae, quase todas as plantas vasculares abrigam os endossimbiontes dos FMA, tanto endo quanto ecto. Os endossimbiontes FMA de plantas colonizam sistematicamente as raízes das plantas e ajudam o hospedeiro da planta com os nutrientes do solo e, como retorno, obtêm as fontes de carbono orgânico da planta.[80] Os exsudatos das raízes das plantas contêm uma diversidade de metabólitos secundários, especialmente flavonoides e estrigolactonas, que atuam como sinais químicos e atraem o FMA.[82] O fungo micorrízico arbusculares Gigaspora margarita não só vive como um endossimbionte da planta, mas também abriga outros organismos endossimbiontes semelhantes a bactérias intracitoplasmáticas.[83] Ao isolar as culturas puras de endossimbiontes de FMA, foi relatado que ele tem efeitos diferentes nos diferentes hospedeiros da planta. A introdução do FMA de uma planta pode reduzir o crescimento líquido da outra planta hospedeira, o que pode ter relação com o FMA já presente.[84] Além disso, os FMA são relatados em vários estudos como promotores da saúde e do crescimento das plantas e como agentes de alívio de estresses abióticos, como salinidade, seca, calor, má nutrição e toxicidade de metais.[85]
Fungos endofíticos editar
Além dos endossimbiontes micorrízicos, os fungos endofíticos também estão despertando o interesse dos cientistas por mostrarem muito potencial, não apenas em sua relação mutualística, em que beneficiam a planta hospedeira e também tiram vantagens, mas também por mostrarem resultados promissores em outros domínios, como ajudar a planta a crescer em ambientes poluídos, como ambientes altamente poluídos com metais tóxicos.[86] Os endófitos fúngicos são um grupo taxonomicamente diverso de fungos onipresentes, que são divididos em diferentes categorias com base no modo de transmissão, na biodiversidade, na colonização da planta e no tipo de planta hospedeira.[87][88] Essas categorias são clavicipitáceas e não clavicipitáceas, sendo que a primeira coloniza sistematicamente as gramíneas de estação temperada, enquanto a última coloniza plantas superiores e até mesmo raízes, e é por isso que pode ser dividida em outras categorias.[89] O Bacillus amyloliquefaciens é um fungo endofítico nascido na semente que produz giberelinas e promove a fisiologia. O B. amyloliquefaciens foi avaliado em um estudo por seu potencial de promoção do crescimento, no qual promove a maior altura das plantas transgênicas de arroz anão.[90] Da mesma forma, as espécies de fungos endofíticos Aureobasidium e Preussia isoladas da Boswellia sacra produzem o hormônio ácido indolacético para promover a saúde e o desenvolvimento das plantas.[91]
Os pulgões são os insetos mais comuns e podem ser encontrados na maioria das plantas, e as joaninhas carnívoras são os predadores especializados dos pulgões. Essas joaninhas são usadas em diferentes programas de controle de pragas. Foi realizado um estudo sobre o efeito da simbiose planta-endófito na população e na aptidão de joaninhas carnívoras. O fungo endofítico de plantas Neotyphodium lolii está produzindo micotoxinas alcaloides em resposta às invasões de pulgões. As joaninhas que se alimentam dos pulgões das plantas infectadas apresentaram taxa reduzida de fertilidade e desempenho reprodutivo anormal. As joaninhas adultas não foram afetadas de forma significativa em termos de simetria e tamanho do corpo. No entanto, os efeitos negativos consistentemente fortes dos endófitos sobre a aptidão geral das joaninhas sugerem que as micotoxinas são transmitidas ao longo da cadeia alimentar e afetam os predadores de topo.[76]
Bactérias endofíticas editar
As bactérias endofíticas pertencem a um grupo diversificado de endossimbiontes de plantas e são caracterizadas pela colonização sistemática dos tecidos internos das plantas. Os gêneros mais comuns de bactérias endofíticas incluem Pseudomonas, Bacillus, Acinetobacter, Actinobacteria e Sphingomonas. Além disso, alguns gêneros de bactérias endofíticas pertencem à família Enterobacteriaceae (Pirttila e Frank, 2011). As bactérias endofíticas colonizam principalmente os tecidos das folhas a partir das raízes das plantas, mas também podem entrar na planta pelas folhas por meio dos estômatos (Senthilkumar et al., 2011). Em geral, as bactérias endofíticas são isoladas dos tecidos das plantas por meio da esterilização da superfície do tecido da planta em um ambiente estéril.[92] Além disso, o isolamento de bactérias endofíticas de acordo com suas necessidades essenciais em ocupações de nicho foi explorado. É por isso que a comunidade bacteriana endofítica pode ser dividida em endófitos "passageiros" e "verdadeiros". As bactérias endofíticas de passagem são aquelas que eventualmente colonizam o tecido interno da planta por meio de eventos estocásticos, enquanto as verdadeiras endófitas possuem características adaptativas que as fazem viver estritamente em associação com as plantas.[93] A associação de bactérias endofíticas cultivadas in vitro com a planta é considerada uma relação mais íntima, na qual ela ajuda a planta a se aclimatar às condições e promove a saúde e o crescimento. As bactérias endofíticas são consideradas endossimbiontes essenciais da planta porque praticamente todas as plantas as abrigam, e esses endossimbiontes desempenham funções essenciais na sobrevivência da planta hospedeira.[94] Essa relação planta-endossimbionte é importante em termos de ecologia, evolução e diversidade. Além disso, as bactérias endofíticas, como Sphingomonas sp. e Serratia sp. isoladas de plantas de terras áridas, regulam o conteúdo de hormônios endógenos e promovem o crescimento das plantas cultivadas.[95]
Archaea como endossimbiontes de plantas editar
As arqueas são membros da maioria dos microbiomas. Embora as arqueias sejam altamente abundantes em ambientes extremos, elas são menos abundantes e diversificadas em associação com hospedeiros eucarióticos. No entanto, as arqueias são um componente substancial dos ecossistemas associados às plantas no fitobioma acima e abaixo do solo e desempenham uma função na saúde, no crescimento e na sobrevivência da planta hospedeira em estresses bióticos e abióticos. No entanto, apenas alguns estudos investigaram a função das arqueias na saúde das plantas e sua possível simbiose nos ecossistemas.[96] Em geral, a maioria dos estudos relacionados a endossimbiontes de plantas concentra-se em endossimbiontes fúngicos ou bacterianos usando abordagens metagenômicas.[97]
A caracterização das arqueas não se limita apenas às plantas cultivadas, como o arroz[98] e o milho, mas também foi identificada em muitas espécies de plantas aquáticas.[96] A abundância de arqueas é diferente em diferentes tecidos, por exemplo, as arqueas são mais abundantes na rizosfera do que na filosfera e na endosfera.[99] Essa abundância de arqueas está altamente associada ao tipo de espécie de planta, ao ambiente e ao estágio de desenvolvimento da planta.[100] Em um estudo realizado sobre a detecção de endófitos bacterianos e arqueas específicos de genótipos de plantas, 35% das sequências de arqueas foram detectadas nas sequências gerais (obtidas por meio de sequenciamento de amplicon e verificadas por PCR em tempo real). As sequências de arqueas pertencem aos filos Nitrososphaerota, Thermoproteota e Euryarchaeota.[101]
Endossimbiontes de bactérias editar
Algumas Betaproteobactérias têm endossimbiontes Gammaproteobactérias.[102]
Endossimbiontes de fungos editar
Os fungos abrigam bactérias endofílicas;[103] entretanto, os efeitos das bactérias sobre os fungos não foram bem estudados. Muitos fungos que abrigam essas bactérias endógenas, por sua vez, vivem dentro das plantas[103] e são conhecidos como endófitos fúngicos. A hipótese é que os fungos oferecem um refúgio seguro para as bactérias, e diversas bactérias colonizam esses refúgios, criando um microecossistema.[104] Essas interações são importantes porque podem afetar a maneira como os fungos interagem com o ambiente, modulando seus fenótipos.[103]
A maneira pela qual as bactérias fazem isso é alterando a expressão gênica dos fungos.[103] Por exemplo, foi demonstrado que Luteibacter sp. infecta naturalmente o endófito ascomiceto Pestalotiopsis sp. isolado de Platycladus orientalis.[103] O Luteibacter sp. influencia a produção de auxina e enzimas em seu hospedeiro, o que, por sua vez, pode influenciar o efeito que o fungo tem em seu hospedeiro vegetal.[103] Outro exemplo interessante de uma bactéria que vive em simbiose com um fungo é o fungo Mortierella. Esse fungo que habita o solo vive em estreita associação com uma bactéria produtora de toxina, Mycoavidus, que ajuda o fungo a se defender contra nematoides.[105] Essa é uma área de estudo muito nova, mas potencialmente muito importante, dentro do estudo da simbiose.
Associações vírus-hospedeiro editar
O projeto genoma humano encontrou vários milhares de retrovírus endógenos, elementos virais endógenos no genoma que se assemelham muito e podem ser derivados de retrovírus, organizados em 24 famílias.[106][107]
Veja também editar
Referências editar
- ↑ Margulis L, Chapman MJ (2009). Kingdoms & domains an illustrated guide to the phyla of life on Earth 4th ed. Amsterdam: Academic Press/Elsevier. p. 493. ISBN 978-0-08-092014-6
- ↑ Mergaert P (abril de 2018). «Role of antimicrobial peptides in controlling symbiotic bacterial populations». Natural Product Reports. 35 (4): 336–356. PMID 29393944. doi:10.1039/c7np00056a
- ↑ Little AF, van Oppen MJ, Willis BL (junho de 2004). «Flexibility in algal endosymbioses shapes growth in reef corals». Science. 304 (5676): 1492–1494. Bibcode:2004Sci...304.1491L. PMID 15178799. doi:10.1126/science.1095733
- ↑ Moore KR, Magnabosco C, Momper L, Gold DA, Bosak T, Fournier GP (2019). «An Expanded Ribosomal Phylogeny of Cyanobacteria Supports a Deep Placement of Plastids». Frontiers in Microbiology. 10. 1612 páginas. PMC 6640209 . PMID 31354692. doi:10.3389/fmicb.2019.01612
- ↑ McCutcheon JP (outubro de 2021). «The Genomics and Cell Biology of Host-Beneficial Intracellular Infections». Annual Review of Cell and Developmental Biology. 37 (1): 115–142. PMID 34242059. doi:10.1146/annurev-cellbio-120219-024122
- ↑ Callier V (8 de junho de 2022). «Mitochondria and the origin of eukaryotes». Knowable Magazine. doi:10.1146/knowable-060822-2 . Consultado em 18 de agosto de 2022
- ↑ Wierz JC, Gaube P, Klebsch D, Kaltenpoth M, Flórez LV (2021). «Transmission of Bacterial Symbionts With and Without Genome Erosion Between a Beetle Host and the Plant Environment». Frontiers in Microbiology. 12. 715601 páginas. PMC 8493222 . PMID 34630349. doi:10.3389/fmicb.2021.715601
- ↑ Ebert D (23 de novembro de 2013). «The Epidemiology and Evolution of Symbionts with Mixed-Mode Transmission». Annual Review of Ecology, Evolution, and Systematics (em inglês). 44 (1): 623–643. ISSN 1543-592X. doi:10.1146/annurev-ecolsys-032513-100555. Consultado em 19 de agosto de 2022
- ↑ a b Bright M, Bulgheresi S (março de 2010). «A complex journey: transmission of microbial symbionts». Nature Reviews. Microbiology. 8 (3): 218–230. PMC 2967712 . PMID 20157340. doi:10.1038/nrmicro2262
- ↑ Bright M, Bulgheresi S (março de 2010). «A complex journey: transmission of microbial symbionts». Nature Reviews. Microbiology. 8 (3): 218–230. PMC 2967712 . PMID 20157340. doi:10.1038/nrmicro2262
- ↑ a b Slatko, Barton E.; Taylor, Mark J.; Foster, Jeremy M. (1 de julho de 2010). «The Wolbachia endosymbiont as an anti-filarial nematode target». Symbiosis (em inglês). 51 (1): 55–65. ISSN 1878-7665. PMC 2918796 . PMID 20730111. doi:10.1007/s13199-010-0067-1
- ↑ Warrell D, Cox TM, Firth J, Török E (11 de outubro de 2012). Oxford Textbook of Medicine: Infection (em inglês). [S.l.]: OUP Oxford. ISBN 978-0-19-965213-6
- ↑ McCutcheon JP (outubro de 2021). «The Genomics and Cell Biology of Host-Beneficial Intracellular Infections». Annual Review of Cell and Developmental Biology. 37 (1): 115–142. PMID 34242059. doi:10.1146/annurev-cellbio-120219-024122
- ↑ Callier V (8 de junho de 2022). «Mitochondria and the origin of eukaryotes». Knowable Magazine. doi:10.1146/knowable-060822-2 . Consultado em 18 de agosto de 2022
- ↑ Sagan L (março de 1967). «On the origin of mitosing cells». Journal of Theoretical Biology. 14 (3): 255–274. Bibcode:1967JThBi..14..225S. PMID 11541392. doi:10.1016/0022-5193(67)90079-3
- ↑ Gabaldón T (outubro de 2021). «Origin and Early Evolution of the Eukaryotic Cell». Annual Review of Microbiology. 75 (1): 631–647. PMID 34343017. doi:10.1146/annurev-micro-090817-062213
- ↑ a b Wernegreen JJ (novembro de 2002). «Genome evolution in bacterial endosymbionts of insects». Nature Reviews. Genetics. 3 (11): 850–861. PMID 12415315. doi:10.1038/nrg931
- ↑ Campbell MA, Łukasik P, Simon C, McCutcheon JP (novembro de 2017). «Idiosyncratic Genome Degradation in a Bacterial Endosymbiont of Periodical Cicadas». Current Biology. 27 (22): 3568–3575.e3. PMC 8879801 . PMID 29129532. doi:10.1016/j.cub.2017.10.008
- ↑ a b Bright, Monika; Bulgheresi, Silvia (março de 2010). «A complex journey: transmission of microbial symbionts». Nature Reviews Microbiology (em inglês). 8 (3): 218–230. ISSN 1740-1534. PMC 2967712 . PMID 20157340. doi:10.1038/nrmicro2262
- ↑ Warrell D, Cox TM, Firth J, Török E (11 de outubro de 2012). Oxford Textbook of Medicine: Infection (em inglês). [S.l.]: OUP Oxford. ISBN 978-0-19-965213-6
- ↑ a b c Gage, Daniel J. (junho de 2004). «Infection and Invasion of Roots by Symbiotic, Nitrogen-Fixing Rhizobia during Nodulation of Temperate Legumes». Microbiology and Molecular Biology Reviews (em inglês). 68 (2): 280–300. ISSN 1092-2172. PMC 419923 . PMID 15187185. doi:10.1128/MMBR.68.2.280-300.2004
- ↑ a b c Shigenobu S, Watanabe H, Hattori M, Sakaki Y, Ishikawa H (setembro de 2000). «Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS». Nature. 407 (6800): 81–86. Bibcode:2000Natur.407...81S. PMID 10993077. doi:10.1038/35024074
- ↑ Chrostek, Ewa; Pelz-Stelinski, Kirsten; Hurst, Gregory D. D.; Hughes, Grant L. (2017). «Horizontal Transmission of Intracellular Insect Symbionts via Plants». Frontiers in Microbiology. 8: 2237. ISSN 1664-302X. PMC 5712413 . PMID 29234308. doi:10.3389/fmicb.2017.02237
- ↑ Smith, Noel H.; Gordon, Stephen V.; de la Rua-Domenech, Ricardo; Clifton-Hadley, Richard S.; Hewinson, R. Glyn (setembro de 2006). «Bottlenecks and broomsticks: the molecular evolution of Mycobacterium bovis». Nature Reviews Microbiology (em inglês). 4 (9): 670–681. ISSN 1740-1534. PMID 16912712. doi:10.1038/nrmicro1472
- ↑ Eleftherianos, Ioannis; Atri, Jaishri; Accetta, Julia; Castillo, Julio C. (2013). «Endosymbiotic bacteria in insects: guardians of the immune system?». Frontiers in Physiology. 4: 46. ISSN 1664-042X. PMC 3597943 . PMID 23508299. doi:10.3389/fphys.2013.00046
- ↑ Baumann P, Moran NA, Baumann L (2000). «Bacteriocyte-associated endosymbionts of insects». In: Dworkin M. The prokaryotes. New York: Springer
- ↑ Douglas AE (janeiro de 1998). «Nutritional interactions in insect-microbial symbioses: aphids and their symbiotic bacteria Buchnera». Annual Review of Entomology. 43: 17–37. PMID 15012383. doi:10.1146/annurev.ento.43.1.17
- ↑ Nalepa, Christine A. (2020). «Origin of Mutualism Between Termites and Flagellated Gut Protists: Transition From Horizontal to Vertical Transmission». Frontiers in Ecology and Evolution. 8. ISSN 2296-701X. doi:10.3389/fevo.2020.00014
- ↑ Wernegreen JJ (março de 2004). «Endosymbiosis: lessons in conflict resolution». PLOS Biology. 2 (3): E68. PMC 368163 . PMID 15024418. doi:10.1371/journal.pbio.0020068
- ↑ Moran NA (abril de 1996). «Accelerated evolution and Muller's rachet in endosymbiotic bacteria». Proceedings of the National Academy of Sciences of the United States of America. 93 (7): 2873–2878. Bibcode:1996PNAS...93.2873M. PMC 39726 . PMID 8610134. doi:10.1073/pnas.93.7.2873
- ↑ Aksoy S, Maudlin I, Dale C, Robinson AS, O'Neill SL (janeiro de 2001). «Prospects for control of African trypanosomiasis by tsetse vector manipulation». Trends in Parasitology. 17 (1): 29–35. PMID 11137738. doi:10.1016/S1471-4922(00)01850-X
- ↑ Oliver KM, Campos J, Moran NA, Hunter MS (fevereiro de 2008). «Population dynamics of defensive symbionts in aphids». Proceedings. Biological Sciences. 275 (1632): 293–299. PMC 2593717 . PMID 18029301. doi:10.1098/rspb.2007.1192
- ↑ International Aphid Genomics Consortium (fevereiro de 2010). «Genome sequence of the pea aphid Acyrthosiphon pisum». PLOS Biology. 8 (2): e1000313. PMC 2826372 . PMID 20186266. doi:10.1371/journal.pbio.1000313
- ↑ Jaenike J, Unckless R, Cockburn SN, Boelio LM, Perlman SJ (julho de 2010). «Adaptation via symbiosis: recent spread of a Drosophila defensive symbiont». Science. 329 (5988): 212–215. Bibcode:2010Sci...329..212J. PMID 20616278. doi:10.1126/science.1188235
- ↑ Hamilton PT, Peng F, Boulanger MJ, Perlman SJ (janeiro de 2016). «A ribosome-inactivating protein in a Drosophila defensive symbiont». Proceedings of the National Academy of Sciences of the United States of America. 113 (2): 350–355. Bibcode:2016PNAS..113..350H. PMC 4720295 . PMID 26712000. doi:10.1073/pnas.1518648113
- ↑ Ballinger MJ, Perlman SJ (junho de 2017). «Generality of toxins in defensive symbiosis: Ribosome-inactivating proteins and defense against parasitic wasps in Drosophila». PLOS Pathogens. 13 (7): e1006431. PMC 5500355 . PMID 28683136. doi:10.1371/journal.ppat.1006431
- ↑ Ballinger MJ, Perlman SJ (junho de 2017). «Generality of toxins in defensive symbiosis: Ribosome-inactivating proteins and defense against parasitic wasps in Drosophila». PLOS Pathogens. 13 (7): e1006431. PMC 5500355 . PMID 28683136. doi:10.1371/journal.ppat.1006431
- ↑ Aksoy, S., Pourhosseini, A. & Chow, A. 1995. Mycetome endosymbionts of tsetse flies constitute a distinct lineage related to Enterobacteriaceae. Insect Mol Biol. 4, 15–22.
- ↑ Welburn SC, Maudlin I, Ellis DS (junho de 1987). «In vitro cultivation of rickettsia-like-organisms from Glossina spp». Annals of Tropical Medicine and Parasitology. 81 (3): 331–335. PMID 3662675. doi:10.1080/00034983.1987.11812127
- ↑ Zchori-Fein E, Perlman SJ (junho de 2004). «Distribution of the bacterial symbiont Cardinium in arthropods». Molecular Ecology. 13 (7): 2009–2016. PMID 15189221. doi:10.1111/j.1365-294X.2004.02203.x
- ↑ Klein A, Schrader L, Gil R, Manzano-Marín A, Flórez L, Wheeler D, et al. (fevereiro de 2016). «A novel intracellular mutualistic bacterium in the invasive ant Cardiocondyla obscurior». The ISME Journal. 10 (2): 376–388. PMC 4737929 . PMID 26172209. doi:10.1038/ismej.2015.119
- ↑ Burnett WJ, McKenzie JD (maio de 1997). «Subcuticular bacteria from the brittle star Ophiactis balli (Echinodermata: Ophiuroidea) represent a new lineage of extracellular marine symbionts in the alpha subdivision of the class Proteobacteria». Applied and Environmental Microbiology. 63 (5): 1721–1724. Bibcode:1997ApEnM..63.1721B. PMC 168468 . PMID 9143108. doi:10.1128/AEM.63.5.1721-1724.1997
- ↑ Dubilier N, Mülders C, Ferdelman T, de Beer D, Pernthaler A, Klein M, et al. (maio de 2001). «Endosymbiotic sulphate-reducing and sulphide-oxidizing bacteria in an oligochaete worm». Nature. 411 (6835): 298–302. Bibcode:2001Natur.411..298D. PMID 11357130. doi:10.1038/35077067
- ↑ Mujer CV, Andrews DL, Manhart JR, Pierce SK, Rumpho ME (outubro de 1996). «Chloroplast genes are expressed during intracellular symbiotic association of Vaucheria litorea plastids with the sea slug Elysia chlorotica». Proceedings of the National Academy of Sciences of the United States of America. 93 (22): 12333–12338. Bibcode:1996PNAS...9312333M. PMC 37991 . PMID 8901581. doi:10.1073/pnas.93.22.12333
- ↑ Deceptively simple: Minute marine animals live in a sophisticated symbiosis with bacteria - Phys.org
- ↑ How a bacterium feeds an entire flatworm - Phys.org
- ↑ a b Baker AC (novembro de 2003). «Flexibility and Specificity in Coral-Algal Symbiosis: Diversity, Ecology, and Biogeography of Symbiodinium». Annual Review of Ecology, Evolution, and Systematics. 34: 661–89. doi:10.1146/annurev.ecolsys.34.011802.132417
- ↑ a b c d e Villareal T (1994). «Widespread occurrence of the Hemiaulus-cyanobacterial symbiosis in the southwest North Atlantic Ocean». Bulletin of Marine Science. 54: 1–7
- ↑ a b c d Carpenter EJ, Montoya JP, Burns J, Mulholland MR, Subramaniam A, Capone DG (20 de agosto de 1999). «Extensive bloom of a N2-fixing diatom/cyanobacterial association in the tropical Atlantic Ocean». Marine Ecology Progress Series. 185: 273–283. Bibcode:1999MEPS..185..273C. doi:10.3354/meps185273 . hdl:1853/43100
- ↑ a b c d Foster RA, Subramaniam A, Mahaffey C, Carpenter EJ, Capone DG, Zehr JP (março de 2007). «Influence of the Amazon River plume on distributions of free-living and symbiotic cyanobacteria in the western tropical north Atlantic Ocean». Limnology and Oceanography. 52 (2): 517–532. Bibcode:2007LimOc..52..517F. doi:10.4319/lo.2007.52.2.0517
- ↑ Subramaniam A, Yager PL, Carpenter EJ, Mahaffey C, Björkman K, Cooley S, et al. (julho de 2008). «Amazon River enhances diazotrophy and carbon sequestration in the tropical North Atlantic Ocean». Proceedings of the National Academy of Sciences of the United States of America. 105 (30): 10460–10465. PMC 2480616 . PMID 18647838. doi:10.1073/pnas.0710279105
- ↑ a b c Goebel NL, Turk KA, Achilles KM, Paerl R, Hewson I, Morrison AE, et al. (dezembro de 2010). «Abundance and distribution of major groups of diazotrophic cyanobacteria and their potential contribution to N₂ fixation in the tropical Atlantic Ocean». Environmental Microbiology. 12 (12): 3272–3289. PMID 20678117. doi:10.1111/j.1462-2920.2010.02303.x
- ↑ a b c d Foster RA, Kuypers MM, Vagner T, Paerl RW, Musat N, Zehr JP (setembro de 2011). «Nitrogen fixation and transfer in open ocean diatom-cyanobacterial symbioses». The ISME Journal. 5 (9): 1484–1493. PMC 3160684 . PMID 21451586. doi:10.1038/ismej.2011.26
- ↑ Scharek R, Tupas LM, Karl DM (11 de junho de 1999). «Diatom fluxes to the deep sea in the oligotrophic North Pacific gyre at Station Aloha». Marine Ecology Progress Series. 182: 55–67. Bibcode:1999MEPS..182...55S. doi:10.3354/meps182055 . hdl:10261/184131
- ↑ Zeev EB, Yogev T, Man-Aharonovich D, Kress N, Herut B, Béjà O, Berman-Frank I (setembro de 2008). «Seasonal dynamics of the endosymbiotic, nitrogen-fixing cyanobacterium Richelia intracellularis in the eastern Mediterranean Sea». The ISME Journal. 2 (9): 911–923. PMID 18580972. doi:10.1038/ismej.2008.56
- ↑ a b c Hilton JA, Foster RA, Tripp HJ, Carter BJ, Zehr JP, Villareal TA (23 de abril de 2013). «Genomic deletions disrupt nitrogen metabolism pathways of a cyanobacterial diatom symbiont». Nature Communications. 4 (1). 1767 páginas. Bibcode:2013NatCo...4.1767H. PMC 3667715 . PMID 23612308. doi:10.1038/ncomms2748
- ↑ a b Villareal TA (dezembro de 1989). «Division cycles in the nitrogen-fixingRhizosolenia(Bacillariophyceae)-Richelia(Nostocaceae) symbiosis». British Phycological Journal. 24 (4): 357–365. doi:10.1080/00071618900650371
- ↑ a b Zehr JP (setembro de 2015). «EVOLUTION. How single cells work together». Science. 349 (6253): 1163–1164. PMID 26359387. doi:10.1126/science.aac9752
- ↑ Dziallas, C.; Allgaier, M.; Monaghan, M. T.; Grossart, H. P. (2012). «Act together—implications of symbioses in aquatic ciliates». Frontiers in Microbiology. 3: 288. PMC 3413206 . PMID 22891065. doi:10.3389/fmicb.2012.00288
- ↑ Joint, Ian (29 de junho de 2013). Molecular Ecology of Aquatic Microbes (em inglês). [S.l.]: Springer Science & Business Media. ISBN 978-3-642-79923-5
- ↑ Kawakami, H. (1991). «An endosymbiotic Chlorella-bearing ciliate: Platyophrya chlorelligera Kawakami 1989». European Journal of Protistology. 26 (3–4): 245–255. PMID 23196282. doi:10.1016/S0932-4739(11)80146-X
- ↑ Fenchel, Tom; Bernard, Catherine (1993). «Endosymbiotic purple non-sulphur bacteria in an anaerobic ciliated protozoon». FEMS Microbiology Letters. 110: 21–25. doi:10.1111/j.1574-6968.1993.tb06289.x
- ↑ Paracer, Surindar; Ahmadjian, Vernon (6 de julho de 2000). Symbiosis: An Introduction to Biological Associations (em inglês). [S.l.]: Oxford University Press. ISBN 978-0-19-802788-1
- ↑ Joseph Seckbach; Patrick Kociolek (2011). The Diatom World. [S.l.]: Springer Science & Business Media. p. 439. ISBN 978-94-007-1327-7
- ↑ Toledo, Rafael Isaac Ponce (5 de março de 2018). Origins and early evolution of photosynthetic eukaryotes (Tese). Université Paris-Saclay
- ↑ Surindar Paracer; Vernon Ahmadjian (2000). Symbiosis: An Introduction to Biological Associations. [S.l.]: Oxford University Press. p. 155. ISBN 978-0-19-511807-0
- ↑ Jeon KW, Jeon MS (outubro de 1976). «Endosymbiosis in amoebae: recently established endosymbionts have become required cytoplasmic components». Journal of Cellular Physiology. 89 (2): 337–344. PMID 972171. doi:10.1002/jcp.1040890216
- ↑ «Kwang W. Jeon | Biochemistry & Cellular and Molecular Biology – UTK BCMB». 28 de abril de 2014
- ↑ Luigi Nibali; Brian Henderson (2016). The Human Microbiota and Chronic Disease: Dysbiosis as a Cause of Human Pathology. [S.l.]: John Wiley & Sons. p. 165. ISBN 978-1-118-98287-7
- ↑ K. Jeon, “Amoeba and X-bacteria: Symbiont Acquisition and Possible Species Change,” in: L. Margulis and R. Fester, eds., Symbiosis as a Source of Evolutionary Innovation (Cambridge, Mass.: MIT Press), c. 9.
- ↑ Kerney R, Kim E, Hangarter RP, Heiss AA, Bishop CD, Hall BK (abril de 2011). «Intracellular invasion of green algae in a salamander host». Proceedings of the National Academy of Sciences of the United States of America. 108 (16): 6497–6502. Bibcode:2011PNAS..108.6497K. PMC 3080989 . PMID 21464324. doi:10.1073/pnas.1018259108
- ↑ Qiu H, Yoon HS, Bhattacharya D (setembro de 2013). «Algal endosymbionts as vectors of horizontal gene transfer in photosynthetic eukaryotes». Frontiers in Plant Science. 4. 366 páginas. PMC 3777023 . PMID 24065973. doi:10.3389/fpls.2013.00366
- ↑ Hardoim PR, van Overbeek LS, Berg G, Pirttilä AM, Compant S, Campisano A, et al. (setembro de 2015). «The Hidden World within Plants: Ecological and Evolutionary Considerations for Defining Functioning of Microbial Endophytes». Microbiology and Molecular Biology Reviews. 79 (3): 293–320. PMC 4488371 . PMID 26136581. doi:10.1128/MMBR.00050-14
- ↑ Khare E, Mishra J, Arora NK (2018). «Multifaceted Interactions Between Endophytes and Plant: Developments and Prospects». Frontiers in Microbiology. 9. 2732 páginas. PMC 6249440 . PMID 30498482. doi:10.3389/fmicb.2018.02732
- ↑ Porras-Alfaro A, Bayman P (8 de setembro de 2011). «Hidden fungi, emergent properties: endophytes and microbiomes». Annual Review of Phytopathology. 49 (1): 291–315. PMID 19400639. doi:10.1146/annurev-phyto-080508-081831
- ↑ a b de Sassi C, Müller CB, Krauss J (maio de 2006). «Fungal plant endosymbionts alter life history and reproductive success of aphid predators». Proceedings. Biological Sciences. 273 (1591): 1301–1306. PMC 1560287 . PMID 16720406. doi:10.1098/rspb.2005.3442
- ↑ Schardl CL, Leuchtmann A, Spiering MJ (2 de junho de 2004). «Symbioses of grasses with seedborne fungal endophytes». Annual Review of Plant Biology. 55 (1): 315–340. PMID 15377223. doi:10.1146/annurev.arplant.55.031903.141735
- ↑ Hunter MD, Price PW (1992). «Playing Chutes and Ladders: Heterogeneity and the Relative Roles of Bottom-Up and Top-Down Forces in Natural Communities». Ecology. 73 (3): 724–732. ISSN 0012-9658. JSTOR 1940152. doi:10.2307/1940152
- ↑ Baron NC, Rigobelo EC (2022). «Endophytic fungi: a tool for plant growth promotion and sustainable agriculture». Mycology. 13 (1): 39–55. PMC 8856089 . PMID 35186412. doi:10.1080/21501203.2021.1945699
- ↑ a b Salhi LN, Bustamante Villalobos P, Forget L, Burger G, Lang BF (setembro de 2022). «Endosymbionts in cranberry: Diversity, effect on plant growth, and pathogen biocontrol». Plants, People, Planet (em inglês). 4 (5): 511–522. ISSN 2572-2611. doi:10.1002/ppp3.10290
- ↑ Roth R, Paszkowski U (outubro de 2017). «Plant carbon nourishment of arbuscular mycorrhizal fungi». Current Opinion in Plant Biology. 39 Cell signalling and gene regulation 2017. 39: 50–56. PMID 28601651. doi:10.1016/j.pbi.2017.05.008
- ↑ Oldroyd GE, Harrison MJ, Paszkowski U (maio de 2009). «Reprogramming plant cells for endosymbiosis». Science. 324 (5928): 753–754. Bibcode:2009Sci...324..753O. PMID 19423817. doi:10.1126/science.1171644
- ↑ Bianciotto V, Bandi C, Minerdi D, Sironi M, Tichy HV, Bonfante P (agosto de 1996). «An obligately endosymbiotic mycorrhizal fungus itself harbors obligately intracellular bacteria». Applied and Environmental Microbiology. 62 (8): 3005–3010. Bibcode:1996ApEnM..62.3005B. PMC 168087 . PMID 8702293. doi:10.1128/aem.62.8.3005-3010.1996
- ↑ Herre EA, Mejía LC, Kyllo DA, Rojas E, Maynard Z, Butler A, Van Bael SA (março de 2007). «Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae». Ecology. 88 (3): 550–558. PMID 17503581. doi:10.1890/05-1606
- ↑ Begum N, Qin C, Ahanger MA, Raza S, Khan MI, Ashraf M, et al. (2019). «Role of Arbuscular Mycorrhizal Fungi in Plant Growth Regulation: Implications in Abiotic Stress Tolerance». Frontiers in Plant Science. 10. 1068 páginas. PMC 6761482 . PMID 31608075. doi:10.3389/fpls.2019.01068
- ↑ Domka AM, Rozpaądek P, Turnau K (2019). «Are Fungal Endophytes Merely Mycorrhizal Copycats? The Role of Fungal Endophytes in the Adaptation of Plants to Metal Toxicity». Frontiers in Microbiology. 10. 371 páginas. PMC 6428775 . PMID 30930857. doi:10.3389/fmicb.2019.00371
- ↑ Rodriguez RJ, White JF, Arnold AE, Redman RS (abril de 2009). «Fungal endophytes: diversity and functional roles». The New Phytologist. 182 (2): 314–330. PMID 19236579. doi:10.1111/j.1469-8137.2009.02773.x
- ↑ Purahong W, Hyde KD (1 de março de 2011). «Effects of fungal endophytes on grass and non-grass litter decomposition rates». Fungal Diversity (em inglês). 47 (1): 1–7. ISSN 1878-9129. doi:10.1007/s13225-010-0083-8
- ↑ «Evolutionary Development of the Clavicipitaceae». The Fungal Community (em inglês): 525–538. 24 de maio de 2005. ISBN 9780429116407. doi:10.1201/9781420027891-33
- ↑ Shahzad R, Waqas M, Khan AL, Asaf S, Khan MA, Kang SM, et al. (setembro de 2016). «Seed-borne endophytic Bacillus amyloliquefaciens RWL-1 produces gibberellins and regulates endogenous phytohormones of Oryza sativa». Plant Physiology and Biochemistry. 106: 236–243. PMID 27182958. doi:10.1016/j.plaphy.2016.05.006
- ↑ Khan AL, Al-Harrasi A, Al-Rawahi A, Al-Farsi Z, Al-Mamari A, Waqas M, et al. (30 de junho de 2016). «Endophytic Fungi from Frankincense Tree Improves Host Growth and Produces Extracellular Enzymes and Indole Acetic Acid». PLOS ONE. 11 (6): e0158207. Bibcode:2016PLoSO..1158207K. PMC 4928835 . PMID 27359330. doi:10.1371/journal.pone.0158207
- ↑ Quadt-Hallmann A, Kloepper JW, Benhamou N (10 de fevereiro de 2011). «Bacterial endophytes in cotton: mechanisms of entering the plant». Canadian Journal of Microbiology (em inglês). 43 (6): 577–582. doi:10.1139/m97-081
- ↑ Hardoim PR, van Overbeek LS, Elsas JD (outubro de 2008). «Properties of bacterial endophytes and their proposed role in plant growth». Trends in Microbiology (em English). 16 (10): 463–471. PMID 18789693. doi:10.1016/j.tim.2008.07.008
- ↑ Bodył A, Mackiewicz P, Stiller JW (julho de 2007). «The intracellular cyanobacteria of Paulinella chromatophora: endosymbionts or organelles?». Trends in Microbiology (em English). 15 (7): 295–296. PMID 17537638. doi:10.1016/j.tim.2007.05.002
- ↑ Asaf S, Khan MA, Khan AL, Waqas M, Shahzad R, Kim A, Kang S, Lee I (1 de janeiro de 2017). «Bacterial endophytes from arid land plants regulate endogenous hormone content and promote growth in crop plants: an example of Sphingomonas sp. and Serratia marcescens». Journal of Plant Interactions (em inglês). 12 (1): 31–38. ISSN 1742-9145. doi:10.1080/17429145.2016.1274060
- ↑ a b Jung J, Kim JS, Taffner J, Berg G, Ryu CM (1 de janeiro de 2020). «Archaea, tiny helpers of land plants». Computational and Structural Biotechnology Journal. 18: 2494–2500. PMC 7516179 . PMID 33005311. doi:10.1016/j.csbj.2020.09.005
- ↑ Taffner J, Cernava T, Erlacher A, Berg G (setembro de 2019). «Novel insights into plant-associated archaea and their functioning in arugula (Eruca sativa Mill.)». Journal of Advanced Research. Special Issue on Plant Microbiome. 19: 39–48. PMC 6629838 . PMID 31341668. doi:10.1016/j.jare.2019.04.008
- ↑ Ma M, Du H, Sun T, An S, Yang G, Wang D (fevereiro de 2019). «Characteristics of archaea and bacteria in rice rhizosphere along a mercury gradient». The Science of the Total Environment. 650 (Pt 1): 1640–1651. Bibcode:2019ScTEn.650.1640M. PMID 30054090. doi:10.1016/j.scitotenv.2018.07.175
- ↑ Knief C, Delmotte N, Chaffron S, Stark M, Innerebner G, Wassmann R, et al. (julho de 2012). «Metaproteogenomic analysis of microbial communities in the phyllosphere and rhizosphere of rice». The ISME Journal. 6 (7): 1378–1390. PMC 3379629 . PMID 22189496. doi:10.1038/ismej.2011.192
- ↑ Moissl-Eichinger C, Pausan M, Taffner J, Berg G, Bang C, Schmitz RA (janeiro de 2018). «Archaea Are Interactive Components of Complex Microbiomes». Trends in Microbiology. 26 (1): 70–85. PMID 28826642. doi:10.1016/j.tim.2017.07.004
- ↑ Müller H, Berg C, Landa BB, Auerbach A, Moissl-Eichinger C, Berg G (2015). «Plant genotype-specific archaeal and bacterial endophytes but similar Bacillus antagonists colonize Mediterranean olive trees». Frontiers in Microbiology. 6. 138 páginas. PMC 4347506 . PMID 25784898. doi:10.3389/fmicb.2015.00138
- ↑ Von Dohlen, Carol D., Shawn Kohler, Skylar T. Alsop, and William R. McManus. "Mealybug β-proteobacterial endosymbionts contain γ-proteobacterial symbionts." Nature 412, no. 6845 (2001): 433-436.
- ↑ a b c d e f Shaffer JP, Carter ME, Spraker JE, Clark M, Smith BA, Hockett KL, et al. (abril de 2022). Lindemann SR, ed. «Transcriptional Profiles of a Foliar Fungal Endophyte (Pestalotiopsis, Ascomycota) and Its Bacterial Symbiont (Luteibacter, Gammaproteobacteria) Reveal Sulfur Exchange and Growth Regulation during Early Phases of Symbiotic Interaction». mSystems. 7 (2): e0009122. PMC 9040847 . PMID 35293790. doi:10.1128/msystems.00091-22
- ↑ Arnold AE (abril de 2022). «Bacterial-fungal interactions: Bacteria take up residence in the house that Fungi built». Current Biology. 32 (7): R327–R328. PMID 35413262. doi:10.1016/j.cub.2022.02.024
- ↑ Büttner H, Niehs SP, Vandelannoote K, Cseresnyés Z, Dose B, Richter I, et al. (setembro de 2021). «Bacterial endosymbionts protect beneficial soil fungus from nematode attack». Proceedings of the National Academy of Sciences of the United States of America. 118 (37): e2110669118. Bibcode:2021PNAS..11810669B. PMC 8449335 . PMID 34504005. doi:10.1073/pnas.2110669118
- ↑ Villarreal LP (outubro de 2001). «Persisting Viruses Could Play Role in Driving Host Evolution». ASM News. Cópia arquivada em 8 de maio de 2009
- ↑ Belshaw R, Pereira V, Katzourakis A, Talbot G, Paces J, Burt A, Tristem M (abril de 2004). «Long-term reinfection of the human genome by endogenous retroviruses». Proceedings of the National Academy of Sciences of the United States of America. 101 (14): 4894–4899. Bibcode:2004PNAS..101.4894B. PMC 387345 . PMID 15044706. doi:10.1073/pnas.0307800101