Termodinâmica clássica
Denomina-se Termodinâmica clássica ao ramo da Termodinâmica que surgiu primeiramente com o entendimento progressivo dos conceitos de trabalho, calor, energia e entropia no contexto clássico.[1]
Essa abordagem, por motivos óbvios, tinha uma feição eminentemente fenomenológica. Não havia então uma teoria constitutiva da matéria totalmente aceita e satisfatória para descrever os sistemas microscópicos e, por derivação, os sistemas macroscópicos. A teoria cinético-molecular não havia sido plenamente desenvolvida ainda, e não foi senão na transição do século XIX para o século XX que o paradigma energeticista, defendido por Helm, Ostwald e Mach foi cedendo terreno para o paradigma atomista, defendido por Ludwig Boltzmann e Felix Klein. Mais tarde a mecânica estatística e termodinâmica estatística surgiram como disciplinas plenas, baseadas principalmente nos estudos de Boltzmann.
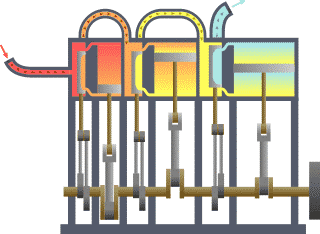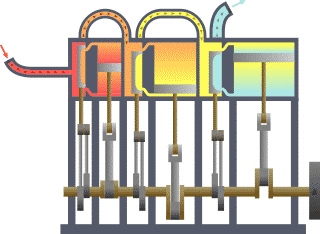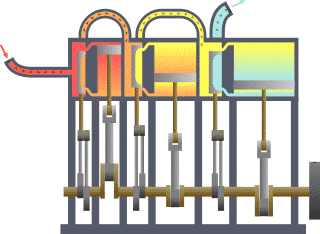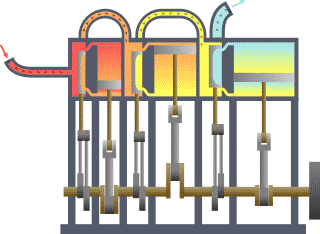
Leis da Termodinâmica editar
A termodinâmica é baseada em leis estabelecidas experimentalmente:
- A Lei Zero da Termodinâmica[2] determina que, quando dois sistemas em equilíbrio termodinâmico têm igualdade de temperatura com um terceiro sistema também em equilíbrio, eles têm igualdade de temperatura entre si. Esta lei é a base empírica para a medição de temperatura. Ela também estabelece o que vem a ser um sistema em equilíbrio termodinâmico: dado tempo suficiente, um sistema isolado atingirá um estado final - o estado de equilíbrio termodinâmico - onde nenhuma transformação macroscópica será doravante observada, caracterizando-se este por uma homogeneidade das grandezas termodinâmicas ao longo de todo o sistema (temperatura, pressão, volumes parciais constantes).
- A Primeira Lei da Termodinâmica[3] fornece o aspecto quantitativo de processos de conversão de energia. É o princípio da conservação da energia e da conservação da massa, agora familiar: "A energia do Universo, sistema mais vizinhança, é constante".
- A Segunda Lei da Termodinâmica determina de forma quantitativa a viabilidade de processos em sistemas físicos no que se refere à possibilidade de troca de energia e à ocorrência ou não destes processos na natureza. Afirma que há processos que ocorrem numa certa direção mas não podem ocorrer na direção oposta. Foi enunciada por Clausius da seguinte maneira: "A entropia do Universo, [sistema mais vizinhança], tende a um máximo": somente processos que levem a um aumento, ou quando muito à manutenção, da entropia total do sistema mais vizinhança são observados na natureza. Em sistemas isolados, transformações que impliquem uma diminuição em sua entropia jamais ocorrerão.
- A Terceira Lei da Termodinâmica estabelece um ponto de referência absoluto para a determinação da entropia, representado pelo estado derradeiro de ordem molecular máxima e mínima energia. Enunciada como: "A entropia de uma substância cristalina pura na temperatura zero absoluto é zero".
Referências
- ↑ admin (19 de julho de 2016). «Termodinâmica, Física, Análise, O que é Termodinâmica». Portal São Francisco. Consultado em 12 de outubro de 2020
- ↑ Termodinâmica, Teoria Cinética e Termodinâmica Estatística - Sears, Francis W.; Salinger, Gerhard L. - Terceira edição - Guanabara Dois - 1979 - Rio de Janeiro - RJ
- ↑ Callen, Hebert B. (1985). Thermodynamics and an Introduction to Thermosthatics. [S.l.]: John Wiley & Sons.