Trifosfato de adenosina
| Trifosfato de adenosina Alerta sobre risco à saúde | |
|---|---|
| |
| |
| Nome IUPAC | [(2R,3S,4R,5R)-5-(6-aminopurina-9-il)-3,4-dihidroxioxolano-2- il]metil (hidróxi-fosfonooxifosforil) fosfato de hidrogênio |
| Outros nomes | adenosina 5'-(tetrahidrogênio trifosfato) |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| Propriedades | |
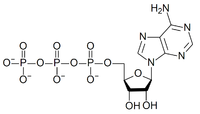
| Fórmula química | C10H16N5O13P3 |
| Massa molar | 507.11 g mol-1 |
| Acidez (pKa) | 6.5 |
| Termoquímica | |
| Entalpia padrão de combustão ΔcH |
7 Kcal/mol[1] |
| Compostos relacionados | |
| Fosfatos de adenosina relacionados | Monofosfato de adenosina Difosfato de adenosina (ADP) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Trifosfato de adenosina, adenosina trifosfato ou simplesmente ATP, é um nucleotídeo responsável pelo armazenamento de energia em suas ligações químicas. É constituída por adenosina, um nucleosídeo, associado a três radicais fosfato conectados em cadeia. A energia é armazenada nas ligações entre os fosfatos.


A molécula atua como uma moeda celular, ou seja, é uma forma conveniente de transformação da energia. A molécula ATP armazena energia proveniente da respiração celular e da fotossíntese, para consumo imediato. Seu aproveitamento é feito associando a remoção de seu grupo fosfato terminal aos processos que requerem energia. Desta forma, a energia química armazenada no ATP pode ser utilizada em processos químicos (biossíntese), mecânicos (contração muscular), elétricos (condução de estímulo nervoso), osmóticos (transporte ativo através de membranas), luminosos (bioluminescência) e etc.[2] Sua energia não pode ser estocada, seu uso é imediato, energia só pode ser estocada na forma de carboidratos e lipídios.
As principais formas de produção do ATP são a fosforilação oxidativa e a fotofosforilação. Um radical fosfato inorgânico (Pi) é adicionado a uma molécula de ADP (adenosina difosfato), utilizando energia proveniente da decomposição da glicose (na fosforilação oxidativa) ou da luz (na fotofosforilação).
Existem enzimas especializadas no rompimento desta mesma ligação, liberando fosfato e energia, usada nos processos celulares, gerando novamente moléculas de ADP. Em certas ocasiões, o ATP é degradado até sua forma mais simples, o AMP (adenosina monofosfato), liberando três fosfatos e uma quantidade maior de energia.
Estima-se que o corpo humano adulto produza o próprio peso em ATP a cada 24 horas, porém consumindo outros tantos no mesmo período.[3] Se a energia gerada na queima da glicose não fosse armazenada em moléculas de ATP, provavelmente as células seriam rapidamente destruídas pelo calor gerado.
Liberação de energia editar
Deve-se levar em conta que a quebra do ATP não é simplesmente um rompimento de ligações químicas. Sabe-se que a destruição de ligações químicas é um processo endotérmico, e isso seria uma contradição. Na verdade, a transformação da ATP em ADP + P é uma hidrólise, ou seja, a água é um dos reagentes desse processo. A formação de ligações covalentes no final da transformação libera mais energia do que a absorção na quebra das ligações presentes entre os átomos das moléculas de ATP e água. Dessa forma, a reação global acaba se tornando exotérmica.
Outros fatores contribuem para que esse composto orgânico libere energia ao ser quebrado. Os produtos ADP + P possuem maior entropia do que o reagente ATP, ou seja, os produtos possuem maior grau de desorganização do que o reagente. Além disso, o fosfato inorgânico apresenta o fenômeno da ressonância (eletróns das ligações π em movimento dentro do próprio composto). Há também, dentro da molécula, átomos de oxigênio com excesso de carga negativa e que estão muito próximos uns dos outros. Isso gera repulsão eletrostática entre essas cargas, e a decomposição do ATP diminui essa repulsão, pelo afastamento dessas cargas. Por fim, a hidratação dos compostos ADP e P libera uma considerável quantidade de energia. Tudo isso faz com que o sistema composto por ADP e P seja mais estável do que o composto por ATP. Essa estabilidade se dá pelo fato de que ocorre, durante a reação de decomposição do ATP, diminuição da energia livre desse sistema, em outras palavras, liberação de energia.
Assim, processos metabólicos como A + B → C que necessitem de grande quantidade de energia para acontecer ou não são espontâneos, ocorrem espontaneamente na presença de ATP, processo representado por A + B + ATP + H2O → C + ADP + P, o que garante o funcionamento de organismos vivos.
Processos implicados na formação de ATP editar
- Fotossíntese —captação de Energia Luminosa que é transformada em Energia Química => seres Foto-Autotróficos
- Quimiossíntese — obtêm energia oxidando a matéria inorgânica --> seres Quimio-Autotróficos.
Processos implicados no uso de ATP editar
- Respiração Celular ou Respiração Aeróbia — decomposição de nutrientes na presença de oxigénio (O2) a fim de obter ATP => Todos os Seres Vivos Aeróbios
- Fermentação (Respiração Anaeróbia) — decomposição de nutrientes na ausência de oxigénio (O2) a fim de obter ATP => seres anaeróbios.
História editar
O ATP foi descoberto em 1929 por Karl Lohmann[4] e Jendrassik[5] e, ao mesmo tempo e de forma independente, também por Cyrus Fiske e Yellapragada Subba Rao, alunos da Escola de Medicina Harvard.[6]
Em 1941, Fritz Albert Lipmann propôs que o ATP agia como um intermediário entre as reações de geração e de consumo de energia nas células.[7]
Foi sintetizado pela primeira vez em 1948, por Alexander Todd.[8]
O Prêmio Nobel de Química de 1997 foi outorgado a Paul D. Boyer e John E. Walker, "por suas descobertas acerca do mecanismo de ação enzimático que possibilitou a síntese da adenosina trifosfato",[9] e a Jens C. Skou, "por sua descoberta pioneira de uma enzima transportadora de íons".[9]
Ver também editar
Referências
- ↑ http://www.sobiologia.com.br/conteudos/bioquimica/bioquimica2.php
- ↑ MARZZOCO, Anita; TORRES, Bayardo Baptista (junho de 2015). «Bioquímica Básica, 4ª edição.». Bioquímica Básica, 4ª edição.
- ↑ Törnroth-Horsefield S, Neutze R (dezembro de 2008). «Opening and closing the metabolite gate». Proc. Natl. Acad. Sci. U.S.A. 105 (50): 19565–6. PMC 2604989 . PMID 19073922. doi:10.1073/pnas.0810654106
- ↑ Lohmann, K. (agosto de 1929). «Über die Pyrophosphatfraktion im Muskel» [On the pyrophosphate fraction in muscle]. Naturwissenschaften (em alemão). 17: 624–625. Bibcode:1929NW.....17..624.. doi:10.1007/BF01506215
- ↑ Vaughan, Martha; Hill, Robert L.; Simoni, Robert D. (2002). «The Determination of Phosphorus and the Discovery of Phosphocreatine and ATP: the Work of Fiske and SubbaRow». Journal of Biological Chemistry. 277: e21. PMID 12161449. Consultado em 24 de outubro de 2017. Cópia arquivada em 8 de agosto de 2017
- ↑ Maruyama, K. (março de 1991). «The discovery of adenosine triphosphate and the establishment of its structure». J. Hist. Biol. 24: 145–154. doi:10.1007/BF00130477
- ↑ Lipmann, F. (1941). «Metabolic generation and utilization of phosphate bond energy.». Adv. Enzymol. 1: 99–162. ISSN 0196-7398
- ↑ «History: ATP first discovered in 1929». The Nobel Prize in Chemistry 1997. Nobel Foundation. Consultado em 26 de maio de 2010. Cópia arquivada em 23 de janeiro de 2010
- ↑ a b «The Nobel Prize in Chemistry 1997». www.nobelprize.org. Consultado em 21 de janeiro de 2018. Cópia arquivada em 24 de outubro de 2017