GLUT4
| editar |
O GLUT 4, também denominado transportador de glicose 4 ou membro 4 da família 2 de carreador de soluto é uma proteína transportadora codificada pelo gene SLC2A4[1], sendo abundante nas membranas celulares do músculo esquelético, cardíaco e tecido adiposo.[2] Existem evidências de que o gene que codifica o GLUT 4 foi conservado durante a evolução dos vertebrados, já que o mesmo é encontrado em mamíferos (41 espécies), répteis (2 espécies) e peixes com nadadeiras raiadas (10 espécies).[3] A primeira evidência para a existência dessa proteína foi fornecida por David James em 1988.[3][4]
Apesar de possuir a menor cinética da família dos GLUT, esse transportador apresenta uma grande afinidade pelo seu substrato, a glicose.[2] Sendo assim, a principal função do GLUT 4, que é um transportador insulina-dependente[2], é realizar o transporte por difusão facilitada de glicose, proporcionando um fluxo bidirecional desse elemento. Como este transporte é realizado a favor do gradiente de concentração, a presença dessas proteínas transportadoras se torna essencial.[5] Todavia, em momentos onde o estímulo não é tão alto, a densidade de GLUT4 na membrana das células é muito baixa. Nesse caso, o GLUT se encontra presente em vesículas citoplasmáticas, cujo número varia entre os tecidos, dependendo da atividade dos mesmos.[2]
Estrutura editar
Através de análises, foi sugerida a presença de 12 segmentos transmembrânicos hidrofóbicos conectados por segmentos hidrofilícos na estrutura molecular do GLUT 4. Esses segmentos transmembrânicos formam alfa-hélices perpendiculares ao plano da membrana plasmática, constituindo poros e canais por onde a molécula de glicose atravessa. As sequências de aminoácidos presentes nesses segmentos são altamente conservadas entre as diversas isoformas de GLUT, o que sugere que esses resíduos determinam uma função comum a todas essas isoformas, ou seja, o transporte de glicose. No entanto, as diferenças aumentam nas extremidades NH2 e COOH, sugerindo que esses domínios estão envolvidos nas características específicas de cada GLUT, ou seja, na regulação hormonal, localização celular e imunogenicidade.[5] Entre as sequências únicas presentes no GLUT 4, encontra-se um resíduo de fenilalanina na sequência N-terminal e dois resíduos de leucina e motivos ácidos na extremidade COOH.[7]
Distribuição nos tecidos editar
Músculo Esquelético editar
O GLUT4 é o principal transportador de glicose presente no músculo esquelético, e é encontrado e armazenado no meio intracelular.[8] A contração do músculo esquelético juntamente com o aumento das taxas de insulina no sangue estimulam a ação do GLUT4 e a captação de glicose, através de diversas cascatas de sinalização.[9] Isso ocorre pois a contração muscular e o esforço físico provocam a formação da adenosina monofosfato (AMP), que interfere no processo favorecendo um aumento na taxa de transcrição do GLUT4 e, consequentemente, uma maior translocação deste.[2] As vesículas transportadoras de GLUT4 podem ser divididas em dois grupos: as vesículas que são receptores positivos para transferrina (transportadora de ferro) e fazem parte de compartimentos endossomais, e as vesículas que são receptores negativos para transferrina e não são endossomais, provavelmente fazendo parte de um compartimento específico do GLUT4.[9] O uso de cada tipo de vesícula requer um estímulo específico. A vesícula positiva para transferrina é utilizada mediante contrações musculares, ao passo que a vesícula negativa é ativada pela presença de insulina em grandes concentrações e pelo exercício físico.[8]
Músculo Cardíaco editar
O transportador GLUT4 está presente no músculo cardíaco, no meio intracelular (assim como no músculo esquelético e adipócitos), e sua ação é estimulada pela combinação de exercícios físicos e presença de insulina no sangue.[10] O estado de jejum também pode ser favorável a ação do GLUT4, já que quando o metabolismo se encontra nessas condições, o outro transportador encontrado no músculo cardíaco (GLUT1) estará em baixa concentração, e o GLUT4 permanece em concentrações normais.[11] O GLUT4 é constantemente translocado entre o meio intracelular e a membrana plasmática, para facilitar a difusão de glicose para o meio intracelular (ou para fazer exocitose).[10]
Tecido Adiposo editar
O tecido adiposo é responsável por regular a homeostase da glicose e a massa gorda corporal, e é capaz de se relacionar com diversos tecidos e órgãos. Em adipócitos com problemas funcionais, pode haver uma expressão desregulada de GLUT4 e um aumento na captação de glicose, o que favorece o acúmulo de gordura no organismo e pode levar o indivíduo a um quadro de obesidade. Já em células com redução da expressão do GLUT4, a captação de glicose pelo adipócito é reduzida, mas o armazenamento de gordura continua ocorrendo normalmente.[12]
Regulação editar
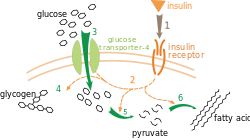
A captação de glicose pelos miócitos e adipócitos é mediada pelo transportador de glicose GLUT4. Durante o repouso e entre as refeições, alguns GLUT4 estão presentes na membrana plasmática, mas a grande maioria (podendo chegar a 95% em adipócitos) encontra-se retida nas membranas de pequenas vesículas intracelulares[13]. A insulina liberada pelo pâncreas em resposta à alta concentração de glicose sanguínea desencadeia o movimento dessas vesículas intracelulares à membrana plasmática, com a qual elas se fundem, levando as moléculas de GLUT4 para a membrana plasmática. Com mais moléculas de GLUT4 em ação, a taxa de captação de glicose aumenta em 15 vezes ou mais, participando ativamente no controle da glicemia nos tecidos e no plasma.[14]. Quando os níveis de glicose sanguínea retornam ao normal, a liberação de insulina torna-se lenta, e a maioria das moléculas de GLUT4 é removida da membrana plasmática e armazenada novamente em vesículas pelo processo de endocitose.[15]
Altos níveis de insulina geram aumento na síntese do glicogênio nos miócitos pela ativação da PP1 e inativação da GSK3. Miócitos possuem vesículas intracelulares que funcionam como uma reserva de transportadores GLUT4.[14] Em baixos níveis de insulina, cerca de 10% do GLUT4 está na membrana plasmática e 90% nas vesículas intracelulares, mas quando estimulados pela insulina, migram para membrana plasmática e propicia aumento na captação de glicose. A ligação da insulina a seu receptor aciona o mecanismo de sinalização intracelular e a ligação/ativação do IRS1 com a enzima PI3-quinase é um passo essencial para ativar um sistema ainda pouco conhecido, que promove um rápido deslocamento das vesículas intracelulares para a superfície celular, onde fundem-se com a membrana plasmática, aumentando a densidade de proteínas transportadoras GLUT4.[15] Com isso, ocorre baixa da glicose sanguínea através dos miócitos, já que aumentam a taxa de captação de glicose, a síntese de glicogênio e a glicólise.[14]
Miócitos com vesículas de GLUT4 localizam-se principalmente nos tecidos adiposo branco e marrom, musculatura esquelética e cardíaca. No tecido adiposo, redução na expressão de GLUT4 associa-se com obesidade e desenvolvimento da RI, independentemente da regulação que ocorrer em músculo esquelético. Esta regulação negativa do GLUT4 em tecido adiposo é observada de forma consistente em estados de RI, tais como obesidade, DM2 e síndrome metabólica.[15]
Em casos de inflamação tecidual, e resistência à insulina há estímulo do fator de necrose tumoral (TNF-α) e demais substâncias do processo inflamatório, que diminuem a densidade dos GLUT na membrana e torna o músculo mais resistente à captação de glicose. Em animais diabéticos o nível de GLUT4, tanto nos adipócitos e células musculares cardíacas e esqueléticas, está diminuindo. Por isso, exercícios físicos fatigantes devem ser evitados por indivíduos diabéticos, de modo a evitar lesões a tecidos musculares. Além disso, deve-se evitar dietas ricas em gordura, já que estas diminuem os níveis de GLUT4 nos adipócitos e músculos.[2]
Importância Clínica editar
Os tecidos que possuem resistência à insulina também possuem deficiência na captação de glicose e são indicativos do surgimento de diversas doenças, tais como: hipertensão, aterosclerose, diabetes mellitus e obesidade. Em portadores de diabetes mellitus tipo 2, notou-se, após experimentos com modelos animais, que as células do tecido adiposo branco aumentam seu volume cerca de 15 vezes, enquanto a quantidade GLUT4 não aumenta proporcionalmente, aparecendo com uma frequência apenas 3 vezes maior, demonstrando uma regulação tecido específica do GLUT4, pois ocorre apenas no tecido adiposo. Em relação à obesidade, constatou-se também em modelos animais que, enquanto o quadro não está estabelecido, a resistência ao hormônio insulina encontra-se regular ou aumentada, tendência seguida pelo GLUT4. Apenas quando a obesidade já está estabelecida, a resistência à insulina está instalada e há redução na quantidade de GLUT4 em todos os tecidos.[5]
Interações editar
A principal interação de GLUT4 é, obviamente, com a insulina. A insulina induz o aumento de isquemia miocárdica e do número de transportadores GLUT4 na membrana da célula cardíaca. Quando os níveis energéticos estão baixos e os níveis de AMP aumentam ocorre a indução dos transportadores GLUT4, assim a glicose pode ser transportada da circulação para dentro do músculo e fornecer energia.[16]
O GLUT 4 pode interagir com a proteína Daxx, associada à regulação da morte celular (apoptose) através de domínios semelhantes, encontrados tanto no transportador como na proteína. Quando essa interação acontece, a proteína Daxx é translocada para o espaço intracelular.[17]
Há indícios da presença do gene de GLUT4 no sistema nervoso central, como no hipocampo, estrutura relacionada à memória e ao sistema límbico, e a deficiência do seu transporte nessa estrutura acarreta diminuição das atividades metabólicas dos neurônios, podendo levar à depressão e disfunção cognitiva. Há substratos anatômicos na sinalização da insulina no hipocampo demonstrando que a translocação estimulada por insulina de GLUT4 para a membrana plasmática do hipocampo ocorre por mecanismos semelhantes aos descritos em tecidos periféricos. Com isso, sugere-se que a translocação mediada por insulina de GLUT4 pode fornecer um mecanismo que estimula um aumento dos neurônios do hipocampo através da utilização de glicose durante o aumento da atividade neuronal associada à aprendizagem dependente do hipocampo.[16][17]
Referências
- ↑ «Symbol report for SLC2A4». Consultado em 11 de dezembro de 2018
- ↑ a b c d e f da Silva, Cássio Eccker. «Transportadores de glicose: Tecidos dependentes e independentes de insulina» (PDF). Universidade Federal do Rio Grande do Sul. Consultado em 10 de dezembro de 2018
- ↑ a b Planas, Josep V.; Camps, Marta; Carvalho-Simoes, Francisco; Capilla, Encarnación; Marín-Juez, Rubén (18 de junho de 2014). «Structural and Functional Evolution of Glucose Transporter 4 (GLUT4): A Look at GLUT4 in Fish». Glucose Homeostasis (em inglês). doi:10.5772/58094
- ↑ Pilch, Paul F.; Navarro, Javier; Brown, Robert; James, David E. (maio de 1988). «Insulin-regulatable tissues express a unique insulin-sensitive glucose transport protein». Nature (em inglês). 333 (6169): 183–185. ISSN 1476-4687. doi:10.1038/333183a0
- ↑ a b c Machado, Ubiratan Fabres (dezembro de 1998). «Transportadores de glicose». Arquivos Brasileiros de Endocrinologia & Metabologia. 42 (6): 413–421. ISSN 0004-2730. doi:10.1590/S0004-27301998000600003
- ↑ Buchberger, A.; Howard, M. J.; Proctor, M.; Bycroft, M. (16 de março de 2001). «The UBX domain: a widespread ubiquitin-like module». Journal of Molecular Biology. 307 (1): 17–24. ISSN 0022-2836. PMID 11243799. doi:10.1006/jmbi.2000.4462
- ↑ Czech, Michael P.; Huang, Shaohui (4 de abril de 2007). «The GLUT4 Glucose Transporter». Cell Metabolism (em inglês). 5 (4): 237–252. ISSN 1550-4131. doi:10.1016/j.cmet.2007.03.006
- ↑ a b Ploug, T.; van Deurs, B.; Ai, H.; Cushman, S. W.; Ralston, E. (21 de setembro de 1998). «Analysis of GLUT4 distribution in whole skeletal muscle fibers: identification of distinct storage compartments that are recruited by insulin and muscle contractions». The Journal of Cell Biology. 142 (6): 1429–1446. ISSN 0021-9525. PMC 2141761 . PMID 9744875
- ↑ a b Lauritzen, Hans P. M. M. (abril de 2013). «Insulin- and contraction-induced glucose transporter 4 traffic in muscle: insights from a novel imaging approach». Exercise and Sport Sciences Reviews. 41 (2): 77–86. ISSN 1538-3008. PMC 3602324 . PMID 23072821. doi:10.1097/JES.0b013e318275574c
- ↑ a b Slot, J. W.; Geuze, H. J.; Gigengack, S.; James, D. E.; Lienhard, G. E. (1 de setembro de 1991). «Translocation of the glucose transporter GLUT4 in cardiac myocytes of the rat». Proceedings of the National Academy of Sciences of the United States of America. 88 (17): 7815–7819. ISSN 0027-8424. PMC 52394 . PMID 1881917
- ↑ www.physiology.org. doi:10.1152/ajpheart.1997.273.3.h1309 https://www.physiology.org/action/captchaChallenge?redirectUrl=https%3A%2F%2Fwww.physiology.org%2Fdoi%2Fabs%2F10.1152%2Fajpheart.1997.273.3.H1309&. Consultado em 11 de dezembro de 2018 Em falta ou vazio
|título=(ajuda) - ↑ Favaretto, Francesca; Milan, Gabriella; Collin, Gayle B.; Marshall, Jan D.; Stasi, Fabio; Maffei, Pietro; Vettor, Roberto; Naggert, Jürgen K. (2014). «GLUT4 defects in adipose tissue are early signs of metabolic alterations in Alms1GT/GT, a mouse model for obesity and insulin resistance». PloS One. 9 (10): e109540. ISSN 1932-6203. PMC 4192353 . PMID 25299671. doi:10.1371/journal.pone.0109540
- ↑ www.scielo.br (PDF) http://www.scielo.br/pdf/abem/v50n2/29301.pdf. Consultado em 11 de dezembro de 2018 Em falta ou vazio
|título=(ajuda) - ↑ a b c Nelson, David L.; COX, Michael M. Princípios de bioquímica de Lehninger. Porto Alegre: Artmed, 2011. 6. ed. Porto Alegre: Artmed, 2014. 408, 559, 626 p.
- ↑ a b c MACHADO, U. F. Transportadores de Glicose. São Paulo: Abril, 1998. Disponível em: <http://www.scielo.br/pdf/abem/v42n6/v42n6a03.pdf> Acesso em: 10 dez. 2018.
- ↑ a b «Insulin-stimulated translocation of GLUT4 to the plasma membrane in rat hippocampus is PI3-kinase dependent». Brain Research (em inglês). 1296: 35–45. 16 de outubro de 2009. ISSN 0006-8993. PMC 2997526 . PMID 19679110. doi:10.1016/j.brainres.2009.08.005
- ↑ a b Udayabanu, Malairaman; Patel, Sita Sharan (1 de março de 2014). «Urtica dioica extract attenuates depressive like behavior and associative memory dysfunction in dexamethasone induced diabetic mice». Metabolic Brain Disease (em inglês). 29 (1): 121–130. ISSN 1573-7365. doi:10.1007/s11011-014-9480-0
Leitura adicional editar
- Slot JW, Geuze HJ, Gigengack S, Lienhard GE, James DE (abril de 1991). «Immuno-localization of the insulin regulatable glucose transporter in brown adipose tissue of the rat». J. Cell Biol. 113 (1): 123–35. PMC 2288909 . PMID 2007617. doi:10.1083/jcb.113.1.123
- Govers R, Coster AC, James DE (julho de 2004). «Insulin increases cell surface GLUT4 levels by dose dependently discharging GLUT4 into a cell surface recycling pathway». Mol. Cell. Biol. 24 (14): 6456–66. PMC 434240 . PMID 15226445. doi:10.1128/MCB.24.14.6456-6466.2004
- Ng Y, Ramm G, Lopez JA, James DE (abril de 2008). «Rapid activation of Akt2 is sufficient to stimulate GLUT4 translocation in 3T3-L1 adipocytes». Cell Metab. 7 (4): 348–56. PMID 18396141. doi:10.1016/j.cmet.2008.02.008
- Foster LJ, Klip A (2000). «Mechanism and regulation of GLUT-4 vesicle fusion in muscle and fat cells». Am. J. Physiol., Cell Physiol. 279 (4): C877–90. PMID 11003568*Bryant NJ, Govers R, James DE (2002). «Regulated transport of the glucose transporter GLUT4». Nature Reviews Molecular Cell Biology. 3 (4): 267–77. PMID 11994746. doi:10.1038/nrm782
- Baumann MU, Deborde S, Illsley NP (2003). «Placental glucose transfer and fetal growth». Endocrine. 19 (1): 13–22. PMID 12583599. doi:10.1385/ENDO:19:1:13
- Olson AL, Knight JB (2004). «Regulation of GLUT4 expression in vivo and in vitro». Front. Biosci. 8 (1-3): s401–09. PMID 12700047. doi:10.2741/1072
- McCarthy AM, Elmendorf JS (2007). «GLUT4's itinerary in health & disease». Indian J. Med. Res. 125 (3): 373–88. PMID 17496362
- Buse JB, Yasuda K, Lay TP; et al. (1992). «Human GLUT4/muscle-fat glucose-transporter gene. Characterization and genetic variation». Diabetes. 41 (11): 1436–45. PMID 1397719. doi:10.2337/diabetes.41.11.1436
- O'Rahilly S, Krook A, Morgan R; et al. (1992). «Insulin receptor and insulin-responsive glucose transporter (GLUT 4) mutations and polymorphisms in a Welsh type 2 (non-insulin-dependent) diabetic population». Diabetologia. 35 (5): 486–89. PMID 1521731. doi:10.1007/BF02342449*Liu ML, Olson AL, Moye-Rowley WS; et al. (1992). «Expression and regulation of the human GLUT4/muscle-fat facilitative glucose transporter gene in transgenic mice». J. Biol. Chem. 267 (17): 11673–36. PMID 1601840
- Choi WH, O'Rahilly S, Buse JB; et al. (1992). «Molecular scanning of insulin-responsive glucose transporter (GLUT4) gene in NIDDM subjects». Diabetes. 40 (12): 1712–18. PMID 1756912. doi:10.2337/diabetes.40.12.1712
- Kusari J, Verma US, Buse JB; et al. (1991). «Analysis of the gene sequences of the insulin receptor and the insulin-sensitive glucose transporter (GLUT-4) in patients with common-type non-insulin-dependent diabetes mellitus». J. Clin. Invest. 88 (4): 1323–30. PMC 295602 . PMID 1918382. doi:10.1172/JCI115437
- Fukumoto H, Kayano T, Buse JB; et al. (1989). «Cloning and characterization of the major insulin-responsive glucose transporter expressed in human skeletal muscle and other insulin-responsive tissues». J. Biol. Chem. 264 (14): 7776–79. PMID 2656669
- Chiaramonte R, Martini R, Taramelli R, Comi P (1993). «Identification of the 5' end of the gene encoding a human insulin-responsive glucose transporter». Gene. 130 (2): 307–08. PMID 7916714. doi:10.1016/0378-1119(93)90438-9
- Verhey KJ, Birnbaum MJ (1994). «A Leu-Leu sequence is essential for COOH-terminal targeting signal of GLUT4 glucose transporter in fibroblasts». J. Biol. Chem. 269 (4): 2353–56. PMID 8300557
- Lee W, Samuel J, Zhang W; et al. (1997). «A myosin-derived peptide C109 binds to GLUT4-vesicles and inhibits the insulin-induced glucose transport stimulation and GLUT4 recruitment in rat adipocytes». Biochem. Biophys. Res. Commun. 240 (2): 409–14. PMID 9388492. doi:10.1006/bbrc.1997.7671
- Shi Y, Samuel SJ, Lee W; et al. (1999). «Cloning of an L-3-hydroxyacyl-CoA dehydrogenase that interacts with the GLUT4 C-terminus». Arch. Biochem. Biophys. 363 (2): 323–32. PMID 10068455. doi:10.1006/abbi.1998.1088
- Abel ED, Kaulbach HC, Tian R; et al. (2000). «Cardiac hypertrophy with preserved contractile function after selective deletion of GLUT4 from the heart». J. Clin. Invest. 104 (12): 1703–14. PMC 409881 . PMID 10606624. doi:10.1172/JCI7605
- Abel ED, Peroni O, Kim JK; et al. (2001). «Adipose-selective targeting of the GLUT4 gene impairs insulin action in muscle and liver». Nature. 409 (6821): 729–33. PMID 11217863. doi:10.1038/35055575
Ligações externas editar
- MeSH GLUT4+Protein
- USCD—Nature molecule pages: The signaling pathway", "GLUT4"; contains a high-resolution network map. Accessed 25 December 2009.