Glicina
| Glicina Alerta sobre risco à saúde[1] | |
|---|---|
|
|
|
|
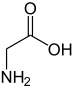
| Nome IUPAC | Glicina Ácido 2-aminoacético |
| Outros nomes | Ácido aminoetanóico |
| Identificadores | |
| Abreviação | Gly, G |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C2H5NO2 |
| Massa molar | 75.06 g mol-1 |
| Aparência | sólido branco |
| Densidade | 1,1607 g/cm3 |
| Ponto de fusão |
233 °C (decomposição) |
| Solubilidade em água | 25 g/100 mL |
| Solubilidade | solúvel em etanol, piridina insolúvel em éter |
| Acidez (pKa) | 2,32 |
| Riscos associados | |
| LD50 | 2600 mg/kg (ratos, oral) |
| Compostos relacionados | |
| Aminoácidos relacionados | Alanina (2-amino-propanoico) Beta-alanina (3-amino-propanoico) Alfa-fenilglicina Sarcosina (N-metil glicina) |
| Compostos relacionados | Ácido carbâmico (NH2COOH) Ácido glicólico (hidroxiacético) Etanolamina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A glicina (do grego glykos, "doce", nome devido ao seu sabor adocicado[2]) é um dos aminoácidos codificados pelo código genético, sendo, portanto, um dos componentes das proteínas dos seres vivos. É codificado pelos codões GGU, GGC, GGA e GGG[3].
Devido à sua simplicidade estrutural, este aminoácido tende a ser conservado evolucionariamente em proteínas como o citocromo c, a mioglobina e a hemoglobina. A glicina é o único aminoácido que não apresenta actividade óptica. A maioria das proteínas possui pequenas quantidades de glicina; o colagénio é uma excepção de nota, constituindo a glicina cerca de um terço da sua estrutura primária. A presença de glicina inibe a formação de alfa-hélices mas facilita a formação de folhas-beta na estrutura secundária de proteínas, por ser um aminoácido que apresenta um alto grau de flexibilidade quando integrado numa cadeia polipeptídica.[2]
Apesar de ser um aminoácido apolar, a sua cadeia lateral (um átomo de hidrogênio) é demasiado curta para participar em interações hidrofóbicas.[2] No entanto, a glicina pode, em determinadas enzimas como a piruvato:formato liase, ser convertida a radical glicilo através da retirada desse átomo de hidrogênio, sendo este radical importante para a catálise enzimática, embora instável e destruído na presença de O2.
Biossíntese editar
A glicina não é um aminoácido essencial na dieta humana, já que é sintetizado pelo organismo a partir do aminoácido serina numa reacção catalisada pela enzima serina hidroximetiltransferase:[2]
- HO2CCH(NH2)CH2OH + H2-folato → HO2CCH2NH2 + CH2-folato + H2O
Função fisiológica editar
Como intermediário biossintético editar
A glicina serve de precursor a diversas espécies químicas. O ácido aminolevulínico, precursor chave das porfirinas, é sintetizado in vivo a partir de glicina e succinil-coenzima A. A glicina fornece também o bloco C2N central a todas as purinas. Uma das vias de degradação do aminoácido treonina passa pela sua conversão a glicina, embora esta via metabólica seja relativamente pouco importante no metabolismo humano. É ainda precursor na via biossintética da fosfocreatina.
A degradação da glicina segue três vias principais:
- Pode ser degradada a piruvato, seguindo a reacção inversa da sua biossíntese (ou seja, conversão a serina e então conversão desta a piruvato).
- Especialmente em animais, a glicina pode ser oxidada a CO2, NH4+ e um grupo metileno pela enzima glicina sintase.
- Pode ser oxidada e desaminada a glioxilato pela enzima D-aminoácido oxidase, sendo o glioxilato posteriormente reduzido a oxalato.
Como neurotransmissor editar
A glicina é um neurotransmissor inibitório no sistema nervoso central, especialmente a nível da medula espinal, tronco cerebral e retina. Quando receptores de glicina são activados, o ânion cloreto entra no neurônio através de receptores ionotrópicos, causando um potencial pós-sináptico inibitório. A estricnina actua como antagonista nos receptores ionotrópicos de glicina. A glicina é, junto com o glutamato, um co-agonista de receptores NMDA; esta ação facilita a actividade excitatória dos receptores glutaminérgicos, em contraste com a atividade inibitória da glicina.
A dose letal de glicina administrada oralmente, em ratos, é de 7930 mg/kg[4], causando morte usualmente por hiperexcitabilidade.
Como elemento estrutural editar
Além de ser um aminoácido importante na formação de colagénio, é essencial na formação da camada de peptidoglicano na parede celular de bactérias Gram-positivas, ao formar um pentapéptido (pentaglicina) que ajuda na ligação entre resíduos de ácido N-acetilmurâmico. A pentaglicina está ausente nas bactérias Gram-negativas.
A glutationa, tripéptido essencial na manutenção do equilíbrio redox intracelular, tem na sua constituição glicina.
Na fotorrespiração editar
As mitocôndrias de plantas apresentam uma via alternativa de respiração, a fotorrespiração, em que a glicina é convertida a serina através da seguinte reacção, catalisada pela enzima glicina descarboxilase:
- 2 Gly + NAD+ → Ser + CO2 + NH3 + NADH + H+,
tornando-se esta a principal fonte de NADH mitocondrial para posterior produção de ATP. Esta reacção faz parte do grupo estrutural do RNA ciclo do glicolato.
Detectada num cometa editar
A glicina foi descoberta na atmosfera do cometa Júpiter 67P/Churyumov-Gerasimenko, pela sonda europeia Rosetta.[5]
Referências
- ↑ Merck Index, 11th Edition, 4386.
- ↑ a b c d Nelson 2004.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. «Nomenclature and Symbolism for Amino Acids and Peptides». Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado em 17 de maio de 2007
- ↑ «Safety (MSDS) data for glycine». The Physical and Theoretical Chemistry Laboratory Oxford University. 2005. Consultado em 1 de novembro de 2006. Arquivado do original em 20 de outubro de 2007
- ↑ «Detetado num cometa aminoácido essencial para a vida»
- DAWSON, R.M.C.; ELLIOTT, D.C.; ELLIOTT, W.H.; JONES, K.M., Data for Biochemical Research, 3rd ed., pp. 1–31 (1986)
Bibliografia editar
- Nelson, David L; Cox, Michael M (2004). Lehninger Principles of Biochemistry 4 ed. [S.l.]: W.H.Freeman. ISBN 978-0-7167-4339-2
- Wagner, A.F; Frey, M.; Neugebauer, F.A.; Schäfer, W.; Knappe, J (1992). The free radical in pyruvate formate-lyase is located on glycine-734. 89(3):996-1000. [S.l.]: Proc. Natl. Acad. Sci. U.S.A.
Ligações externas editar
- «Glicina» (em inglês)
- «Computational Chemistry Wiki» (em inglês)
- «Sistema de clivagem da glicina» (em inglês)