Níquel tetracarbonilo
| Níquel tetracarbonilo Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | Tetracarbonylnickel(0) |
| Outros nomes | Níquel carbonilo |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Número RTECS | QR6300000 |
| Propriedades | |
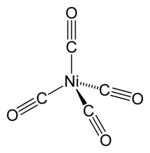
| Fórmula molecular | Ni(CO)4 |
| Massa molar | 170.7 g/mol |
| Aparência | líquido incolor |
| Densidade | 1.3 g/ml, líquido |
| Ponto de fusão |
-19 °C |
| Ponto de ebulição |
43 °C |
| Solubilidade em água | Imiscível |
| Estrutura | |
| Geometria de coordenação |
Tetrahedral |
| Forma molecular | Tetrahedral |
| Momento dipolar | zero |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-632 kJ/mol |
| Entalpia padrão de combustão ΔcH |
-1180 kJ/mol |
| Entropia molar padrão S |
320 J.K−1.mol−1 |
| Riscos associados | |
| Classificação UE | Flammable (F) Very toxic (T+) Carc. Cat. 3 Repr. Cat. 2 Dangerous for the environment (N) |
| NFPA 704 | |
| Frases R | R61, R11, R26, R40, R50/53 |
| Frases S | S53, S45, S60, S61 |
| Ponto de fulgor | -20 °C |
| Temperatura de auto-ignição |
60 °C |
| Compostos relacionados | |
| carbonilos metálicos relacionados | Cromo hexacarbonilo Dimanganês decacarbonilo Ferro pentacarbonilo Dicobalto octacarbonilo |
| Compostos relacionados | Pd(P(C6H5)34]] Ni(PF34 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Níquel tetracarbonilo (ou tetracarbonilníquel) Ni(CO)4 é um complexo organometálico incolor que representa um versátil reagente. É extremamente venenoso. Descrito pela primeira vez por Ludwig Mond em 1890 é considerado o primeiro complexo metalocarbonílico simples a ser reportado. Sua toxicidade e volatilidade a temperatura ambiente lhe fez ganhar o apelido de "morte líquida".
Estrutura e ligações editar
Tendo a fórmula molecular Ni(CO)4, o níquel carbonilo é composto de um átomo central de níquel cercado por quatro ligantes carbonilos (monóxido de carbono) em um arranjo tetraédrico. Os ligantes CO, nos quais o C e o O estão conectados por ligações triplas (frequentemente descritos como ligações duplas), são covalentemente ligados ao átomo de níquel via as terminações de carbono. A estrutura destes compostos confundiu por muitos anos, e a maioria das publicações antes de 1950 descrevia cadeias de CO ligadas ao metal.
Níquel carbonilo tem 18 elétrons de valência, como muitos outros metal-carbonilos tais como o ferro pentacarbonilo e molibdênio hexacarbonilo. Estes metal-carbonilos tem estruturas simétricas e são em termos de carga neutros, resultando em sua alta volatilidade. No Ni(CO)4, o átomo de níquel tem um número de oxidação formal de zero.
Preparação editar
Ni(CO)4 foi primeiramente sintetizado em 1890 por Ludwig Mond pela reação direta do metal níquel com CO. Este trabalho pioneiro alvancou a existência de muitos outros metal-carbonilo, incluindo os de V, Cr, Mn, Fe, e Co.
O metal níquel reage a temperatura ambiente com o monóxido de carbono gasoso para formar o tetracarbonilo. A 323 K, o monóxido de carbono é passado por níquel impuro. Sob moderado aquecimento, tal como o contato com uma superfície quente de vidro, Ni(CO)4 decompõe-se voltando a monóxido de carbono e níquel metálico. Estas duas reações formam a base para o processo Mond para a purificação de níquel.[1]
Ligações externas editar
- «International Chemical Safety Card 0064» (em inglês)
- «European Chemicals Bureau» (em inglês)
- «IARC Monograph "Nickel and Nickel compounds"» (em inglês)
- «NIST Standard Reference Database» (em inglês)
