Reação de Horner-Wadsworth-Emmons
A reação de Horner-Wadsworth-Emmons (reação HWE), também chamada de extensão de cadeia de Horner‐Wadsworth‐Emmons, é uma reação química usada na química orgânica de carbânions de fosfonato estabilizados com aldeídos (ou cetonas) para produzir predominantemente E-alcenos.[1]
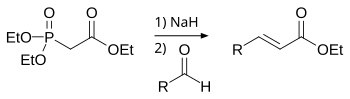

Em 1958, Leopold Horner publicou uma reação de Wittig modificada usando carbânions estabilizados com fosfonato.[2][3] William S. Wadsworth e William D. Emmons definiram ainda mais a reação.[4][5]
Em contraste com os iletos de fosfônio usados na reação de Wittig, os carbânions estabilizados com fosfonato são mais nucleofílicos, mas menos básicos. Da mesma forma, os carbânions estabilizados com fosfonato podem ser alquilados. Ao contrário dos iletos de fosfônio, o subproduto do sal de dialquilfosfato é facilmente removido por extração aquosa.
Mecanismo de reação editar
A reação de Horner-Wadsworth-Emmons começa com a desprotonação do fosfonato para dar o fosfonato carbânion 1. Adição nucleofílica do carbânion para o aldeído 2 (ou cetona) produzindo 3a ou 3b é a etapa de limitação de taxa.[12] If R2 = H, então intermediários 3a e 4a e intermediários 3b e 4b pode interconverter um com o outro.[13] A eliminação final de 4a e 4b produz (E)-alqueno 5 e (Z)-alqueno 6, com o subproduto sendo um dialquil-fosfato.
A razão dos isômeros de alceno 5 e 6 depende do resultado estereoquímico da adição inicial de carbânion e da capacidade dos intermediários de se equilibrarem.
O grupo de retirada de elétrons (electron-withdrawing group, abreviado na literatura em inglês EWG) alfa ao fosfonato é necessário para que a eliminação final ocorra. Na ausência de um grupo de retirada de elétrons, o produto final é o α-hidroxifosfonato 3a e 3b.[14] No entanto, estes α-hidroxifosfonatos podem ser transformados em alquenos por reação com diisopropilcarbodiimida.[15]
Estereosseletividade editar
A reação Horner–Wadsworth–Emmons favorece a formação de (E)-alquenos. Em geral, quanto mais equilíbrio entre os intermediários, maior a seletividade para a formação de (E)-alqueno.
Referências
- ↑ Wadsworth, W. Org. React. 1977, 25, 73. doi:10.1002/0471264180.or025.02
- ↑ Leopold Horner; Hoffmann, H. M. R.; Wippel, H. G. Ber. 1958, 91, 61–63.
- ↑ Horner, L.; Hoffmann, H. M. R.; Wippel, H. G.; Klahre, G. Ber. 1959, 92, 2499–2505.
- ↑ Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. (doi:10.1021/ja01468a042)
- ↑ Wadsworth, W. S., Jr.; Emmons, W. D. Organic Syntheses, Coll. Vol. 5, p.547 (1973); Vol. 45, p.44 (1965). (Article)
- ↑ Wadsworth, W. S., Jr. Org. React. 1977, 25, 73–253. (Review)
- ↑ Boutagy, J.; Thomas, R. Chem. Rev. 1974, 74, 87–99. (Review, doi:10.1021/cr60287a005)
- ↑ Kelly, S. E. Compr. Org. Synth. 1991, 1, 729–817. (Review)
- ↑ B. E. Maryanoff; Reitz, A. B. Chem. Rev. 1989, 89, 863–927. (Review, doi:10.1021/cr00094a007)
- ↑ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2012, 16, 2206–2230 (Review)
- ↑ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2015, 19, 744–775 (Review)
- ↑ Larsen, R. O.; Aksnes, G. Phosphorus Sulfur 1983, 15, 218–219.
- ↑ Lefèbvre, G.; Seyden-Penne, J. J. Chem Soc., Chem. Commun. 1970, 1308–09.
- ↑ Corey, E. J.; Kwiatkowski, G. T. J. Am. Chem. Soc. 1966, 88, 5654–56. (doi:10.1021/ja00975a057)
- ↑ Reichwein, J. F.; Pagenkopf, B. L. J. Am. Chem. Soc. 2003, 125, 1821–24. (doi:10.1021/ja027658s)