Reação de Ramberg-Bäcklund
A reação de Ramberg-Bäcklund é uma reação orgânica convertendo uma α-halossulfona em alceno na presença de uma base com extrusão de dióxido de enxofre.[1] A reação deve seu nome a dois químicos suecos, Ludwig Ramberg e Birger Bäcklund. O carbânion formado por desprotonação gera um dióxido de tiirano instável, que se decompõe liberando . Esta etapa de eliminação é considerada uma cicloeliminação.[1]
A transformação total é a conversão das ligações carbono-enxofre em uma ligação dupla carbono-carbono. O procedimento original envolvia halogenação de um sulfeto, seguida de oxidação a sulfona. Recentemente, o método preferido foi reverter a ordem das etapas. Após a oxidação, normalmente por meio de um peroxiácido, a halogenação é feita sob condições básicas utilizando-se para a etapa de transferência de halogênio.[2] Este método foi usado para a sìntese de 1,8-difenil-1,3,5,7-octatetraeno.
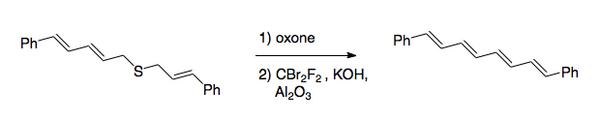
A reação de Ramberg-Bäcklund tem inúmeras aplicações. Devido à natureza da eliminação, pode ser aplicado a anéis pequenos [2],

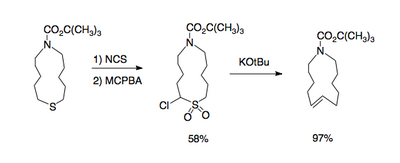
e grandes que possuem ligação dupla[3].
As α-halossulfonas são acessíveis através da oxidação dos α-halossulfetos correspondentes com perácidos, tais como ácido meta-cloroperbenzóico; a oxidação de sulfetos age seletivamente na presença de alcenos e álcoois. α-Halossulfetos podem, por sua vez, ser sintetizados por tratamento de sulfetos eletrófilos halógenos como ''N''-clorosuccinimida.[4]
O grupo sulfona contém um próton acídico em uma das α-posições que é abstraído por uma base forte (esquema 1). A carga negativa nesta posição (formalmente um carbânion) é transferida ao halogênio localizado na outra α-posição em um deslocamento nucleofílico, formando temporariamente uma sulfona cíclica de três membros. Este intermediário é instável e libera dióxido de enxofre para formar o alceno. Misturas de isômeros cis trans são quase sempre obtidos.[3]
Este tipo de reação dá acesso ao 1,2-dimetilenociclohexano[4]

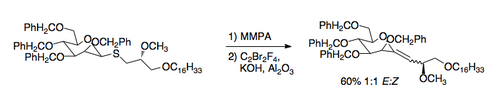
e a variação epóxido[5] dá acesso aos álcoois alílicos.

O rearranjo de Favorskii e a contração de sulfeto de Eschenmoser são reações conceitualmente relacionadas.
Uma aplicação recentemente desenvolvida da reação de Ramberg-Bäcklund é a síntese de C-glicosídeos. Os tioéteres requeridos são obtidos facilmente por meio de um tiol. A aplicação das condições de Ramberg-Bäcklund leva então a um vinil-éter exocíclico que pode reduzido ao C-nucleosídeo [5].
Referências
- ↑ E. Buncel, Julian Michael Dust, Carbanion Chemistry: Structures and Mechanisms, American Chemical Society, 2003 ISBN 0-841-23556-2 (em inglês)
- ↑ Cao, Xiao-Ping; T.-L. Chan, S. Fong, Y. Li, T.-O. Mau, and C.-D. Poon, (21 de Agosto de 2001). «Stereoselective synthesis of substituted all-trans 1,3,5,7-octatetraenes by a modified Ramberg–Bäcklund reaction». "Tetrahedron". "J. Chem. Soc., Chem. Commun". 58 (7): 1301–1307. doi:10.1016/S0040-4020(01)01224-8
- ↑ Paquette, L. (1977). «Organic Reactions - The Ramberg-Bäcklund Rearrangement». 25 páginas. doi:10.1002/0471264180.or025.01
- ↑ Cyclohexane, 1,2-bis(methylene)- Eric Block and Mohammad Aslam Organic Syntheses, Coll. Vol. 8, p. 212 (1993); Vol. 65, p. 90 (1987) Artigo (em inglês)
- ↑ Paul, Evans; Paul Johnson, Richard J. K. Taylor (Abril de 2006). «The Epoxy-Ramberg-Bäcklund Reaction (ERBR): A Sulfone-Based Method for the Synthesis of Allylic Alcohols». European Journal of Organic Chemistry (7): 1740-1754. doi:10.1002/ejoc.200500956. 7
Bibliografias editar
- ↑ L. Ramberg, B. Bäcklund Ark. Chim., Mineral Geol., 1940, 27 Vol 13A, 1- 50.
- ↑ L. A. Paquette, J. C. Philips, and R. E. Wingard, Jr. "J. Am. Chem. Soc.," 93, 4516 (1971).
- ↑ I. MaGee and E. J. Beck, "Can. J. Chem.," 78, 1060 (2000).
- ↑ Böhme, H.; Gran, H. J. Ann. Chem. 1952, 577, 68.
- ↑ F. K. Griffin, D. E. Paterson, P. V. Murphy, and R. J. K. Taylor, "Eur. J. Org. Chem.," 1305, (2002).

