Tetracloreto de selênio
Tetracloreto de selênio é o composto inorgânico com a fórmula SeCl4. Este composto existe como sólido branco amarelado volátil. É um de dois cloretos de selênio normalmente disponíveis, sendo o outro exemplo o monocloreto de selénio , Se2Cl2. SeCl4 é utilizado na síntese de outros compostos de selénio.
Síntese e estrutura editar
SeCl4 é preparado por tratamento de selênio com cloro : [3] Quando a mistura reacional é aquecida, o produto sublimaa partir do balão de reação. A volatilidade do SeCl4 pode ser explorada para a purificação de selênio.
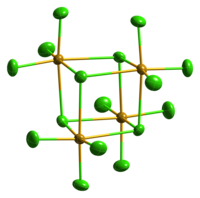
SeCl4 sólido é iônico, formado por cátions SeCl3+ e ânions Cl-. Os cátions são piramidais consistente com as previsões da teoria VSEPR. SeCl4 gasoso contém SeCl2 e cloro, que se recombinam após a condensação.
Reações editar
O tetracloreto de selênio pode ser reduzido in situ para o dicloreto usando trifenilestibina:
SeCl4 reage com água para dar os ácidos clorídrico e selenoso: [4]
Após o tratamento com dióxido de selênio, dá oxicloreto de selênio: [4]
Referências
- ↑ Lide, David R. (1998). Handbook of Chemistry and Physics 87 ed. Boca Raton, FL: CRC Press. 487 páginas. ISBN 0-8493-0594-2. Consultado em 2 de julho de 2008
- ↑ «323527 Selenium tetrachloride». Sigma-Aldrich. Consultado em 2 de julho de 2008
Nota editar
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Selenium tetrachloride», especificamente desta versão.