Usuário(a):Lijealso/Síndrome de dor regional complexa
| Síndrome de dor regional complexa | |
|---|---|
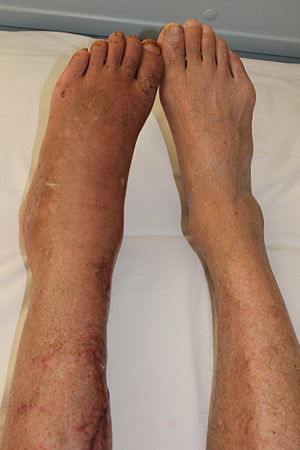
| Perna de um paciente (esquerda) com síndrome de dor regional complexa, posterior a fractura da tíbia. | |
| Classificação e recursos externos | |
A síndrome de dor regional complexa ( CRPS ), também conhecida como distrofia simpático-reflexa ( RSD ), síndrome da dor regional complexa (SDRC) e síndrome dolorosa complexa regional (SDCR), descreve uma série de condições dolorosas que são caracterizadas por uma dor regional contínua (espontânea e/ou evocada) que é aparentemente desproporcional no tempo ou grau em relação ao curso actual de qualquer trauma conhecido ou outra lesão. [1] Geralmente começa num membro, manifesta-se como dor extrema, inchaço, amplitude limitada de movimento e alterações na pele e nos ossos. Pode afetar inicialmente um membro e depois se espalhar por todo o corpo; 35% das pessoas afetadas relatam sintomas em todo o corpo. [2] Existem dois subtipos. É possível ter os dois tipos. [3]
Classificação editar
O sistema de classificação atualmente em uso pela Associação Internacional para o Estudo da Dor (IASP) divide a CRPS em dois tipos. É reconhecido que as pessoas podem apresentar os dois tipos de CRPS.
| Associação Internacional para o Estudo da Classificação da Dor | ||
|---|---|---|
| Tipo | Descobertas clínicas | Sinónimos |
| Tipo I | CRPS sem evidência de lesão nervosa no membro afetado. Secundário em relação a lesão/trauma. Representa cerca de 90% de casos do CRPS. | RSD, atrofia de Sudeck |
| Tipo II | CRPS com evidência de dano nervoso no membro afetado. | Causalgia |
Sinais e sintomas editar
Foi descoberto que as características clínicas da CRPS são resultado de inflamação derivada da libertação de certos sinais químicos pró-inflamatórios pelos nervos, receptores nervosos sensibilizados que enviam sinais de dor para o cérebro, disfunção da capacidade dos vasos sanguíneos locais de se contrair e dilatar de forma adequada e neuroplasticidade mal adaptativa. [4]
Os sinais e sintomas da CRPS manifestam-se normalmente perto do local da lesão. Os sintomas mais comuns são dor extrema, incluindo queimação, pontadas, ranger e latejar. A dor é desproporcional à gravidade da lesão inicial. [5] Mover ou tocar o membro costuma ser intolerável. Com o diagnóstico de CRPS tipo I ou II, os pacientes podem desenvolver dor em queimação e alodinia (dor a estímulos não dolorosos). Ambas as síndromes também são caracterizadas por disfunção autonómica, que se manifesta por mudanças localizadas de temperatura, cianose e/ou edema.
O paciente também pode apresentar inchaço localizado; extrema sensibilidade a estímulos não dolorosos, como vento, água, ruído e vibrações; extrema sensibilidade ao toque (do próprio, outras pessoas e até mesmo de suas roupas ou roupas de cama e cobertores); sudorese anormalmente aumentada (ou sudorese ausente); mudanças na temperatura da pele (alternando entre suado e frio); alterações na coloração da pele (de branco e mosqueado a vermelho vivo ou violeta-avermelhado); alterações na textura da pele (cerosa, brilhante, fina, pele firme); amolecimento e estreitamento dos ossos ; sensibilidade ou rigidez articular; alterações nas unhas e no cabelo (crescimento retardado ou aumentado, unhas/cabelos que quebram facilmente); espasmos musculares; perda muscular (atrofia); tremores; distonia; alodinia; hiperalgesia; e habilidade diminuída/restrita e movimento doloroso da parte do corpo afetada. [5] Ataques de queda (quedas), quase desmaio e desmaios são relatados raramente, assim como problemas visuais.
Os sintomas da CRPS variam em gravidade e duração. Uma versão do índice de dor de McGill, uma escala para avaliar a dor, classifica a CRPS no topo, acima do parto, amputação e cancro. [6] Como a CRPS é um problema sistémico, qualquer órgão pode potencialmente ser afetado. Os sintomas podem mudar com o tempo e podem variar de pessoa para pessoa. Os sintomas podem até mudar várias vezes num único dia.
Anteriormente, a CRPS era considerado como tendo três estágios, no entanto, estudos mais recentes sugerem que as pessoas afetadas pela CRPS não progridem através dos estágios sequenciais e o sistema de estágios não é mais amplamente utilizado. [7] Em vez disso, evidências crescentes apontam para subtipos distintos da CRPS.
Causas editar
A síndrome de dor regional complexa é incomum e a sua causa não é claramente compreendida. A CRPS geralmente desenvolve-se após uma lesão, cirurgia, ataque cardíaco ou derrame. [5] [8] Os investigadores estimam que 2–5% daqueles com lesões de nervos periféricos, [9] e 13-70% daqueles com hemiplegia (paralisia de um lado do corpo) [10] desenvolverão SDCR. Além disso, alguns estudos indicaram que o tabagismo estava muito presente nos pacientes e está estatisticamente associado à DSR. Isso pode estar envolvido na sua patologia, através do aumento da atividade simpática, vasoconstrição ou algum outro mecanismo desconhecido relacionado a neurotransmissores. Esta hipótese foi baseada numa análise retrospetiva de 53 pacientes com DSR, que mostrou que 68% dos pacientes e apenas 37% dos controles eram fumadores. Os resultados são preliminares e limitados por sua natureza retrospectiva. [11] 7% das pessoas que têm SDCR num membro desenvolvem posteriormente no outro membro. [12]
Fisiopatologia editar
A inflamação e a alteração da percepção da dor no sistema nervoso central podem desempenhar papéis importantes. Acredita-se que a dor persistente e a percepção de estímulos não dolorosos como dor, sejam causadas por moléculas inflamatórias (IL-1, IL2, TNF-alfa) e neuropeptídeos (substância P) libertados dos nervos periféricos. Esta libertação pode ser causada por interferência inadequada entre as fibras sensoriais e motoras no local afetado. [13] A CRPS não é uma doença psicológica, mas a dor pode causar problemas psicológicos, como ansiedade e depressão . Frequentemente, ocorre comprometimento da função social e ocupacional. [14]
A síndrome de dor regional complexa é um distúrbio multifatorial com características clínicas de inflamação neurogénica (inchaço no sistema nervoso central), sensibilização nociceptiva (que causa extrema sensibilidade ou alodinia ), disfunção vasomotora (problemas de fluxo sanguíneo que causa inchaço e descoloração) e neuroplasticidade mal adaptativa (o cérebro sofre alterações e se adapta com sinais constantes de dor); A CRPS é o resultado de uma "resposta aberrante [inadequada] à lesão do tecido". [4] A "matriz neuronal subjacente" da CRPS parece envolver o processamento cognitivo e motor, bem como o nociceptivo; a estimulação por picada de agulha de um membro afetado pela CRPS é dolorosa (hiperalgesia mecânica) e mostra uma "ativação significativamente aumentada" não apenas das áreas do córtex S1 (contralateral), áreas S2 (bilateral) e ínsula (bilateral), mas também os córtices associativo-somatossensorial (contralateral), córtices frontais e partes do córtex cingulado anterior. [15] Em contraste com os pensamentos anteriores refletidos no nome RSD, parece que há uma redução do fluxo do sistema nervoso simpático, pelo menos na região afetada (embora possa haver acoplamento simpático-aferente). O wind-up (o aumento da sensação de dor com o tempo) [16] e a sensibilização do sistema nervoso central (SNC) são processos neurológicos essenciais que parecem estar envolvidos na indução e manutenção da CRPS. [17]
Evidências convincentes mostram que o receptor N-metil-D-aspartato ( NMDA) tem envolvimento significativo no processo de sensibilização do SNC. [18] Também existe a hipótese de que níveis elevados de glutamato no SNC promovem o wind-up e a sensibilização do SNC. [17] Além disso, existem evidências experimentais que demonstram a presença de receptores NMDA nos nervos periféricos. [19] Como as funções imunológicas podem modular a fisiologia do SNC, uma variedade de processos imunológicos também foram tomados como hipóteses na contribuição do desenvolvimento inicial e manutenção da sensibilização periférica e central. [20] [21] Além disso, a liberação de citocinas relacionadas ao trauma, inflamação neurogénica exagerada, acoplamento aferente simpático, patologia dos adrenorreceptores, ativação das células gliais, reorganização cortical [22] e dano oxidativo (por exemplo, por radicais livres) são todos fatores que têm sido implicados na fisiopatologia da CRPS . [23] Além disso, auto-anticorpos estão presentes num grande número de pacientes com SDRC e a IgG tem sido reconhecida como uma das causas de hipersensibilidade que estimula os nociceptores A e C, atribuindo à inflamação. [24]
Os mecanismos que levam à redução da densidade mineral óssea (até osteoporose evidente) ainda são desconhecidos. As possíveis explicações incluem um desequilíbrio das atividades do sistema nervoso autónomo simpático e parassimpático [25] [26] [27] e hiperparatireoidismo secundário leve. [28] No entanto, o gatilho do hiperparatireoidismo secundário ainda não foi identificado.
Em resumo, a fisiopatologia da síndrome dolorosa regional complexa ainda não foi definida; A SDCR, com suas manifestações variáveis, pode ser resultado de múltiplos processos fisiopatológicos.
Diagnóstico editar
O diagnóstico é baseado principalmente em descobertas clínicos. Os critérios diagnósticos originais para a CRPS adotados pela Associação Internacional para o Estudo da Dor (IASP) em 1994 foram agora substituídos na prática clínica e na pesquisa pelos "Critérios de Budapeste", que foram criados em 2003 e foram considerados mais sensíveis e específicos . [29] Desde então, eles foram adotados pela IASP. Os critérios exigem que haja dor, bem como história e evidências clínicas de alterações sensoriais, vasomotoras, sudomotoras e motoras ou tróficas. Também se afirma que é um diagnóstico de exclusão . [30]
Para fazer um diagnóstico clínico, todos os quatro dos seguintes critérios devem ocorer:
- Dor contínua, que é desproporcional a qualquer evento incitante
- Deve ser relatado pelo menos um sintoma em três das quatro categorias a seguir. .
- Sensorial: relatos de hiperestesia
- Vasomotor: Relatórios de assimetria de temperatura e/ou alterações da cor da pele e/ou assimetria da cor da pele
- Sudomotor/Edema: Relatos de edema e/ou alterações na sudorese e/ou assimetria na sudorese
- Motor/Trófico: relatos de diminuição da amplitude de movimento e/ou disfunção motora (fraqueza, tremor, distonia ) e/ou alterações tróficas (cabelo, unha, pele)
- Deve exibir pelo menos um sinal no momento da avaliação em duas ou mais das seguintes categorias
- Sensorial: Evidência de hiperalgesia (picada de agulha) e/ou alodinia (ao toque leve e/ou sensação de temperatura e/ou pressão somática profunda e / ou movimento articular)
- Vasomotor: Evidência de assimetria de temperatura (> 1 ° C) e/ou mudanças na cor da pele e/ou assimetria
- Sudomotor/Edema: Evidência de edema e/ou alterações na sudorese e/ou assimetria na sudorese
- Motor/trófico: evidência de diminuição da amplitude de movimento e/ou disfunção motora (fraqueza, tremor, distonia) e/ou alterações tróficas (cabelo, unha, pele)
- Não existe outro diagnóstico que explique melhor os sinais e sintomas
Auxiliares de diagnóstico editar
Nenhum teste específico está disponível para a CRPS, que é diagnosticada principalmente através da observação dos sintomas. No entanto, a termografia, o teste de suor, os raios X, o eletrodiagnóstico e os bloqueios simpáticos podem ser usados para construir uma imagem mais clara do distúrbio. O diagnóstico é complicado pelo fato de que alguns pacientes melhoram sem tratamento. O atraso no diagnóstico e/ou tratamento desta síndrome pode resultar em graves problemas físicos e psicológicos. O reconhecimento precoce e o tratamento imediato fornecem a maior oportunidade de recuperação.
Termografia editar
Atualmente, a evidência empírica estabelecida sugere contra a eficácia da termografia como uma ferramenta confiável para o diagnóstico da CRPS. Embora a CRPS possa, em alguns casos, levar a uma alteração mensurável do fluxo sanguíneo em toda a região afetada, muitos outros fatores também podem contribuir para uma leitura termográfica alterada, incluindo hábitos de fumar do paciente, uso de certas loções para a pele, atividade física recente e história anterior de trauma na região. Além disso, nem todos os pacientes com diagnóstico de SDRC demonstram tal "instabilidade vasomotora" - particularmente aqueles nos estágios mais avançados da doença. [31] Portanto, a termografia por si só não pode ser usada como evidência conclusiva a favor - ou contra - um diagnóstico de CRPS e deve ser interpretada à luz do histórico médico mais amplo do paciente e de estudos diagnósticos anteriores. [32]
A fim de minimizar a confusa influência de fatores externos, os pacientes submetidos a testes termográficos infravermelhos devem obedecer a restrições especiais em relação ao uso de certos vasoconstritores (ou seja, nicotina e cafeína), loções para a pele, fisioterapia e outros procedimentos de diagnóstico nos dias anteriores ao teste. Também pode ser necessário que os pacientes descontinuem certos medicamentos para a dor e bloqueadores simpáticos. Depois do paciente chegar a um laboratório termográfico, é permitido que possa atingir o equilíbrio térmico num quarto a 16-20 ° C, em estado estacionário e sem correntes de ar, vestindo uma bata hospitalar de algodão folgada por aproximadamente 20 minutos. Um técnico então obtém imagens de infravermelhos dos membros afetados e não afetados do paciente, bem como imagens de referência de outras partes do corpo do paciente, incluindo rosto, parte superior das costas e parte inferior das costas. Depois de capturar um conjunto de imagens iniciais, alguns laboratórios exigem ainda que o paciente seja submetido a um teste de estresse funcional autônomo em água fria para avaliar a função do reflexo vasoconstritor periférico do sistema nervoso autónomo . Isso é realizado colocando o membro não afetado de um paciente num banho de água fria (aproximadamente 20° C) por cinco minutos durante a recolha de imagens. Num sistema nervoso autônomo normal, intacto e funcionando, a extremidade afetada de um paciente ficará mais fria. Por outro lado, o aquecimento de uma extremidade afetada pode indicar uma interrupção da função vasoconstritora termorregulatória normal do corpo, o que às vezes pode indicar SDCR subjacente. [33]
Radiografia editar
A cintilografia, as radiografias simples e a ressonância magnética podem ser úteis no diagnóstico. A osteoporose irregular (osteoporose pós-traumática ), que pode ser devido ao desuso da extremidade afetada, pode ser detectada por meio de imagens de raios-X duas semanas após o início da SDRC. Uma cintilografia óssea do membro afetado pode detectar essas alterações ainda mais cedo e quase pode confirmar a doença. A densitometria óssea também pode ser usada para detectar mudanças na densidade mineral óssea. Também pode ser usado para monitorar os resultados do tratamento, uma vez que os parâmetros de densitometria óssea melhoram com o tratamento.
Ultrassom editar
A osteodensitometria baseada em ultrassom (ultrassonometria) pode ser uma potencial técnica futura sem radiação, usada para identificar a redução da densidade mineral óssea na CRPS. [28] Além disso, esse método é promissor na quantificação da arquitetura óssea na periferia dos membros afetados. Este método ainda está em desenvolvimento experimental.
Teste de eletrodiagnóstico editar
Eletromiografia (EMG) e estudos de condução nervosa (NCS) são testes auxiliares importantes na CRPS, porque estão entre os métodos mais confiáveis de deteção de lesão nervosa. Eles podem ser usados como um dos métodos principais para distinguir entre os tipos I e II de CRPS, que diferem com base na evidência de dano real do nervo. EMG e NCS também estão entre os melhores testes para descartar ou excluir diagnósticos alternativos. A CRPS é um "diagnóstico de exclusão", que exige que nenhum outro diagnóstico possa explicar os sintomas do paciente. É muito importante enfatizar isso porque, de outra forma, os pacientes podem receber um diagnóstico errado de CRPS quando, na verdade, eles têm uma condição tratável que explica melhor seus sintomas. Um exemplo é a síndrome do túnel do cárpico grave (CTS), que muitas vezes pode apresentar-se de forma muito semelhante à SDCR. Ao contrário da CRPS, a CTS pode frequentemente ser corrigido com cirurgia para aliviar a dor e evitar danos permanentes e malformações nos nervos. [34]
Quer a EMG e a NCS envolvem alguma medida de desconforto. A EMG envolve o uso de uma pequena agulha inserida em músculos específicos para testar a função muscular e nervosa associada. Tanto a EMG como a NCS envolvem choques muito suaves que em pacientes normais são comparáveis a um estalo de elástico na pele. Embora esses testes possam ser muito úteis na CRPS, o consentimento informado completo deve ser obtido antes do procedimento, particularmente em pacientes com alodinia grave. Apesar da utilidade do teste, esses pacientes podem desejar recusar o procedimento para evitar desconforto.
Classificação editar
- O tipo I, anteriormente conhecido como distrofia simpática reflexa (RSD), atrofia de Sudeck ou algoneurodistrofia, não exibe lesões nervosas demonstráveis. Como a grande maioria dos pacientes com diagnóstico de SDRC têm este tipo, ele é mais comumente referido na literatura médica como tipo I. [ <span title="This claim needs references to reliable sources. (December 2020)">citação necessária</span> ]
- O tipo II, anteriormente conhecido como causalgia, apresenta evidências de danos nervosos evidentes. Apesar das evidências de lesão nervosa, a causa ou os mecanismos da SDCR tipo II são tão desconhecidos quanto os mecanismos do tipo I. [ <span title="This claim needs references to reliable sources. (December 2020)">citação necessária</span> ]
Os pacientes são frequentemente classificados em dois grupos com base na temperatura: CRPS "quente" num grupo e CRPS "fria" no outro grupo. A maioria dos pacientes (cerca de 70%) tem o tipo "quente", que se diz ser uma forma aguda de SDRC. [35] A CRPS fria é considerado um indicativo de uma CRPS mais crónica e está associada a resultados piores no Questionário de Dor de McGill, aumento do envolvimento do sistema nervoso central e maior prevalência de distonia . O prognóstico não é favorável para pacientes com CRPS frio; estudos longitudinais sugerem que esses pacientes têm "desenlaces clínicos piores relacionados com a dor e mostram sinais persistentes de sensibilização central correlacionada com a progressão da doença". [36]
Prevenção editar
A vitamina C pode ser útil na prevenção da síndrome após fratura do antebraço ou pé e tornozelo. [37]
Tratamento editar
O tratamento da CRPS envolve frequentemente várias modalidades. [38]
Terapia editar
A fisioterapia e a terapia ocupacional apresentam evidências de baixa qualidade para apoiar seu uso. [39] As intervenções de fisioterapia podem incluir estimulação elétrica nervosa transcutânea, sustentação progressiva de peso, dessensibilização tátil graduada, massagem e terapia de banho de contraste . Numa coorte retrospectiva (não cega, não randomizada e com intenção de tratar) de cinquenta pacientes com diagnóstico de CRPS, a classificação subjetiva de dor e percepção corporal dos pacientes diminuíram após o envolvimento com um programa de reabilitação multidisciplinar de duas semanas. Os autores pedem ensaios clínicos randomizados para investigar o verdadeiro valor dos programas multidisciplinares para pacientes com CRPS. [40]
Terapia de caixa de espelho editar
A terapia de caixa de espelho usa uma caixa de espelho, ou um espelho autónomo, para criar um reflexo do membro normal de forma que o paciente pense que está a olhar para o membro afetado. O movimento desse membro normal refletido é então executado de forma a que o paciente pareça estar a realizar um movimento com o membro afetado. A terapia da caixa do espelho parece ser benéfica, pelo menos no início da CRPS. [39] No entanto, os efeitos benéficos da terapia do espelho a longo prazo ainda não foram comprovados. [41]
Imagens motoras graduadas editar
Imagens motoras graduadas parecem ser úteis para pessoas com CRPS-1. [42] A imagiologia motora graduada é um processo sequencial que consiste em (a) reconstrução da lateralidade, (b) imagética motora e (c) terapia de espelho . [38] [43]
Medicação editar
Evidências provisórias apoiam o uso de bifosfonatos, calcitonina e cetamina. [39] Os bloqueios nervosos com guanetidina parecem ser prejudiciais. A evidência para o bloqueio de nervos simpáticos geralmente é insuficiente para apoiar seu uso. [44] As injeções botulínicas intramusculares podem beneficiar pessoas com sintomas localizados numa extremidade. [45]
Cetamina editar
A cetamina, um anestésico dissociativo, parece promissor como tratamento para a CRPS. [46] Pode ser usado em doses baixas se outros tratamentos não funcionaram. [47] [48] Nenhum benefício na função ou na depressão, entretanto, foi observado.
Tratamento com bisfosfonatos editar
Até 2013, evidências de baixa qualidade apoiam o uso de bifosfonatos . [39] Uma revisão de 2009 concluiu que "dados revistos, muito limitados, mostraram que os bifosfonatos têm o potencial de reduzir a dor associada à perda óssea em pacientes com CRPS I, no entanto, atualmente as evidências não são suficientes para recomendar seu uso na prática". [49]
Opioides editar
Opioides como oxicodona, morfina, hidrocodona e fentanil têm um lugar controverso no tratamento da SDRC. Estes medicamentos devem ser prescritos e monitorizados sob estrita supervisão de um médico, pois podem levar à dependência física e podem levar ao vício. [50] Até agora, nenhum estudo de longo prazo do uso de opióides orais no tratamento da dor neuropática, incluindo a CRPS, foi realizado. O consenso entre os especialistas é que os opioides não devem ser uma terapia de primeira linha e só devem ser considerados após todas as outras modalidades (medicamentos não opioides, fisioterapia e procedimentos) terem sido testadas. [51]
Cirurgia editar
Estimuladores da medula espinhal editar
O estimulador da medula espinhal parece ser uma terapia eficaz no tratamento de pacientes com CRPS tipo I (evidência de nível A) e tipo II (evidência de nível D). [52] Embora melhorem a dor e a qualidade de vida, as evidências não são claras sobre os efeitos na saúde mental e no funcionamento geral. [53]
A estimulação do gânglio da raiz dorsal é um tipo de neuroestimulação eficaz no tratamento da dor neuropática focal. A FDA aprovou seu uso em fevereiro de 2016. O estudo ACCURATE demonstrou superioridade da estimulação do gânglio da raiz dorsal sobre a estimulação espinhal (coluna dorsal) no tratamento da CRPS e da causalgia. [54]
Simpatectomia editar
Simpatectomia cirúrgica, química ou por radiofrequência - interrupção da parte afetada do sistema nervoso simpático - pode ser usada como último recurso em pacientes com perda iminente de tecido, edema, infecção recorrente ou necrose isquémica. [55] No entanto, poucas evidências dão suporte a essas intervenções permanentes para alterar os sintomas de dor dos pacientes afetados e, além dos riscos normais da cirurgia, como sangramento e infecção, a simpatectomia tem vários riscos específicos, como alterações adversas no funcionamento dos nervos.
Amputação editar
Nenhum estudo randomizado na literatura médica estudou a resposta à amputação de pacientes que falharam nas terapias mencionadas acima e que continuam sofrendo. No entanto, em média, cerca de metade dos pacientes terá resolução de sua dor, enquanto a metade desenvolverá dor em membro fantasma e/ou dor no local da amputação. Como em qualquer outra síndrome de dor crónica, o cérebro provavelmente torna-se cronicamente estimulado com dor, e a amputação tardia pode não funcionar tão bem quanto seria de se esperar. Numa pesquisa com 15 pacientes com CRPS tipo 1, 11 responderam que suas vidas melhoraram após a amputação. [56] Uma vez que este é o tratamento definitivo para uma extremidade dolorida, deve ser deixado como último recurso.
Prognóstico editar
Um bom progresso pode ser alcançado no tratamento da CRPS se o tratamento for iniciado precocemente, idealmente dentro de três meses após os primeiros sintomas. Se o tratamento for adiado, no entanto, o distúrbio pode espalhar-se rapidamente para todo o membro e as alterações nos ossos, nervos e músculos podem se tornar irreversíveis. O prognóstico nem sempre é bom. O Hospital Johns Hopkins relata que 77% dos pacientes apresentam propagações a partir do local original ou erupções em outras partes do corpo. O membro, ou membros, pode sofrer atrofia muscular, perda de uso e parâmetros funcionalmente inúteis que requerem amputação. A RSD/ CRPS não se extingue por si, mas se tratada precocemente, é provável que seja controlável. Uma vez que alguém é diagnosticado com CRPS, se entrar em remissão, a probabilidade de ressurgir após entrar em remissão é significativa. É importante tomar precauções e procurar tratamento imediato em caso de lesão. [57]
Epidemiologia editar
A SDRC pode ocorrer em qualquer idade, sendo a média de idade no momento do diagnóstico, de 42 anos. [9] Afeta homens e mulheres; no entanto, CRPS é três vezes mais frequente em mulheres do que em homens.
CRPS afeta adultos e crianças, e o número de casos de CRPS relatados entre adolescentes e adultos jovens tem aumentado, [58] com um estudo observacional recente que encontrou uma incidência de 1,16/100 000, entre crianças na Escócia. [59]
História editar
A condição atualmente conhecida como CRPS foi originalmente descrita durante a Guerra Civil Americana por Silas Weir Mitchell, que por vezes também é creditado com a invenção do nome "causalgia". [60] No entanto, este termo foi cunhado pelo amigo de Mitchell, Robley Dunglison, a partir das palavras gregas para calor e dor. [61] Ao contrário do que é comumente aceite, verifica-se que essas causalgias foram certamente maiores pela importância dos sintomas vasomotores e sudomotores, mas decorrentes de pequenas lesões neurológicas. Na década de 1940, o termo distrofia simpática reflexa passou a ser usado para descrever essa condição, baseado na teoria de que a hiperatividade simpática estava envolvida na fisiopatologia. [62] Em 1959, Noordenbos observou em pacientes com causalgia que "o dano do nervo é sempre parcial". O uso indevido dos termos, bem como dúvidas sobre a fisiopatologia subjacente, levou a pedidos de melhor nomenclatura. Em 1993, um workshop especial de consenso realizado em Orlando, Flórida, forneceu o termo genérico "síndrome de dor regional complexa", com causalgia e RSD como subtipos. [63]
Pesquisa editar
O Instituto Nacional de Doenças Neurológicas e Derrame (NINDS), parte do National Institutes of Health, apoia e conduz pesquisas sobre o cérebro e o sistema nervoso central, incluindo pesquisas relevantes para a RSDS, por meio de doações às principais instituições médicas em todo o país. Cientistas apoiados pelo NINDS estão a trabalhar para desenvolver tratamentos eficazes para condições neurológicas e, em última instância, para encontrar maneiras de evitá-las. Os investigadores estão a estudar novas abordagens para tratar a CRPS e intervir de forma mais agressiva após lesão traumática, para diminuir as chances do paciente desenvolver a doença. Além disso, cientistas apoiados pelo NINDS estão a estudar como os sinais do sistema nervoso simpático causam dor em pacientes com CRPS. Usando uma técnica chamada microneurografia, esses pesquisadores são capazes de registar e medir a atividade neural em fibras nervosas individuais de pacientes afetados. Ao testar várias hipóteses, esses pesquisadores esperam descobrir o mecanismo único que causa a dor espontânea na CRPS, e essa descoberta pode levar a novas maneiras de bloquear a dor. Outros estudos para superar as síndromes de dor crónica são discutidos no panfleto "Dor crônica: esperança através da pesquisa", publicado pelo NINDS.
A pesquisa sobre o tratamento da condição com feedback visual em espelho está a ser realizada no Royal National Hospital for Rheumatic Disease em Bath. Os pacientes são ensinados a dessensibilizar da maneira mais eficaz e, em seguida, passam a usar espelhos para reescrever os sinais defeituosos no cérebro que parecem responsáveis por essa condição. [64] No entanto, embora a CRPS possa entrar em remissão, a chance de sua recorrência é significativa.
Os Países Baixos têm atualmente o programa mais abrangente de pesquisa sobre a CRPS, como parte de uma iniciativa multimilionária chamada TREND. [65] Equipas de pesquisa alemãs e australianas também procuram uma melhor compreensão e tratamentos para a CRPS.
Em outras espécies animais editar
A CRPS também foi descrita em animais, como o gado. [66]
Casos notáveis editar
- Nia Frazier, estrela de Dance Moms [67]
- Paula Abdul, cantora, ator, personalidade da TV [68]
- Jill Kinmont Boothe, campeã americana de esqui slalom [69]
- Gemma Collis, esgrimista paralímpico britânico
- Shin Dong-wook, ator e modelo sul-coreano [70]
- Howard Hughes, magnata dos negócios americano, aviador, inventor, cineasta e filantropo [71]
- Rachel Morris, ciclista paralímpica britânica. [72]
- Cynthia Toussaint, autora e personalidade da mídia [73]
- Danielle Brown, arqueira paralímpica britânica [74]
- Radene Marie Cook, ex-locutora de rádio de Los Angeles, artista e defensora [75]
- Marieke Vervoort, atleta paraolímpica belga [76]
- Bruno Soriano, jogador de futebol espanhol [77]
Referências editar
Referências
- ↑ Wilson, Peter R.; Stanton-Hicks, Michael; Bruehl, Stephen; Harden, R. Norman (1 de maio de 2007). «Proposed New Diagnostic Criteria for Complex Regional Pain Syndrome». Pain Medicine. 8: 326–331. ISSN 1526-2375. PMID 17610454. doi:10.1111/j.1526-4637.2006.00169.x
- ↑ «The natural history of complex regional pain syndrome». The Clinical Journal of Pain. 25: 273–80. May 2009. PMID 19590474. doi:10.1097/AJP.0b013e31818ecea5 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Schwartzman RJ, Erwin KL, Alexander GM(ajuda) - ↑ Proposed new diagnostic criteria for complex regional pain syndrome. Harden RN, Bruehl S, Stanton-Hicks M, Wilson PR. Pain Med. 2007 May-Jun;8(4):326-31.
- ↑ a b «Clinical features and pathophysiology of complex regional pain syndrome». Lancet Neurology. 10: 637–48. July 2011. PMC 5511749 . PMID 21683929. doi:10.1016/S1474-4422(11)70106-5 Verifique data em:
|data=(ajuda) - ↑ a b c «Complex regional pain syndrome - Symptoms and causes». Mayo Clinic
- ↑ «McGILL Pain Index and CRPS or RSD». Consultado em 5 de dezembro de 2012. Cópia arquivada em 9 de novembro de 2012
- ↑ Bruehl, Stephen; Harden, R. Norman; Galer, Bradley S.; Saltz, Samuel; Backonja, Miroslav; Stanton-Hicks, Michael (January 2002). «Complex regional pain syndrome: are there distinct subtypes and sequential stages of the syndrome?». Pain. 95: 119–124. ISSN 0304-3959. PMID 11790474. doi:10.1016/s0304-3959(01)00387-6 Verifique data em:
|data=(ajuda) - ↑ «Complex regional pain syndrome». nhs.uk. 19 de outubro de 2017
- ↑ a b «Signs and symptoms of reflex sympathetic dystrophy: prospective study of 829 patients». Lancet. 342: 1012–6. October 1993. PMID 8105263. doi:10.1016/0140-6736(93)92877-V Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Veldman PH, Reynen HM, Arntz IE, Goris RJ(ajuda) - ↑ Yu D (August 2004). «Shoulder pain in hemiplegia». Physical Medicine and Rehabilitation Clinics of North America. 15: vi–vii, 683–97. PMID 15219895. doi:10.1016/S1047-9651(03)00130-X Verifique data em:
|data=(ajuda) - ↑ «Reflex sympathetic dystrophy and cigarette smoking». The Journal of Hand Surgery. 18: 168–9. January 1993. PMID 8423309. doi:10.1016/0363-5023(93)90273-6 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Pawelka S, Fialka V, Ernst E(ajuda) - ↑ Complex regional pain syndrome in adults - UK guidelines for diagnosis, referral and management in primary and secondary care; Royal College of Physicians London (May 2012)
- ↑ Complex regional pain syndrome type I: a comprehensive review. Bussa M, Guttilla D, Lucia M, Mascaro A, Rinaldi S. Acta Anaesthesiol Scand. 2015 Jul;59(6):685-97. Epub 2015 Apr 22.
- ↑ «A review of psychosocial factors in complex regional pain syndrome». Journal of Clinical Psychology in Medical Settings. 20: 247–54. June 2013. PMID 22961122. doi:10.1007/s10880-012-9322-3 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Lohnberg JA, Altmaier EM(ajuda) - ↑ «Brain processing during mechanical hyperalgesia in complex regional pain syndrome: a functional MRI study». Pain. 114: 93–103. March 2005. PMID 15733635. doi:10.1016/j.pain.2004.12.001 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Maihöfner C, Forster C, Birklein F, Neundörfer B, Handwerker HO(ajuda) - ↑ «Pain». Courses.washington.edu. Consultado em 23 de dezembro de 2013
- ↑ a b «Subanesthetic ketamine infusion therapy: a retrospective analysis of a novel therapeutic approach to complex regional pain syndrome». Pain Medicine. 5: 263–75. September 2004. PMID 15367304. doi:10.1111/j.1526-4637.2004.04043.x Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Correll GE, Maleki J, Gracely EJ, Muir JJ, Harbut RE(ajuda) - ↑ «A pilot open-label study of the efficacy of subanesthetic isomeric S(+)-ketamine in refractory CRPS patients». Pain Med. 9: 44–54. 2008. PMID 18254766. doi:10.1111/j.1526-4637.2006.00223.x
- ↑ «Topically administered ketamine reduces capsaicin-evoked mechanical hyperalgesia». The Clinical Journal of Pain. 22: 32–6. January 2006. PMID 16340591. doi:10.1097/01.ajp.0000149800.39240.95 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Pöyhiä R, Vainio A(ajuda) - ↑ «Immune regulation of central nervous system functions: from sickness responses to pathological pain». Journal of Internal Medicine. 257: 139–55. February 2005. PMID 15656873. doi:10.1111/j.1365-2796.2004.01443.x Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Watkins LR, Maier SF(ajuda) - ↑ «The neurocognitive effects of 5-day anesthetic ketamine for the treatment of refractory complex regional pain syndrome». Archives of Clinical Neuropsychology. 22: 719–29. August 2007. PMID 17611073. doi:10.1016/j.acn.2007.05.005 Verifique data em:
|data=(ajuda) - ↑ Birklein F (February 2005). «Complex regional pain syndrome». Journal of Neurology. 252: 131–8. CiteSeerX 10.1.1.483.1324 . PMID 15729516. doi:10.1007/s00415-005-0737-8 Verifique data em:
|data=(ajuda) - ↑ «Can vitamin C prevent complex regional pain syndrome in patients with wrist fractures? A randomized, controlled, multicenter dose-response study». The Journal of Bone and Joint Surgery. American Volume. 89: 1424–31. July 2007. PMID 17606778. doi:10.2106/JBJS.F.01147 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Zollinger PE, Tuinebreijer WE, Breederveld RS, Kreis RW(ajuda) - ↑ «Autoantibodies produce pain in complex regional pain syndrome by sensitizing nociceptors». Pain Med. 160: 2855–2865. 2019. PMID 31343542. doi:10.1097/j.pain.0000000000001662
- ↑ Bajayo, A; Bar, A; Denes, A; Bachar, M; Kram, V; Attar-Namdar, M; Zallone, A; Kovács, KJ; Yirmiya, R (18 September 2012). «Skeletal parasympathetic innervation communicates central IL-1 signals regulating bone mass accrual.». Proceedings of the National Academy of Sciences of the United States of America. 109: 15455–60. Bibcode:2012PNAS..10915455B. PMC 3458367 . PMID 22949675. doi:10.1073/pnas.1206061109 Verifique data em:
|data=(ajuda) - ↑ Kondo, H; Takeuchi, S; Togari, A (1 March 2013). «β-Adrenergic signaling stimulates osteoclastogenesis via reactive oxygen species.». American Journal of Physiology. Endocrinology and Metabolism. 304: E507-15. PMID 23169789. doi:10.1152/ajpendo.00191.2012 Verifique data em:
|data=(ajuda) - ↑ Nencini, S; Ivanusic, JJ (2016). «The Physiology of Bone Pain. How Much Do We Really Know?». Frontiers in Physiology. 7. 157 páginas. PMC 4844598 . PMID 27199772. doi:10.3389/fphys.2016.00157
- ↑ a b Bazika-Gerasch, B; Maier, C; Kumowski, N; Fiege, C; Kaisler, M; Vollert, J; Dietrich, JW (June 2019). «Compared to limb pain of other origin, ultrasonographic osteodensitometry reveals loss of bone density in complex regional pain syndrome.». Pain. 160: 1261–1269. PMID 30747906. doi:10.1097/j.pain.0000000000001520 Verifique data em:
|data=(ajuda) - ↑ Harden, Norman R.; Bruehl, Stephen; Perez, Roberto S.G.M.; Birklein, Frank; Marinus, Johan; Maihofner, Christian; Lubenow, Timothy; Buvanendran, Asokumar; Mackey, Sean (August 2010). «Validation of proposed diagnostic criteria (the "Budapest Criteria") for Complex Regional Pain Syndrome». Pain. 150: 268–274. ISSN 0304-3959. PMC 2914601 . PMID 20493633. doi:10.1016/j.pain.2010.04.030 Verifique data em:
|data=(ajuda) - ↑ Frontera, Walter R.; Silver, Julie K.; Rizzo, Thomas D. (5 de setembro de 2014). Essentials of Physical Medicine and Rehabilitation E-Book (em inglês). [S.l.]: Elsevier Health Sciences. ISBN 978-0-323-22272-3
- ↑ «Despite clinical similarities there are significant differences between acute limb trauma and complex regional pain syndrome I (CRPS I)». Pain. 93: 165–71. August 2001. PMID 11427328. doi:10.1016/s0304-3959(01)00309-8 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Birklein F, Künzel W, Sieweke N(ajuda) - ↑ «Skin temperature side differences--a diagnostic tool for CRPS?». Pain. 98: 19–26. July 2002. PMID 12098613. doi:10.1016/s0304-3959(01)00470-5 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Wasner G, Schattschneider J, Baron R(ajuda) - ↑ «Stress infrared telethermography is useful in the diagnosis of complex regional pain syndrome, type I (formerly reflex sympathetic dystrophy)». Clin J Pain. 13: 50–9. March 1997. PMID 9084952. doi:10.1097/00002508-199703000-00008 Verifique data em:
|data=(ajuda) - ↑ «Reflex Sympathetic Dystrophy Clinical Practice Guidelines». Rsdfoundation.org. 1 de janeiro de 2003. Consultado em 23 de dezembro de 2013. Cópia arquivada em 2 de novembro de 2013
- ↑ «Warm and cold complex regional pain syndromes: differences beyond skin temperature?». Neurology. 72: 505–12. February 2009. PMID 19204260. doi:10.1212/01.wnl.0000341930.35494.66 Verifique data em:
|data=(ajuda) - ↑ «Patients initially diagnosed as "warm" or "cold" CRPS 1 show differences in central sensory processing some eight years after diagnosis: a quantitative sensory testing study». Pain. 115: 204–11. May 2005. PMID 15836983. doi:10.1016/j.pain.2005.02.031 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Vaneker M, Wilder-Smith OH, Schrombges P, de Man-Hermsen I, Oerlemans HM(ajuda) - ↑ Meena, S; Sharma, P; Gangary, SK; Chowdhury, B (9 December 2014). «Role of vitamin C in prevention of complex regional pain syndrome after distal radius fractures: a meta-analysis.». European Journal of Orthopaedic Surgery & Traumatology : Orthopedie Traumatologie. 25: 637–41. PMID 25488053. doi:10.1007/s00590-014-1573-2 Verifique data em:
|data=(ajuda) - ↑ a b «Complex regional pain syndrome». Foot and Ankle Clinics. 16: 351–66. June 2011. CiteSeerX 10.1.1.483.1324 . PMID 21600455. doi:10.1016/j.fcl.2011.03.001 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Shah A, Kirchner JS(ajuda) - ↑ a b c d O'Connell, NE; Wand, BM; McAuley, J; Marston, L; Moseley, GL (30 April 2013). «Interventions for treating pain and disability in adults with complex regional pain syndrome.». The Cochrane Database of Systematic Reviews. 4: CD009416. PMC 6469537 . PMID 23633371. doi:10.1002/14651858.CD009416.pub2 Verifique data em:
|data=(ajuda) - ↑ Lewis, Jennifer S.; Kellett, Sara; McCullough, Ryan; Tapper, Ashley; Tyler, Chelsey; Viner, Maria; Palmer, Shea (2 de agosto de 2019). «Body Perception Disturbance and Pain Reduction in Longstanding Complex Regional Pain Syndrome Following a Multidisciplinary Rehabilitation Program». Pain Medicine (Malden, Mass.). 20: 2213–2219. ISSN 1526-4637. PMID 31373373. doi:10.1093/pm/pnz176
- ↑ Moseley, G; Zalucki, N; Wiech, K (2008). «Tactile discrimination, but not tactile stimulation alone, reduces chronic limb pain». Pain. 137: 600–8. PMID 18054437. doi:10.1016/j.pain.2007.10.021
- ↑ «Does evidence support physiotherapy management of adult Complex Regional Pain Syndrome Type One? A systematic review». European Journal of Pain. 13: 339–53. April 2009. PMID 18619873. doi:10.1016/j.ejpain.2008.05.003 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Daly AE, Bialocerkowski AE(ajuda) - ↑ «Graded Motor Imagery». Graded Motor Imagery. Consultado em 23 de dezembro de 2013
- ↑ O'Connell, NE; Wand, BM; Gibson, W; Carr, DB; Birklein, F; Stanton, TR (28 July 2016). «Local anaesthetic sympathetic blockade for complex regional pain syndrome.». The Cochrane Database of Systematic Reviews (Submitted manuscript). 7: CD004598. PMC 7202132 . PMID 27467116. doi:10.1002/14651858.CD004598.pub4 Verifique data em:
|data=(ajuda) - ↑ «Intramuscular botulinum toxin in complex regional pain syndrome: case series and literature review». Pain Physician. 14: 419–24. 2011. PMID 21927045. Cópia arquivada em 3 de fevereiro de 2015 Verifique o valor de
|display-authors=Kharkar S, Ambady P, Venkatesh Y, Schwartzman RJ(ajuda) - ↑ Azari, P; Lindsay, DR; Briones, D; Clarke, C; Buchheit, T; Pyati, S (1 March 2012). «Efficacy and safety of ketamine in patients with complex regional pain syndrome: a systematic review.». CNS Drugs. 26: 215–28. PMID 22136149. doi:10.2165/11595200-000000000-00000 Verifique data em:
|data=(ajuda) - ↑ Schwartzman, RJ; Alexander, GM; Grothusen, JR (May 2011). «The use of ketamine in complex regional pain syndrome: possible mechanisms.». Expert Review of Neurotherapeutics. 11: 719–34. PMID 21539489. doi:10.1586/ern.11.31 Verifique data em:
|data=(ajuda) - ↑ Niesters, M; Martini, C; Dahan, A (February 2014). «Ketamine for chronic pain: risks and benefits.». British Journal of Clinical Pharmacology. 77: 357–67. PMC 4014022 . PMID 23432384. doi:10.1111/bcp.12094 Verifique data em:
|data=(ajuda) - ↑ «Biphosphonates for the therapy of complex regional pain syndrome I--systematic review» (PDF). European Journal of Pain (Submitted manuscript). 13: 17–21. January 2009. PMID 18440845. doi:10.1016/j.ejpain.2008.03.005 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Brunner F, Schmid A, Kissling R, Held U, Bachmann LM(ajuda) - ↑ «Complex Regional Pain Syndrome Fact Sheet | National Institute of Neurological Disorders and Stroke»
- ↑ Stengel, M; Binder, A; Baron, R (2007). «Update on the diagnosis and management of complex regional pain syndrome». Adv Pain Manage. 3: 96–104
- ↑ «Spinal cord stimulation for complex regional pain syndrome: a systematic review of the clinical and cost-effectiveness literature and assessment of prognostic factors». European Journal of Pain. 10: 91–101. February 2006. PMID 16310712. doi:10.1016/j.ejpain.2005.02.004 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Taylor RS, Van Buyten JP, Buchser E(ajuda) - ↑ Visnjevac, O; Costandi, S; Patel, BA; Azer, G; Agarwal, P; Bolash, R; Mekhail, NA (April 2017). «A Comprehensive Outcome-Specific Review of the Use of Spinal Cord Stimulation for Complex Regional Pain Syndrome.». Pain Practice. 17: 533–545. PMID 27739179. doi:10.1111/papr.12513 Verifique data em:
|data=(ajuda) - ↑ vauthors=Deer T, et al | Dorsal root ganglion stimulation yielded higher treatment success for complex regional pain syndrome and causalgia at 3 and 12 months: a randomized comparative trial | Pain |volume=158 | issue=4| pages=669-681 | pmid=5359787 | doi=10.197/j.pain.0000000000000814
- ↑ «Complex Regional Pain Syndromes: guidelines for therapy». The Clinical Journal of Pain. 14: 155–66. June 1998. PMID 9647459. doi:10.1097/00002508-199806000-00012 Verifique data em:
|data=(ajuda) - ↑ «Therapy-resistant complex regional pain syndrome type I: to amputate or not?». The Journal of Bone and Joint Surgery. American Volume. 93: 1799–805. October 2011. PMID 22005865. doi:10.2106/JBJS.J.01329 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Bodde MI, Dijkstra PU, den Dunnen WF, Geertzen JH(ajuda) - ↑ «Complex Regional Pain Syndrome (CRPS): Management and Treatment». Cleveland Clinic. Consultado em 10 August 2020 Verifique data em:
|acessodata=(ajuda) - ↑ «RSDSA :: Reflex Sympathetic Dystrophy Syndrome Association». Rsds.org. 21 de janeiro de 2010. Consultado em 10 de abril de 2010. Cópia arquivada em 24 de março de 2010
- ↑ «Complex regional pain syndrome in children: incidence and clinical characteristics». Arch Dis Child. 101: archdischild–2015–310233. February 2016. PMID 27005945. doi:10.1136/archdischild-2015-310233 Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Abu-Arafeh H, Abu-Arafeh I(ajuda) - ↑ Mitchell, S.W. (1872). Injuries of Nerves and their Consequences. Philadelphia: JB Lippincott 377 pages.
- ↑ Richards RL (January 1967). «The term 'causalgia'». Medical History. 11: 97–9. PMC 1033672 . PMID 5341040. doi:10.1017/s0025727300011789 Verifique data em:
|data=(ajuda) - ↑ EVANS JA (March 1947). «Reflex sympathetic dystrophy; report on 57 cases». Annals of Internal Medicine. 26: 417–26. PMID 20288177. doi:10.7326/0003-4819-26-3-417 Verifique data em:
|data=(ajuda) - ↑ «Reflex sympathetic dystrophy: changing concepts and taxonomy». Pain. 63: 127–33. October 1995. PMID 8577483. doi:10.1016/0304-3959(95)00110-E Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Stanton-Hicks M, Jänig W, Hassenbusch S, Haddox JD, Boas R, Wilson P(ajuda) - ↑ McCabe, C. S. (2003). «A controlled pilot study of the utility of mirror visual feedback in the treatment of complex regional pain syndrome (type 1)». Oxford University Press (OUP). Rheumatology (Oxford, England). 42: 97–101. ISSN 1460-2172. PMID 12509620. doi:10.1093/rheumatology/keg041
- ↑ TREND homepage Arquivado em dezembro 24, 2009, no Wayback Machine.
- ↑ «Continuous extradural analgesia in a cow with complex regional pain syndrome». Veterinary Anaesthesia and Analgesia. 33: 189–92. May 2006. PMID 16634945. doi:10.1111/j.1467-2995.2005.00245.x Verifique data em:
|data=(ajuda); Verifique o valor de|display-authors=Bergadano A, Moens Y, Schatzmann U(ajuda) - ↑ Nia Frazier https://m.facebook.com/DrHollyFrazier/posts/thank-you-all-for-tuning-into-tonights-episode-of-dance-moms-this-was-a-very-per/213060555505579/
- ↑ Paula Abdul «Archived copy». Consultado em 2 de junho de 2015. Cópia arquivada em 2 de junho de 2015
- ↑ LA Times: Jill Kinmont Boothe is still going strong http://articles.latimes.com/2011/may/22/sports/la-sp-crowe-20110523
- ↑ Shin Dong-Wook http://www.allkpop.com/2013/01/actor-shin-dong-wook-suffering-from-rare-disease
- ↑ Forest Tennant, MD, DrPH (July–August 2007). «Howard Hughes & Pseudoaddiction» (PDF). Practical Pain Management. 6: 12–29. Consultado em January 7, 2011. Cópia arquivada (PDF) em September 25, 2007 Verifique data em:
|acessodata=, |arquivodata=, |data=(ajuda) - ↑ Rachel Morris http://www.paralympics.org.uk/gb/athletes/rachel-morris Arquivado em 2012-09-01 no Wayback Machine
- ↑ Cynthia Toussaint http://www.lifescript.com/health/centers/pain/articles/how_a_hamstring_tear_derailed_a_dancers_life.aspx
- ↑ BBC https://www.bbc.co.uk/sport/disability-sport/27064013
- ↑ «Radene Marie Cook». 2 de dezembro de 2017
- ↑ De Standaard - Rolstoelatlete Marieke Vervoort is overleden
- ↑ Bruno Soriano, la lesión más larga