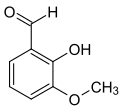
orto-Vanilina
| Orto-Vanilina Alerta sobre risco à saúde | |
|---|---|

| |
| Outros nomes | 2-Hidroxi-3-metoxibenzaldeído o-Vanilina |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Propriedades | |
| Fórmula molecular | C8H8O3 |
| Massa molar | 152,15 g·mol−1 |
| Aparência | agulhas cristalinas de cor amarelo pálido[1] |
| Ponto de fusão | |
| Ponto de ebulição |
265–266 °C[2] |
| Solubilidade em água | THF: 5,37 M, Etanol: 3,04 M, Metanol: 2,27 M[3] |
| Compostos relacionados | |
| Outros aniões/ânions | Novovanilina (etoxi no lugar do metoxi) |
| Compostos relacionados | Vanilina e isovanilina (isômeros) orto-Acetovanilona (em vez de metanal, etanona) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
orto-Vanilina ou o-Vanilina (2-hidroxi-3-metoxibenzaldeído) é um composto orgânico com a fórmula molecular C8H8O3. É um derivado substituído do benzaldeído com um grupo hidroxila adicional e um grupo metóxi.
Apresenta-se quando substância pura como um sólido e está presente nos óleos essenciais de muitas plantas.[4][5][6] Seus grupos funcionais incluem aldeído, éter e fenol, e é distintamente diferente de seu isômero mais prevalente, a vanilina. O prefixo "orto-" refere-se à posição da fração hidroxila do composto, a qual é encontrada na posição "para-" na vanilina.
orto-Vanilina é um sólido cristalino, fibroso, amarelo brilhante. Diferentemente de seu mais bem conhecido análogo, o-vanilina não tem o odor intenso e característico de baunilha. Presente em uma variedade de produtos alimentares, não é especificamente procurado, e é, portanto, um aditivo alimentar menos comummente produzido e disponível.
História editar
orto-Vanilina foi primeiro isolada, em 1876, pelo renomado químico alemão Ferdinand Tiemann.[7] Em torno de 1910, métodos para sua purificação foram desenvolvidos por Francis Noelting, que similarmente demonstrou a sua versatilidade como um precursor sintético geral para um conjunto diverso de compostos, tais como as cumarinas.[8]
Em torno de 1920, o composto iniciou a apresentar uso como um corante para peles.[9]
Propriedades biológicas editar
orto-Vanilina é nociva se ingerida, irritante aos olhos, pele e sistema respiratório, mas tem um inconfundível alto DL50 de 1330 mg/kg em camundongos.[10]
É um fraco inibidor de tirosinase,[11] a apresenta tanto propriedades antimutagênicas e comutagênicas em Escherichia coli.[12] No entanto, o seu efeito em balanço (resultado final) torna-o um “potente comutagênico.”[13]
orto-Vanilina possui propriedades antifúngica e antibacteriana moderadas.[14]
Usos editar
Hoje, a maior parte da orto-vanilina é usada no estudo de mutagênese e um precursor sintético para fármacos, tais como as cumarinas.[8]
Referências
- ↑ F. Iwasaki, I. Tanaka, A. Aihara: „2-Hydroxy-3-methoxybenzaldehyde (o-Vanillin)“, in: Acta Cryst. B, 1976, 32 (4), S. 1264–1266; doi:10.1107/S0567740876005086.
- ↑ a b Catálogo da Sigma-Aldrich, Orto-Vanilina
- ↑ Solubility of ortho-vanillin in non-aqueous solvents
- ↑ Abou Zeid, A. H.; Sleem, A. A. (2002). «Natural and stress constituents from Spinacia oleracea L. leaves and their biological activities». Bulletin of the Faculty of Pharmacy (Cairo University). 40 (2): 153–167
- ↑ Barbe, Jean-Christophe; Bertrand, Alain. (1996). «Quantitative analysis of volatile compounds stemming from oak wood. Application to the aging of wines in barrels». Journal des Sciences et Techniques de la Tonnellerie. 2: 77–88
- ↑ Brunke, E. J.; Hammerschmidt, F. J.; Schmaus, G. (1992). «Das etherische Öl von Santolina chamaecyparissus L. (Santolina chamaecyparissus essential oil)». Parfümerie und Kosmetik. 73 (9): 617–618, 623–624, 626, 628–630, 632, 634–637
- ↑ Tiemann, Ferdinand (1876). «Ueber die der Coniferyl- und Vanillinreihe angehörigen Verbindungen (Coniferyl- and vanillin series-related compounds)». Berichte der Deutschen Chemischen Gesellschaft. 9: 409–423. doi:10.1002/cber.187600901133
- ↑ a b Noelting, Francis A. M. o-Hydroxy-m-methoxybenzaldehyde (Orthovanillin). Annales de chimie et de physique (1910), 19, 476–550.
- ↑ Gerngross, Otto. Dyeing hide with o-vanillin and o-protocatechualdehyde and the aldehyde tanning. Angewandte Chemie (1920), 33 (44), 136–138.
- ↑ http://msds.chem.ox.ac.uk/VA/o-vanillin.html
- ↑ Kubo, Isao; Kinst-Hori, Ikuyo. Tyrosinase inhibitory activity of the olive oil flavor compounds. Journal of Agricultural and Food Chemistry (1999), 47 (11), 4574–4578.
- ↑ Watanabe, Kazuko; Ohta, Toshihiro; Shirasu, Yasuhiko. Enhancement and inhibition of mutation by o-vanillin in Escherichia coli. Mutation Research, DNA Repair (1989), 218 (2), 105–109.
- ↑ Takahashi, Kazuhiko; Sekiguchi, Mutsuo; Kawazoe, Yutaka. A specific inhibition of induction of adaptive response by o-vanillin, a potent comutagen. Biochemical and Biophysical Research Communications (1989), 162 (3), 1376–1381.
- ↑ Leifertova, I.; Hejtmankova, N.; Hlava, H.; Kudrnacova, J.; Santavy, F. Antifungal and antibacterial effects of phenolic substances. A study of the relation between the biological activity and the constitution of the investigated compounds. Acta Universitatis Palackianae Olomucensis, Facultatis Medicae (1975), 74, 83–101.