Ácido carborano
| Ácido Carborano H[CXB11Y5Z6] Alerta sobre risco à saúde | |
|---|---|

| |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácidos carborano H(CXB11Y5Z6) (X, Y, Z = H, Alk, F, Cl, Br, CF3) são uma classe de superácidos.[1] Estima-se que são um milhão de vezes mais fortes do que o ácido sulfúrico alguns 100% em termos das sua função de acidez de Hammet com valores (H 0 ≤ -18) e possuem os valores de pK a abaixo dos -20, estabelecendo-los como alguns dos mais fortes ácidos de Bronsted conhecidos.[2][3][4] O exemplo mais bem estudado é o ácido clorocarborânico, H (CHB11Cl11 ). Verificou-se que a acidez do H(CHB11Cl11 ) excedia largamente a do ácido tríflico, CF3SO3H, e bistriflimida, (CF3SO2)2NH, compostos anteriormente considerados como os ácidos isolados mais fortes.
Suas altas acidez derivam da extensa deslocalização de suas bases conjugadas, ânions carboranato (CXB11Y5Z6- ), que são geralmente mais estabilizados por grupos eletronegativos como Cl, F e CF 3 . Devido à falta de propriedades oxidantes e o excepcionalmente baixa nucleofilicidade e alta estabilidade das suas bases conjugadas, que são os únicos superácidos conhecidos para protonar C60 fulereno sem o decompor.[5][6] Além disso, eles formam sais estáveis, isoláveis com benzeno protonado, C 6H7+, o composto parental dos intermediários Wheland encontradas em reações de substituição electrófila aromática.
O ácido fluorado carborano, H(CHB 11F11), é ainda mais forte que o ácido carborano clorado. É capaz de protonar o butano para formar o cátion tert-butílico à temperatura ambiente e é o único ácido conhecido a protonar o dióxido de carbono para dar o cátion em ponte, [H(CO 2)2]+, tornando-o possivelmente o ácido mais forte conhecido. Em particular, o dióxido de carbono não sofre protonação observável quando tratado com os superácidos mistos HF-SBF5 ou HSO3 F-5 SBF.[7][8][8][9]
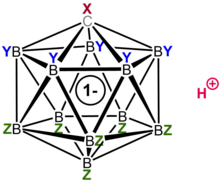
Como classe, os ácidos carborano formam o grupo mais ácido de substâncias conhecidas, bem definidas e isoláveis, muito mais ácidas do que os ácidos fortes de componente único conhecidos anteriormente, como o ácido triflico ou o ácido perclórico . Em certos casos, como os derivados quase peralogenados mencionados acima, suas aci- midades rivalizam (e possivelmente excedem) as dos superácidos mistos Lewis-Brønsted tradicionais, como o ácido mágico e o ácido fluoroantimônico . (No entanto, uma comparação direta não foi possível até agora, devido à falta de uma medida de acidez que é adequada para ambas as classes de ácidos: pKa valores são mal definidos para os ácidos mistos quimicamente complexos enquanto Os valores de H 0 não podem ser medidos para os ácidos carborano de fusão muito elevada).
Referências
- ↑ Note that the image the acidic proton is not the one bonded to the carborane but that it is the counterion not displayed.
- ↑ Olah, G. A.; Prakash, G. K. S.; Sommer, J.; Molnar, A. Superacid Chemistry. [S.l.: s.n.] ISBN 978-0-471-59668-4
- ↑ That is, were it liquid, the protonating ability of a neat sample of the carborane superacid, as measured by the activity of H+, would be a million times higher than that of 100% sulfuric acid.
- ↑ «Superacidity of closo -Dodecaborate-Based Brønsted Acids: a DFT Study». The Journal of Physical Chemistry A. 119. PMID 25513897. doi:10.1021/jp506485x
- ↑ «The Strongest Isolable Acid». Angewandte Chemie International Edition. 43. PMID 15468064. doi:10.1002/anie.200460005
- ↑ «Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry» (PDF). Chemical Communications. 2005. PMID 15791295. doi:10.1039/b415425h
- ↑ «The Strongest Brønsted Acid: Protonation of Alkanes by H(CHB11F11) at Room Temperature». Angewandte Chemie International Edition. 53. PMC 4993161 . PMID 24339386. doi:10.1002/anie.201308586
- ↑ a b «Myths about the proton. The nature of H+ in condensed media». Acc. Chem. Res. 46. PMC 3833890 . PMID 23875729. doi:10.1021/ar400064q
- ↑ «The Strongest Acid: Protonation of Carbon Dioxide». Angewandte Chemie International Edition. 55. ISSN 1521-3773. PMID 26663640. doi:10.1002/anie.201509425