Ácido cloroáurico
| Ácido cloroáurico Alerta sobre risco à saúde | |||||||
|---|---|---|---|---|---|---|---|
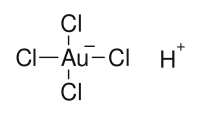
| |||||||
| Outros nomes | ácido tetracloroáurico tetracloro aurato(III) de hidrogênio tetracloro aurato | ||||||
| Identificadores | |||||||
| Número CAS | |||||||
| Propriedades | |||||||
| Fórmula molecular | HAuCl4 | ||||||
| Massa molar | 339,79 g/mol (forma anidra) 393.83 g/mol (tri-hidrato) | ||||||
| Aparência | cristais amarelo ouro higroscópico | ||||||
| Densidade | 3,9 g/cm3 (tri-hidrato) | ||||||
| Solubilidade em água | solúvel em água | ||||||
| Solubilidade | solúvel em álcool, éter | ||||||
| Riscos associados | |||||||
| Classificação UE | not listed | ||||||
| Principais riscos associados |
| ||||||
| Frases R | 34‐43 | ||||||
| Frases S | 26‐36/37/39‐45 | ||||||
| Compostos relacionados | |||||||
| Compostos relacionados | ácido cloroplatínico | ||||||
| Página de dados suplementares | |||||||
| Estrutura e propriedades | n, εr, etc. | ||||||
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas | ||||||
| Dados espectrais | UV, IV, RMN, EM | ||||||
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |||||||
Ácido cloroáurico é o composto de fórmula química HAuCl4. Ele é normalmente usado como fonte de ouro (Au) em experiências químicas. O ácido cloroáurico é o produto formado ao dissolver ouro em água régia, por exemplo, ao retirar ouro de componentes eletrônicos. O mesmo nome é usado para a forma anidra e para a forma tri-hidratada.
Obtenção e síntese
editarA maneira mais convencional e trivial de se obter o ácido cloroáurico é a dissolução de ouro elementar em água régia (uma mistura de três partes de ácido clorídrico para uma parte de ácido nítrico):[1]
Uma outra possibilidade é a reação entre cloreto áurico e ácido clorídrico:[1]
-
Dissolução progressiva de ouro em água régia.
Propriedades
editarPropriedades físicas
editarPropriedades químicas
editarReações
editarO tratamento alcalino do ácido cloroáurico, com uma base padrão, resulta na produção de sal metálico de tetracloro-ouro e água. O respectivo sal de tálio possui solubilidade baixa na maioria dos solventes. A combinação com amônio (sal quaternário de amônio) também é conhecida.[2] Outros sais de forma complexa são: [Au(bi-pir)Cl2][AuCl4][3] e [Co(NH3)6][AuCl4]Cl2.
A redução parcial do ácido produz dicloroaurato(I), [AuCl2]- (oxônio como contra-ião).[4]<--- (Ref. ERRADA??) Através de redução podem também ser produzidos outris compostos de coordenação do ouro(I), especiamente utilizando-se ligantes orgânicos. Frequentemente o próprio ligante serve como agente redutor, como é no caso da tioureia, (H2N)CS:
O ácido cloroáurico é o composto percursor na preparação de nanopartículas de ouro. Para precipitação destas agentes redutores, como por exemplo o tiosulfato (Na2S2O3), são usados.[5]
O aquecimento da forma hidratada (HAuCl4• n H2O) em uma corrente de gás cloro resulta em cloreto áurico (o cloreto de ouro (III), Au2Cl6).[6]
Anedota histórica
editarDurante a Segunda Grande Guerra, o químico húngaro residente na Dinamarca, George de Hevesy, laureado com o Prémio Nobel no ano de 1943, decidiu literalmente transformar as medalhas de pelo menos dois, também laureados, colegas (Max von Laue e James Franck) em ácido cloroáurico, dissolvendo-as em água régia, para escondê-las dos nazistas. E assim o fez, quando Copenhagen acabara de ser invadida. Após a guerra, o ouro foi recuperado e a Fundação Nobel generosamente refez as medalhas.[7]
Referências
- ↑ a b «Gold-Verbindungen». RÖMPP-Online (em alemão). Consultado em 28 de novembro de 2014
- ↑ Makotchenko; Kokovkin (setembro de 2010). «Solid contact [AuCl4]−-selective electrode and its application for evaluation of gold(III) in solutions». Russian Journal of General Chemistry (em inglês). 80 (9): 1733-1737. ISSN 1070-3632. doi:10.1134/S1070363210090021
- ↑ Mironov, Tsvelodub. L. D.; "Equilibria of the substitution of pyridine, 2,2'-Bipyridyl, and 1,10-Phenanthroline for Cl− in AuCl4− in aqueous solution", Russian Journal of Inorganic Chemistry. 2001, vol. 46, p. 143–148.
- ↑ Huang, Xiaohua; Peng, Xianghong; Wang, Yiqing; Yuxiang, Wang; Shin, Dong M.; El-Sayed, Mostafa A.; Nie, Shuming (26 de outubro de 2010). «A reexamination of active and passive tumor targeting by using rod-shaped gold nanocrystals and covalently conjugated peptide ligands». ACS Publications. ACS Nano. 4 (10): 5887–5896. doi:10.1021/nn102055s
- ↑ Zhang; et al. (2012). «Tunability and stability of gold nanoparticles obtained from chloroauric acid and sodium thiosulfate reaction» (PDF). Nanoscale Research Letters. 7. 337 páginas. doi:10.1186/1556-276X-7-337
- ↑ Mellor J. W. A comprehensive treatise on inorganic and theoretical chemistry. Vol. 3. 1946. p. 593.
- ↑ Lemmel, Birgitta (11 de março de 1998). «The Nobel Medals and the Medal for the Prize in Economic Sciences». Consultado em 28 de novembro de 2014
Ligações externas
editar- «Chloroauric Acid» (em inglês). breve texto acadêmico com descrição e ilustrações
