Ligação iônica
Ligação iônica (português brasileiro) ou iónica (português europeu) é um tipo de ligação química baseada na atração eletrostática[1] de íons com cargas opostas. O exemplo mais comum de composto iônico é o cloreto de sódio (NaCl), que é o principal constituinte do sal de cozinha[2].
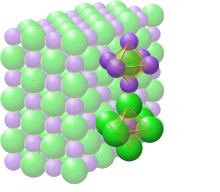
A representação dos compostos iônicos é feita por meio de formulas mínimas ou unitárias, ou seja, a representação NaCl, não se refere a simplesmente uma ligação entre um átomo de sódio e um átomo de cloro, pelo contrário, ela representa uma estrutura mínima que se repete em todo o retículo cristalino do composto, onde os íons de sódio (Na+) estão em proporção de 1 para 1 com os íons cloreto (Cl-)[3].
A maioria dos compostos iônicos tem origem mineral, podendo ser encontrados no solo ou dissolvidos em água[4].
Na água do mar, por exemplo, existem íons dissolvidos[2]. Alguns desses íons são positivos, como sódio, potássio e cálcio, e outros são negativos, como cloreto, bicarbonato e sulfato. Ao evaporarmos a água do mar por aquecimento, a remoção das moléculas de água faz com que se intensifique a interação atrativa entre os íons positivos e negativos, favorecendo o agrupamento desses íons em retículos cristalinos, até que se formem os cristais de compostos iônicos sólidos[5]. É assim que se obtém o sal (cloreto de sódio) a partir da água do mar nas salinas.
A ligação iônica ocorre entre elementos metálicos e não-metálicos, ou entre metais e o hidrogênio[3]. Essa ligação é formada quando há um conglomerado de átomos na forma de íons e a energia que os mantém justos é menor que a energia que os mantém separados. Com isso, as espécies são mantidas juntas por meio de forças eletrostáticas[4].
Para obter as espécies iônicas, há processos que podem ser feitos. Um exemplo seria obter o Óxido de Magnésio (MgO), um composto iônico, a partir da combustão do magnésio metálico[3]. A reação é a seguinte:
Nesse caso, há formação de um produto iônico, uma vez que a energia de ligação é menor que a energia de formação das espécies e a energia que os mantém separados, e a junção desses pelas forças elétrostáticas fornecem estabilidade às espécies[3].

Efeitos da polarização
editarOs íons em cristais de compostos predominantemente iônicos são esféricos, mas, se o íon positivo é pequeno e/ou altamente carregado, será distorcida a nuvem eletrônica do íon negativo. Essa polarização do íon negativo leva a criação de uma densidade de carga extra entre os dois núcleos atômicos, i.e., a covalência parcial. Íons negativos grandes são mais facilmente polarizados, mas, normalmente, o efeito só tem relevância quando íons positivos com cargas de 3+ (ex., Al3+) estão envolvidos (ex., AlCl3 puro é uma molécula covalente). No entanto, íons com carga 2+ (Be2+) ou até com carga 1+ (Li+) demonstram algum grau de polarização devido ao seu pequeno raio atômico (ex., LiI é iônico, mas tem algum caráter covalente). O Grau de Polarização depende da relação de carga e do tamanho do íon, geralmente chamada de densidade de carga.
Estrutura iônica
editarCompostos iônicos no estado sólido formam uma estrutura iônica contínua em um cristal iônico. A forma mais simples de cristal iônico é um cúbico simples. Nessa forma todos os átomos estão posicionados nas extremidades de um cubo. Essa célula unitária tem a massa que é a mesma de 1 dos átomos envolvidos. Quando todos os íons têm aproximadamente o mesmo tamanho, eles podem formar uma estrutura igual chamada cúbica de face-centrada (onde a massa é 4 vezes massa atômica), mas, quando os íons têm tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.
A estrutura do cristal iônico é dependente das energias de coesão existentes no cristal, que, por sua vez, são as energias de atração e repulsão que existem entre os átomos que fazem parte do cristal iônico. Conforme já descrito, as interações são coulômbicas, ou seja, eletroestáticas e a energia pode ser calculada pela seguinte relação:
Onde k = 4πԑ0, com ԑ0 sendo a constante de permissividade do vácuo, Z+ e Z_ referem-se às cargas dos compostos e r representa a distância entre as cargas. Ainda assim, uma outra fórmula pode relacionar melhor o fenômeno, considerando todas as interações existentes entre todos os átomos e considerar o fator geométrico do sólido, através da constante de Madelung (A, A = 0,69315) e a constante de Born-Landé (B), que relaciona as forças de repulsão existentes quando há a superposição de distribuições eletrônicas, inclusive:
Em que n é o expoente de Born. O segundo membro dessa soma representa a força de repulsão existente no cristal iônico.[6]
Caráter iônico da ligação
editarEstudos revelaram que não existe ligação iônica pura[3]. Todas ligações iônicas têm um grau de ligação covalente ou ligação metálica. Quanto maior a diferença na eletronegatividade entre dois átomos mais iônica se torna a ligação[3]. Compostos iônicos conduzem eletricidade quando fundidos ou em solução. Eles geralmente têm um alto ponto de fusão e tendem a ser solúveis em água[4].
Em uma ligação iônica, os átomos estão ligados pela atração de íons com cargas opostas, enquanto que em uma ligação covalente, os átomos estão ligados por compartilhamento de elétrons. Na ligação covalente, a geometria molecular de cada átomo é determinada pelas regras da VSEPR (Valence Shell Electron Pair Repulsion Theory - Teoria da repulsão entre os pares de elétrons da camada de valência), enquanto que, em materiais iônicos, a geometria segue as regras do empacotamento máximo e a resultante das cargas desses íons no empacotamento tende a ser nula.
Há, no entanto, uma tênue linha divisória entre a ligação covalente e a iônica. O caráter iônico de uma ligação pode ser definido por:
Onde é a diferença de eletronegatividade dos átomos. Linus Pauling estabeleceu que se essa diferença for superior a 1,7eV a ligação é considerada iônica. No entanto, pode-se dizer que a ligação Carbono-Bromo ( < 1,65) tem caráter levemente iônico.[7]
De uma maneira mais precisa e mais visualizável, o Triângulo de Ketelaar é uma proposta de entendimento eficaz do caráter iônico, covalente e/ou metálico, do composto a ser analisado. Essa espécie de diagrama leva em consideração a eletronegatividade de Pauling (dado expresso na tabela periódica) e a diferença de eletronegatividade entre os átomos participantes da interação. Com isso, o caráter iônico de certos compostos pode ser observado de maneira mais precisa e, além disso, o caráter covalente dos compostos considerados iônicos pode ser verificado também. Não apenas esses, mas o caráter metálico também pode ser verificado nesse diagrama. Compostos como o HF (fluoreto de hidrogênio) é considerado um composto covalente, porém, quando observado sob a ótica do Triângulo de Ketelaar, demonstra um acentuado caráter iônico. As três características (iônica, metálica e covalente) são representadas em cada um dos vértices do triângulo e, quanto mais houver proximidade dos vértices, maior proximidade do caráter designado por este.
Ver também
editarReferências
- ↑ Atkins, Peter (2001). Princípios de Química:Questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman. 181 páginas
- ↑ a b Pereira, Airton Vicente; Belinski, Andriele Costa; Valus, Natalicio; Beltrame, Flávio Luis (27 de outubro de 2008). «Avaliação da Qualidade de Amostras Comerciais de Sal de Cozinha». Iniciação Científica Cesumar (2): 97–101. ISSN 2176-9192. Consultado em 18 de julho de 2022
- ↑ a b c d e f g Atkins, P. W. (2012). Princípios de química : questionando a vida moderna e o meio ambiente. Loretta Jones 5. ed ed. Porto Alegre: Bookman. OCLC 940011380
- ↑ a b c D., Lee, J. (1999). Química inorgânica não tão concisa. [S.l.]: Edgard Blucher. OCLC 46759356
- ↑ ROCHA, Pedro Filipe Coelho. Dessalinização de água do mar. 2014. 88 f. Dissertação (Mestrado) - Curso de Engenharia Eletrónica Industrial e Computadores, Escola de Engenharia, Universidade do Minho, [S.L], 2014.
- ↑ DUARTE, Hélio. «Ligações Químicas: Ligação Iônica, Covalente e Metálica» (PDF). Química Nova na Escola. Consultado em 20 de abril de 2015
- ↑ «A qúimica antes da química do solo» (PDF). Consultado em 17 de fevereiro de 2021
