Septina
Septinas são proteínas que atuam no estágio final da divisão celular. Foram descobertas em 1970 por Leland H. Hartwell em estudos de fungos na fase da citocinese. O radical "sept" foi adotado para lembrar a formação do septo, que faz o estrangulamento no final da divisão, separando em duas partes o conteúdo citoplasmático. Resultados laboratoriais revelaram quatro mutantes que impediam a ocorrência natural da citocinese a certas temperaturas. Os genes correspondentes representam as quatro primeiras septinas, ScCDC3, ScCDC10, ScCDC11 e ScCDC12.
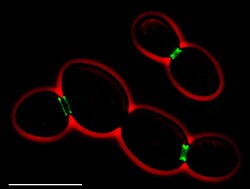
• Em verde: septinas (AgSEP7-GFP)
• Em vermelho: contorno da célula
• Barra de escala: 10 μm
A sigla "ScCDC" refere-se ao fungo usado nas experiências, Sc – Saccharomyces cerevisiae. As letras CDC significam "Cell Division Cycle" (Ciclo da Divisão Celular), e tornou-se um código para diversas proteínas detectadas nas investigações do grupo de Leland; a significância e a quantidade de novas descobertas deste trabalho renderam a este célebre cientista, juntamente com Paul Nurse e Tim Hunt, o Prêmio Nobel de Fisiologia em 2001. No caso especial de septinas humanas e de peixes, popularizou-se uma nova nomenclatura, com todas as letras maiúsculas: SEPT1, SEPT2, SEPT3, ..., SEPT14, e assim sucessivamente, conforme novas forem descobertas.[1]
As septinas se organizam em filamentos e também como um grande anel, cujo diâmetro diminui gradualmente, espremendo a célula. A mitose estará concluída quando o diâmetro do anel de septinas se tornar tão pequeno que cada célula filha possuirá sua própria membrana plasmática. Já não se fala mais em um citoplasma, mas dois, totalmente separados pela fronteira membranar recém-criada. Neste momento, as septinas se desorganizam, se desfazem e são digeridas. Os aminoácidos são reciclados.
Diversas outras funções foram associadas a septinas. Notava-se que, embora houvesse certa diversidade funcional delas, uma característica parecia estar sempre presente: em todas as observações, elas formavam complexos filamentares que impediam a mistura de conteúdos. Em outras palavras, elas participavam da criação de divisores de ambientes, membranas. É o caso da citocinese, da exocitose e da esporulação. Mais recentemente, septinas foram identificadas no tecido cerebral humano. O assunto é de crescente interesse na comunidade científica, já que septinas foram incluídas no grupo de proteínas que sofrem mutações em causa ou consequência de doenças neurodegenerativas, como Alzheimer e Parkinson, além de alguns tipos de câncer e infertilidade masculina.

O genoma humano indica a presença de pelo menos treze genes que codificam septinas. As proteínas produzidas por esses treze genes são agrupadas por homologia de sequência em quatro subgrupos, cada um denominado pela septina fundadora do grupo: (i) SEPT2 (SEPT1, SEPT4, SEPT5), (ii) SEPT3 (SEPT9, SEPT12), (iii) SEPT6 (SEPT8, SEPT10, SEPT11, SEPT14), e (iv) SEPT7. Grande maioria delas têm partes de suas estruturas cristalográficas depositadas no "PDB" e somente duas (SEPT10 e SEPT14) não possuem estrutura elucidada. Uma septina humana pode ser dividida em três regiões bem definidas: o N-terminal, o domínio ligador de GTP e o C-terminal (que contém sequências coiled coil). Membros do subgrupo SEPT6 são os únicos que não apresentam atividade GTPase. Apesar da maioria dos cristais obtidos sejam do domínio ligador de GTP, algumas estruturas dos domínios C-terminais também estão disponíveis.
A septina 2 forma homodímeros e foi estudada inicialmente por dois grupos de cientistas, usando difração de raios X. Na Universidade de Oklahoma, Estados Unidos, Wael M. Rabeh e colaboradores obtiveram resolução de 2,6 Å.[2] No Instituto Max Planck em Dortmund, Alemanha, Minhajuddin Sirajuddin et al. conseguiram resolução de 3,4 Å.[3] Estes últimos também apresentaram um heterotrímero formado pelas septinas 2, 6 e 7, com resolução de 4,0 Å,[4] conforme publicação da revista Nature[5].
Uma septina de subgrupos diferentes se juntam de forma organizada, criando um complexo linear simétrico. Esse complexo em humanos pode ser hetero-hexamérico (6 subunidades; uma septina de três subgrupos diferentes, com duas cópias cada) ou hetero-octamérico (8 subunidades; quando um membro do subgrupo SEPT3 é incluído) e é a estrutura básica na formação de filamentos. Mais recentemente foi corrigida a ordem das subunidades de septina: SEPT2-SEPT6-SEPT7-SEPT3-SEPT3-SEPT7-SEPT6-SEPT2[6] ou SEPT2-SEPT6-SEPT7-SEPT7-SEPT6-SEPT2[7] no caso de complexos hexaméricos (antes acreditava-se que a ordem seria SEPT7-SEPT6-SEPT2-SEPT2-SEPT6-SEPT7). Filamentos longos são então formados, através da polimerização ponta-a-ponta desses complexos hetero-oligoméricos.
No Brasil, há um grupo de pesquisa sobre septinas, sediado no Instituto de Física de São Carlos (USP). Os primeiros estudos foram conduzidos pelo Centro de Biotecnologia Molecular e Estrutural (CBME), um dos primeiros projetos de inovação e difusão criados pela FAPESP cujas atividades iniciaram em 2001. O grupo sãocarlense, coordenado pelo Prof. Dr. Richard Charles Garratt, elucidou a maioria das estruturas de septinas disponível até hoje, inclusive septinas de outros organismos como Schistosoma mansoni, Chlamydomonas reinhardtii e Drosophila melanogaster [8]. Recentemente, também no Instituto de Física de São Carlos, foram resolvidas as estruturas da região coiled coil da septina 4[9] e do domínio GTPase da septina 7[10], com resoluções de 1,35 e 1,74 Å, respectivamente. Estas são as melhores resoluções obtidas para septinas até hoje.
Referências
- ↑ Fangfang Pan, Russell L Malmberg, Michelle Momany, Analysis of septins across kingdoms reveals orthology and new motifs. BMC Evolutionary Biology. 7:103, 1 Jul 2007, pages 8 – 9, doi:10.1186/1471-2148-7-103.
- ↑ Rabeh, W.M., et al., Human septin 2 in complex with GDP.
- ↑ Sirajuddin, M., Wittinghofer, A., Crystal structure of Sept2 G-domain.
- ↑ Sirajuddin, M., Crystal structure of human septin trimer 2/6/7.
- ↑ .Sirajuddin M. et al., Structural insight into filament formation by mammalian septins. Nature. 449, 311 – 315. 18 Jul 2007, doi:10.1038/nature06052.
- ↑ Soroor, Forooz; Kim, Moshe S.; Palander, Oliva; Balachandran, Yadu; Collins, Richard; Benlekbir, Samir; Rubinstein, John; Trimble, William S. (7 de março de 2019). «Revised subunit order of mammalian septin complexes explains their in vitro polymerization properties». dx.doi.org. Consultado em 19 de março de 2021
- ↑ Mendonça, Deborah C.; Macedo, Joci N.; Guimarães, Samuel L.; Barroso da Silva, Fernando L.; Cassago, Alexandre; Garratt, Richard C.; Portugal, Rodrigo V.; Araujo, Ana P. U. (setembro de 2019). «A revised order of subunits in mammalian septin complexes». Cytoskeleton (9-10): 457–466. ISSN 1949-3584. doi:10.1002/cm.21569. Consultado em 19 de março de 2021
- ↑ Adriano de Freitas Fernandes, Diego Antonio Leonardo, Italo Augusto Cavini, Higor Vinícius Dias Rosa, Jhon Antoni Vargas, Humberto D'Muniz Pereira, Alessandro S Nascimento, Richard Charles Garratt (28 de dezembro de 2022). «Conservation and divergence of the G-interfaces of Drosophila melanogaster septins». Wiley Online Library. Cytoskeleton. Consultado em 14 de abril de 2023
- ↑ Leonardo, Diego A.; Cavini, Italo A.; Sala, Fernanda A.; Mendonça, Deborah C.; Rosa, Higor V.D.; Kumagai, Patricia S.; Crusca Jr, Edson; Valadares, Napoleão F.; Marques, Ivo A. (abril de 2021). «Orientational Ambiguity in Septin Coiled Coils and its Structural Basis». Journal of Molecular Biology (9). 166889 páginas. ISSN 0022-2836. doi:10.1016/j.jmb.2021.166889. Consultado em 19 de março de 2021
- ↑ Rosa, Higor Vinícius Dias; Leonardo, Diego Antonio; Brognara, Gabriel; Brandão-Neto, José; Pereira, Humberto D’Muniz; Araújo, Ana Paula Ulian; Garratt, Richard Charles (10 de julho de 2020). «Molecular recognition at septin interfaces: the switches hold the key». dx.doi.org. Consultado em 19 de março de 2021
Ligações externas
editar- Teses de pós-graduação na página da CAPES - Ministério da Educação. Busque pela palavra-chave "septina".
- Estudos estruturais e bioquímicos das septinas humanas bradeiona alfa e beta: moléculas relacionadas com o desenvolvimento de câncer do cólon, reto e melanoma maligno. Tese de doutorado de Wânius José Garcia da Silva. 01/06/2005.
- Novos transposons para construção de fusões com GFP em Candida albicans: Um estudo fenotípico e de localização da septina Cdc3. Tese de mestrado de Marcos Vinicios Salles Dias. 01/12/2006.
- Expressão e purificação da septina Cdc12 de Paracoccidioides brasiliensis em Escherichia coli. Mestrado de Thaila Fernanda dos Reis. 01/10/2007.