Hormônio liberador de gonadotrofina
Hormônio liberador de gonadotrofina (português brasileiro) ou hormona libertadora de gonadotrofina (português europeu) (também conhecido pela sigla GnRH, do inglês Gonadotropin-Releasing Hormone) é um hormônio peptídico liberado pelo hipotálamo que estimula a hipófise a liberar o hormônio folículo-estimulante de gonadotrofinas e hormônio luteinizante, que são necessários à gametogênese e a esteroidogênese de mamíferos.[1] O peptídeo pertence à família de hormônios liberadores de gonadotrofinas, e constitui o passo inicial no eixo hipotálamo-hipófise-gonadal.
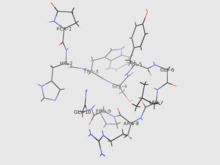
Estrutura
editarA identidade do GnRH foi esclarecida pelos vencedores do Nobel de 1977 Roger Guillemin e Andrew V. Schally:[2]
pyroGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2
Síntese
editarO gene, GNRH1, para o precursor de GnRH está localizado no cromossomo 8 e é expresso exclusivamente em uma população discreta de neurônios no hipotálamo. Nos mamíferos, o produto final do decapeptídeo linear é sintetizado a partir de um pré-hormônio de 92 aminoácidos no hipotálamo anterior pré-óptico.[3] É o alvo de vários mecanismos reguladores do eixo hipotálamo-hipófise-gonadal, como o efeito bimodal do estrogênio[4], com influência tanto inibitória quanto estimuladora na secreção de GnRH.
Função
editarOs terminais nervosos do GnRH envolvidos na regulação da função hipofisária anterior residem na eminência mediana, onde o GnRH é liberado na vasculatura do portal hipofisário.
De lá, ele é transportado para a glândula pituitária, que contém as células gonadotrópicas, onde o GnRH ativa seu próprio receptor, o receptor do hormônio liberador de gonadotropina (GnRHR), um receptor acoplado à proteína G de sete transmembranas, que estimula a ativação da fosfolipase C e a produção de inositol trifosfato, que resulta na mobilização do cálcio, na produção de diacilglicerol e na ativação da proteína quinase C.[5] Isso resulta na ativação de proteínas envolvidas na síntese e secreção das gonadotrofinas LH e FSH. O GnRH é degradado por proteólise em poucos minutos.
A atividade do GnRH é muito baixa durante a infância e é reativada no início da puberdade. Os pulsos de GnRH são fundamentais para o sucesso da função reprodutiva. No entanto, uma vez estabelecida a gravidez, a atividade de GnRH não é necessária. A atividade pulsátil pode ser interrompida pela doença hipotalâmica-hipofisária, seja por disfunção (ou seja, supressão hipotalâmica) ou lesões orgânicas (trauma, tumor). Níveis elevados de prolactina diminuem a atividade de GnRH. Por outro lado, a hiperinsulinemia aumenta a atividade do pulso, levando à atividade desordenada de LH e FSH, como observado na síndrome dos ovários policísticos. A formação de GnRH está ausente congenitamente na síndrome de Kallmann.
Controle de FSH e LH
editarO GnRH estimula a secreção hipofisária do hormônio luteinizante (LH) e do hormônio folículo-estimulante (FSH). Esses processos são controlados pelo tamanho e frequência dos pulsos de GnRH, bem como pelo feedback de andrógenos e estrógenos. Os pulsos de GnRH de baixa frequência são necessários para a liberação de FSH, enquanto os pulsos de GnRH de alta frequência estimulam os pulsos de LH de maneira individual.
Existem diferenças na secreção de GnRH entre mulheres e homens. Nos homens, o GnRH é secretado em pulsos a uma frequência constante; no entanto, nas mulheres, a frequência dos pulsos varia durante o ciclo menstrual, e há um grande aumento de GnRH imediatamente antes da ovulação.[6]
A secreção de GnRH é pulsátil em todos os vertebrados[7] e é necessária para a correta função reprodutiva. Assim, um único hormônio, GnRH1, controla um processo complexo de crescimento folicular, ovulação e manutenção do corpo lúteo na mulher e espermatogênese no homem.
Como um neurohormônio
editarO GnRH é considerado um neurohormônio, um hormônio produzido em uma célula neural específica e liberado em seu terminal neural. Uma área chave para a produção de GnRH é a área pré-óptica do hipotálamo, que contém a maioria dos neurônios secretores de GnRH. Os neurônios da GnRH se originam no nariz e migram para o cérebro, onde estão espalhados por todo o septo medial e hipotálamo e conectados por dendritos muito maiores >1 milímetro. Eles são agrupados para receberem entrada sináptica compartilhada, um processo que lhes permite sincronizar sua versão do GnRH.[8]
Os neurônios GnRH são regulados por muitos neurônios aferentes diferentes, usando vários transmissores diferentes (incluindo noradrenalina, GABA, glutamato).[9]
Referências
- ↑ Gilbert 2019, p. 829.
- ↑ «The Nobel Prize in Physiology or Medicine 1977». NobelPrize.org (em inglês). Consultado em 2 de agosto de 2020
- ↑ «GRIN - Genetics Basis of Gonadotropin-Releasing Hormone GnRH». www.grin.com (em inglês). Consultado em 2 de agosto de 2020
- ↑ Radovick, Sally; Levine, Jon E.; Wolfe, Andrew (9 de abril de 2012). «Estrogenic Regulation of the GnRH Neuron». Frontiers in Endocrinology. 3. ISSN 1664-2392. PMC 3356008 . PMID 22654870. doi:10.3389/fendo.2012.00052
- ↑ Millar, Robert P. (agosto de 2005). «GnRHs and GnRH receptors». Animal Reproduction Science. 88 (1-2): 5–28. ISSN 0378-4320. PMID 16140177. doi:10.1016/j.anireprosci.2005.05.032
- ↑ «Gonadotropin-releasing Hormone (GnRH) and the GnRH Receptor (GnRHR) | GLOWM». www.glowm.com (em inglês). Consultado em 2 de agosto de 2020
- ↑ Tsutsumi, Rie; Webster, Nicholas J.G. (2009). «GnRH Pulsatility, the Pituitary Response and Reproductive Dysfunction». Endocrine journal. 56 (6): 729–737. ISSN 0918-8959. PMC 4307809 . PMID 19609045
- ↑ Campbell, Rebecca E.; Gaidamaka, Galina; Han, Seong-Kyu; Herbison, Allan E. (30 de junho de 2009). «Dendro-dendritic bundling and shared synapses between gonadotropin-releasing hormone neurons». Proceedings of the National Academy of Sciences of the United States of America. 106 (26): 10835–10840. ISSN 0027-8424. PMC 2705602 . PMID 19541658. doi:10.1073/pnas.0903463106
- ↑ Plant, Tony M.; Barker‐Gibb, Mandi L. (1 de janeiro de 2004). «Neurobiological mechanisms of puberty in higher primates». Human Reproduction Update (em inglês). 10 (1): 67–77. ISSN 1355-4786. doi:10.1093/humupd/dmh001
Bibliografia
editar- Gilbert, Scott F.; Barresi, Michael J. F. (2019). Biologia do Desenvolvimento. São Paulo: Artmed