Síndrome do ovário policístico
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
A síndrome dos ovários policísticos (SOP), também conhecida como "síndrome de Stein-Leventhal", "doença cística do ovário", "anovulação crônica hiperandrogênica"[1] é uma patologia grave e crônica (e até o presente momento incurável), sendo a endocrinopatia mais comum em mulheres em idade reprodutiva[2][3][4]. Trata-se de uma das principais causas de subfertilidade feminina[5][6][7] e tem importante impacto na qualidade de vida das pacientes. As pacientes costumam apresentar hiperandrogenismo, amenorreia (ausência de menstruação) e ovários policísticos, mas não necessariamente todas essas condições, sendo ampla a variabilidade clínica[4].
| Síndrome do Ovário Policístico | |
|---|---|
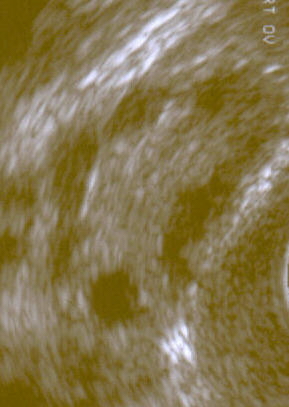
| Ultrassonografia de ovário policístico. | |
| Especialidade | endocrinologia, ginecologia |
| Classificação e recursos externos | |
| CID-10 | E28.2 |
| CID-9 | 256.4 |
| CID-11 | 1213633323 |
| OMIM | 184700 |
| MedlinePlus | 000369 |
| eMedicine | med/2173 ped/2155 radio/565 |
| MeSH | D011085 |
As causas da SOP ainda não são completamente compreendidas, mas certamente se trata de uma etiologia multifatorial, isto é, há fatores genéticos e ambientais que contribuem para o seu desenvolvimento[4].
A constatação, através de exame de ultrassom, de que os ovários apresentam múltiplos cistos, por si só, é insuficiente para caracterizar a ocorrência da síndrome, não sendo uma exigência absoluta para todas as definições conferidas à SOP.[8] Logo, a inexistência de cistos ovarianos não descaracteriza, necessariamente, a síndrome, podendo chegar-se ao diagnóstico de que determinada paciente sofre de SOP mediante outros critérios. Por isso, em janeiro de 2013, os Institutos Nacionais da Saúde dos EUA convocaram um painel independente para determinar se "síndrome dos ovários policísticos" seria o nome correto para designar tal distúrbio hormonal. Cientistas concluíram que o nome atual, que incide sobre um critério - cistos ovarianos - causa confusão e é uma barreira para obter-se progresso e atenção efetiva em prol da paciente.[9]
Mulheres com SOP têm maior risco de obesidade - em particular o fenótipo visceral -, dislipidemia, resistência insulínica, diabetes mellitus tipo 2, além de síndrome metabólica e complicações cardiovasculares[2][10][11]. É comum as mulheres apresentarem anovulação e excesso de hormônios andrógenos. A anovulação resulta em menstruação irregular, amenorreia ou oligomenorreia e infertilidade. O desequilíbrio hormonal tende a provocar acne e hirsutismo. A resistência à insulina está associada com obesidade, diabetes do tipo 2 e níveis elevados de colesterol[12].
Etiologia
editarA SOP é um distúrbio heterogêneo de etiologia incerta[13][14], mas certamente se trata de uma etiologia multifatorial, isto é, há fatores genéticos e ambientais que contribuem para o desenvolvimento. A recorrência na mesma família, sobretudo quando há parentes em primeiro grau, além de estudos de GWAS (Genome Wide Association Studies) que apontaram uma série de genes candidatos nos quais algumas variantes aumentam a propensão à SOP, reforçam a contribuição de fatores genéticos na etiologia da SOP. Está claro também que os fatores ambientais, como o sobrepeso e obesidade, têm grande importância no desenvolvimento da SOP[15].
Apesar das lacunas que existem no entendimento da patogênese da SOP, são bem descritas várias anormalidades bioquímicas associadas e é provável que a inflamação tenha uma importante participação na promoção desses desbalanços[15][16]. Entre as alterações metabólicas da SOP, destacam-se: resistência insulínica com hiperinsulinemia compensatória, maior distribuição visceral de tecido adiposo e alterações de perfil lipídico. Também há alterações de hemostasia e de status oxidativo[15].
Causas relacionadas a desordens endócrinas
editarPessoas com a síndrome do ovário policístico (SOP) produzem GnRH em excesso, e este, por sua vez, acaba estimulando de maneira exagerada a hipófise anterior, levando à produção demasiada do hormônio luteinizante (LH) em proporção superior à do Hormônio Folículo Estimulante (FSH).[17] Este aumento do hormônio luteinizante seria o estimulador da superprodução de andrógenos, fato que se agrega à produção exagerada de androgênios pelos ovários.[18]
A gravidade clínica dos sintomas da SOP parece ser em grande parte determinada por fatores como a obesidade e/ou tendência para o aumento de peso. Entretanto, pesquisas sugerem que aproximadamente metade das pessoas com SOP podem apresentar peso normal ou até mesmo estar abaixo do peso.[19][20]
Eis alguns fatores importantes, segundo as "Diretrizes da Sociedade Brasileira de Reprodução Humana", para o desencadeamento da SOP[21]:
- Hiperativação do sistema relacionado ao estresse e à maior liberação hipotalâmica do hormônio liberador de corticotrofina (CRH);
- Diminuição do tono dopaminérgico hipotalâmico;
- Maior frequência dos pulsos do hormônio liberador de gonadotrofinas (GnRH);
- Resistência à insulina, com hiperinsulinismo;
- Hipersensibilidade das células ovarianas às gonadotrofinas;
- Ação local ovariana anormal dos moduladores (amplificadores e atenuadores) das gonadotrofinas nas células teca e granulosa;
- Moléculas anormais do hormônio luteinizante (LH), com maior atividade biológica;
- Presença de receptor anormalmente sensível ao LH;
- Transmissão genética, poligênica.
Causas Genéticas
editarNa atualidade, evidências apontam que o cerne da SOP possui raízes genéticas. Tal evidência inclui a agregação familiar de casos, maior concordância entre gêmeos monozigóticos (ou univitelinos) do que em gêmeos dizigóticos (ou bivitelinos) e, ainda, herdabilidade das características endócrinas e metabólicas associadas à SOP.[13][22]
O componente genético parece ser herdado de uma forma autossômica dominante com alta penetrância genética, conquanto possua alta variabilidade entre as pessoas. Cada criança, assim sendo, possui uma chance de cerca de 50% de herdar a variante genética predisponente(s) a partir de um dos pais, e, se uma filha receber tal variante(s), poderá vir a desenvolver, até certo nível, a doença.[13][23][24][25] A(s) variante(s) genética(s) pode(m) ser herdada(s) tanto do pai quanto da mãe, e pode(m) ser passada(s) tanto para os filhos (os quais podem ser portadores assintomáticos ou podem ter sintomas como calvície precoce e/ou excesso de cabelo) quanto para as filhas, as quais poderão desenvolver a síndrome.[23][25] Os alelos parecem manifestar-se, nas mulheres, pelo menos parcialmente, através de elevados níveis de androgênios secretados pelas células de teca dos folículos ovarianos.[24] O gene exato afetado ainda não foi identificado.[13][22][26]
Dois estudos recentes apontam a associação entre o gene DENND1A e a Síndrome do Ovário Policístico (SOP): O estudo "Overexpression of a DENND1A isoform produces a polycystic ovary syndrome theca phenotype" verificou que uma variante de um gene ativo em células do ovário (DENND1A.V2) pode levar ao excesso de produção de hormônios androgênicos semelhantes à testosterona. Em suma, em pessoas com SOP, as células da teca produzem uma quantidade muito maior de hormônios masculinos, sendo esta uma característica típica da SOP.[27] Enquanto que, no estudo "Genetics of polycystic ovary syndrome", estudos de replicação têm demonstrado que as variantes em vários desses locis também conferem risco - para a SOP - em pessoas de etnia europeia. Os locis mais fortes nos europeus contêm genes para DENND1A e THADA, com associações adicionais em locis contendo o LHCGR e FSHR, YAP1 e RAB5/SUOX. Os próximos passos para a descoberta da fisiopatologia corroborada por estes locis e variantes incluem mapeamento para determinar a variante do gene causal, estudos de fenótipo para determinar se essas regiões estão associadas às características particulares da SOP e estudos funcionais da variante causal para determinar a causa direta da SOP baseado na genética subjacente. Tal pesquisa assinala que os próximos anos serão tempos muito emocionantes na medida em que grupos de todo o mundo cada vez mais se reúnem para elucidar as origens genéticas da SOP.[28]
Disruptores endócrinos industriais
editarSegundo o artigo "Industrial endocrine disruptors and polycystic ovary syndrome", pesquisas científicas recentes acerca das raízes geradoras da síndrome tornaram cada vez mais evidente o papel do meio ambiente como um fator determinante. Atualmente, a exposição experimental de disruptores endócrinos industriais têm sido relacionada ao comprometimento da função reprodutiva normal e regulação metabólica, favorecendo, possivelmente, o desenvolvimento ou agravando os distúrbios clínicos inter-relacionados à SOP. Produtos químicos industriais podem refletir o papel contribuitivo de um meio ambiente desfavorável e capaz de revelar características da SOP em indivíduos geneticamente predispostos, podendo, ainda, agravar os desequilíbrios hormonais e a infertilidade das fêmeas já afetadas pela SOP.[29]
A listagem dos disruptores endócrinos é altamente heterogênea e inclui produtos químicos sintéticos utilizados como solventes / lubrificantes industriais e seus subprodutos: bifenilos policlorados (PCB), bifenilos polibromados (PBB), dioxinas], pesticidas e herbicidas (como diclorodifenil tricloroetano (DDT) ou dos seus metabolitos, metoxicloro (MXC)) , fungicidas (vinclozolina), estabilizadores de calor e catalisadores químicos (como o tributil-estanho), plástico (por exemplo, contaminantes Bisfenol A (BPA) e plastificantes (ftalatos) ou componentes farmacêuticos (ou seja, dietilestilbestrol; 17α-etinilestradiol).[29]
Os disruptores endócrinos podem agravar ou contribuir para o desequilíbrio hormonal característico da SOP, dada sua capacidade de interferir na produção, liberação, transporte, metabolismo, ligação, ação ou eliminação de hormônios naturais do corpo responsáveis pela manutenção da homeostase, reprodução, desenvolvimento e/ou comportamento. Essa interação pode envolver tanto a função reprodutiva quanto metabólica da síndrome, favorecendo seu aparecimento clínico em indivíduos predispostos, inclusive em fases sensíveis da vida (especialmente a fase fetal).[29] Refletindo a influência nociva do ambiente moderno, o Bisfenol A está emergindo como um jogador-chave na patogênese da SOP, presumivelmente via interação bidirecional com andrógenos. O meio ambiente e, em particular, desreguladores endócrinos, podem ser a peça que faltava para resolver o "quebra-cabeça" da patogênese da SOP.[29]
Relação entre Bisfenol A (BPA) e a SOP
editarO principal malefício do plástico fabricado com Bisfenol A é o aumento da circulação, no sangue humano, de um produto químico bioidêntico ao hormônio feminino. O desequilíbrio hormonal gerado pela contaminação com Bisfenol A afeta pessoas independentemente do sexo, ocasionando profundas alterações na saúde hormonal, reprodutiva e comportamental de todos os sexos. Nas pessoas atribuidas como do sexo feminino ao nascer, o Bisfenol parece desregular a produção do hormônio liberador de gonadotropinas (GnRH) - note-se que ao nível da glândula pituitária (hipófise), produtos químicos industriais (incluindo-se o BPA), por si só, foram capazes de perturbar a liberação de gonadotrofinas.[29] Tais distúrbios encontram-se na raiz da SOP, pois a produção exarcebada do GnRH desequilibra a produção do hormônio luteinizante em proporção superior à do Hormônio Folículo Estimulante (FSH).[29] Este aumento do hormônio luteinizante seria o estimulador da superprodução de andrógenos, fato que se agrega à produção exagerada de androgênios pelos ovários.[18]
O estudo "Bisphenol A (BPA) and its potential role in the pathogenesis of the polycystic ovary syndrome (PCOS)" confirmou assertivas de pesquisas anteriores acerca do potencial papel do Bisfenol A (BPA) no desenvolvimento da Síndrome do Ovário Policístico (SOP). Observações recentes demonstraram níveis mais elevados de BPA em fluídos biológicos de pessoas com SOP e seu papel na patogênese da hiperandrogenismo e hiperinsulinemia. Ao que tudo indica, a exposição da mãe ao BPA durante a gravidez também pode levar ao desenvolvimento da SOP na prole feminina.[30]
O estudo "Endocrine Disruptors and Polycystic Ovary Syndrome (PCOS): Elevated Serum Levels of Bisphenol A in Women with PCOS" encontrou níveis maiores de BPA em pessoas com SOP e uma associação estatisticamente positiva e significativa entre andrógenos e o Bisfenol (BPA), fatores estes que apontam para o fato de que o BPA possui um potencial e relevante papel, por ser um disruptor endócrino, na fisiopatologia da SOP.[31]
O artigo "Industrial endocrine disruptors and polycystic ovary syndrome" revelou que o eixo hipotálamo-hipofisário é castigado pelo Bisfenol A (BPA), pois este desregula a produção do hormônio liberador de gonadotropinas (GnRH). Ao nível da glândula pituitária (hipófise), produtos químicos industriais (incluindo-se o BPA), por si só, foram capazes de perturbar a liberação de gonadotrofinas.[29]
Várias pesquisas recentes indicaram que o Bisfenol é considerado um disruptor endócrino capaz de ser transmitido pela mãe a sua prole de forma epigenética.[30]
A maioria dos estudos sobre os efeitos na saúde do BPA se concentraram na desregulação endócrina levando a toxicidade reprodutiva, mas tal produto apresenta efeitos colaterais adicionais, incluindo danos ao fígado, interrupção da função pancreática de células-β, perturbações hormonais na tireóide e promoção da obesidade.[32]
Observe-se que pessoas adultas já acometidas e/ou diagnosticadas com a síndrome do ovário policístico (SOP) podem sofrer um agravamento da sintomatologia típica da síndrome acaso entrem em contato com disruptores endócrinos como o Bisfenol A (BPA).[29]
O estudo "Impact of early-life bisphenol A exposure on behavior and executive function in children" sugere que o bisfenol A pode comprometer o comportamento, inclusive sexual, de garotas: a exposição ao BPA durante a fase gestacional afetou a regulação nos domínios comportamentais e emocionais, especialmente entre as meninas. Os médicos podem aconselhar os pacientes em questão para reduzir a sua exposição a certos produtos de consumo, mas os benefícios de tais reduções não são claras. A exposição ao Bisfenol A (BPA) durante a fase gestacional pode afetar processos endócrinos ou de outros neurotransmissores e perturbar a diferenciação sexual do cérebro, alterando o comportamento de uma maneira dependente do gênero sexual.[33]
O estudo "Sex Specific Estrogen Receptor beta (ERβ) mRNA Expression in the Rat Hypothalamus and Amygdala is Altered by Neonatal Bisphenol A (BPA) Exposure" esclareceu que a "vida perinatal é uma janela crítica para a organização cerebral do dimorfismo sexual, e é profundamente influenciada por hormônios esteróides." A exposição a compostos de disruptores endócrinos pode interromper este processo, resultando em uma fisiologia reprodutiva e comportamental comprometidas. Em outras palavras, a região e a expressão sexo-específica (RpE) é vulnerável, no período neonatal, a uma exposição ao bisfenol A (BPA), especialmente em regiões do cérebro de ratos em desenvolvimento que são críticas para o comportamento sociossexual.[34]
Excesso de andrógenos (em especial o Bisfenol) durante a gestação do feto feminino
editarUm estudo denominado Androgen excess fetal programming of female reproduction: a developmental aetiology for polycystic ovary syndrome?" (em português: "O excesso de programação androgênica fetal na reprodução feminina: a etiologia de desenvolvimento para a síndrome do ovário policístico?"), após experimentos em macacas do tipo rhesus, demonstrou a possibilidade de fetos femininos submetidos a substâncias andróginas em excesso (especialmente as que provocam a masculinização) desenvolverem, após o nascimento e desenvolvimento, a síndrome do ovário policístico (SOP).[35]
Vários outros estudos científicos, alguns até mais recentes e usando até mesmo outros modelos animais, parecem ter chegado à mesma conclusão. Eis alguns deles:
- Bisphenol A (BPA) and its potential role in the pathogenesis of the polycystic ovary syndrome (PCOS)" [30] (em português: O bisfenol A e seu potencial papel na patogênese da síndrome do ovário policístico).
- Fetal Programming of Polycystic Ovary Syndrome by Androgen Excess: Evidence from Experimental, Clinical, and Genetic Association Studies[36] (em português: Programação Fetal da Síndrome dos Ovários Policísticos por excesso de andrógenos: evidências experimentais, clínicas e estudos associados de genética);
- Developmental Programming of Polycystic Ovary Syndrome: Role of Prenatal Androgen Excess[37] (em português: "Programação do Desenvolvimento da Síndrome dos Ovários Policísticos: Papel do Excesso de Andrógenos no período pré-natal);
- Androgen Excess Disorders in Women: Polycystic Ovary Syndrome and Other Disorders[38] (em português: Distúrbios de excesso de andrógenos em mulheres: Síndrome dos Ovários Policísticos e outros distúrbios).
- Polycystic ovary syndrome: do endocrine-disrupting chemicals play a role?[39] (em português: Síndrome do ovário policístico: os desreguladores endócrinos desempenham algum papel?).
- Bisphenol A and human health: a review of the literature[40] (em português: Bisfenol A e a saúde humana: uma revisão da literatura).
- Bisphenol A in polycystic ovary syndrome and its association with liver-spleen axis[41] (em português: Bisfenol A na síndrome do ovário policístico e sua associação com eixo fígado-baço).
- Phenotypes and enviromental factors: their influence in PCOS[42] (em português: Fenótipos e fatores Ambientais: sua influência na SOP).
- Endocrine-Disrupting Chemicals: Some Actions of POPs on Female Reproduction[43] (em português: Disruptores Endócrinos Químicos: Algumas ações de poluentes orgânicos persistentes (POPs) na reprodução feminina).
Logo, parece claro que o feto feminino contaminado por Bisfenol A (dentre outros disruptores endócrinos industriais) acaba tornando-se predisposto ao desenvolvimento futuro da Síndrome do Ovário Policístico (SOP).
Supõe-se, também, que além do Bisfenol A outras substâncias andrógenas e progestágenas usadas durante a gravidez (naturais ou sintéticas) podem levar à masculinização do feto feminino,[44] devendo, por isso, ser inseridas no escopo de investigação dos estudos acima mencionados.
Seguindo esta linha de raciocínio, percebe-se que alguns fármacos também estão implicados, eis que muitos deles, sabidamente, possuem notáveis efeitos androgênicos durante a gestação, podendo levar, inclusive, à masculinização do feto feminino. Eis alguns exemplos[44]:
- Valproato (também conhecido como Depakote e/ou Depakene). Supõe-se que certos medicamentos possam ter papel importante (ou até mesmo ser a causa) na eclosão da Síndrome do Ovário Policístico (SOP). É o caso, por exemplo, de pessoas submetidas ao tratamento com Valproato (também conhecido como Depakote e/ou Depakene, um medicamento anticonvulsivo usado para tratamento de transtorno bipolar e epilepsia) durante seus anos pré-púberes.[45][46] Alguns estudos vão além e sugerem que remédios antiepilépticos em geral, assim como para tratamento para o transtorno bipolar, poderiam ser uma das causas da SOP. De uma forma ou de outra, evidências científicas sugerem que o Valproato acarretaria o aumento dos níveis de testosterona e provocaria o aumento de peso (e resistência à insulina).[47][48] Uma meta-análise realizada em 2011 pelos cientistas Hu X , Wang J , Dong W , Fang Q , Hu L , Liu C, publicado na renomada revista Epilepsy Research, parece ter comprovado a interligação entre a SOP e o Valproato (ou Depakote).[49]
- O Noretindrona (contraceptivo oral e/ou pílula anticoncepcional). Estudos demonstram que o uso deste fármaco anticoncepcional pode causar a masculinização do feto feminino,[50][51]
- A Oxandrolona (também conhecido como Anavar), é utilizado para síndromes catabólicas; pacientes acamados por várias semanas e queimaduras, restaurando assim os tecidos musculares. É administrado oralmente e seus efeitos são devidos à ligação ao receptor de testosterona. O receptor de testosterona induz ações em nívelcelular de diversas maneiras, com ações anabolizantes, androgênicas dentre outras. É também utilizada, sem a devida indicação médica, para atividades de musculação;
- A Dietilestilbestrol (um estrógeno sintético não esteróide). Se usado durante a gravidez, pode acarretar, conforme consta no Manual Merck Saúde para a família, câncer de vagina em meninas adolescentes cujas mães fizeram uso desta droga durante a gestação. Posteriormente, essas meninas podem apresentar uma cavidade uterina anormal, distúrbios menstruais, um colo do útero incompetente (o qual pode causar abortos espontâneos) e um aumento do risco de gravidez ectópica, de gerar um natimorto e de morte neonatal;[52]
- O Danazol (também conhecido como Ladogal), é utilizado no tratamento de endometriose e doença fibrocística de mama e como profilático no angioedema de origem hereditária da laringe, abdome e cutâneo).[53][54] Trata-se de um derivado da etisterona, um esteróide sintético onde seu mecanismo de ação é impedir a liberação das gonadotrofinase no foco dos receptores de esteroides gonadais em órgãos alvo. Note-se, a propósito, que os dois principais tipos de gonadotrofinas são justamente o hormônio luteinizante (LH) e o hormônio estimulador do folículo (FSH), os quais exercem papel importante na manifestação da SOP;
- outras substâncias e/ou situação raras associadas que possam levar ao pseudo-hermafroditismo feminino (especialmente quando associada à virilização materna durante a gestação).[55]
Alterações transgeracionais epigenéticas relacionadas à SOP
editarEm "Epigenetic transgenerational actions of endocrine disruptors and male fertility", atestou-se a capacidade de um fator ambiental (por exemplo, disruptores endócrinos) de reprogramar a linha germinal e promover um estado de doença transgeracional, com significativas implicações para a biologia evolutiva e etiologia da doença.[56]
Outro estudo, denominado "Epigenetic Mechanism Underlying the Development of Polycystic Ovary Syndrome (PCOS)-Like Phenotypes in Prenatally Androgenized Rhesus Monkeys", após observar macacas rhesus concluiu que a androgenização pré-natal do feto feminino pode modificar os padrões de metilação do DNA, especialmente no que diz respeito a tecidos adiposos viscerais tanto infantis quanto adultos. Este estudo piloto sugere que o excesso de exposição ao andrógeno fetal em primatas não humanos femininos podem predispor a SOP via alteração do epigenoma, proporcionando uma nova avenida para entender a SOP em seres humanos.[57]
A obra "Polycystic Ovary Syndrome: Current and Emerging Concepts" condensou o conhecimento a respeito do tema e lançou-lhe novas luzes. O livro diz que a origem fetal da síndrome do ovário policístico tem sido cada vez mais pesquisada e observada em inúmeros modelos animais. De fato, fetos femininos de diversos mamíferos têm sido induzidos, em especial macacos do tipo rhesus, ratos, camundongos, ovelhas, dentre outros, a desenvolver a síndrome caso expostos a quantidade excessivas de andróginos, inclusive de forma transgeracional.[58]
Sugere-se, assim, que não somente fármacos, mas especialmente disruptores endócrinos industriais[29][59][60][61] - resultantes da poluição ambiental típica da era pós-industrial (e igualmente alimentos industrializados) possam também ser fatores de predisposição (e/ou disruptores endócrinos) capazes de levar ao desenvolvimento da SOP, notadamente de forma transgeracional (e/ou epigenética).
Anticoncepcionais
editarAlém do noretindrona (contraceptivo oral e/ou pílula anticoncepcional),[50][51] cujo uso pode levar à masculinização do feto feminino e ao futuro desenvolvimento da SOP, o estudo "Cycle characteristics after discontinuation of oral contraceptives" indica que os distúrbios cíclicos após a interrupção de contraceptivos orais seriam reversíveis, mas o tempo de regeneração poderia alcançar até 9 meses (significativo) ou até mesmo mais (não significativo).[62] Tais resultados servem para aconselhar casais que desejam engravidar após a interrupção do uso de pílulas anticoncepcionais ou que desejam continuar a contracepção com métodos alternativos.[62]
Sinais e Sintomas
editarAlguns dos possíveis sintomas e/ou sinais, conquanto variem de paciente para paciente, são:[63]
- Perturbações menstruais: a SOP produz, principalmente, oligomenorreia (poucos períodos menstruais) ou amenorreia(ausência de ciclos menstruais). Outros tipos de distúrbios menstruais, contudo, também poderão vir a ser observados.[64][14] Em suma, a síndrome pode causar períodos menstruais infrequentes, ausentes e/ou irregulares;[65]
- Altos níveis de hormônios masculinizantes (excesso de andrógeno, em especial a testosterona): os sinais mais comuns desta condição são a acne e o hirsutismo(padrão masculino de crescimento do cabelo), mas a síndrome também pode produzir hipermenorreia (períodos menstruais muito frequentes), alopécia androgênica(aumento do afinamento capilar ou perda difusa de cabelo), dentre outros sintomas.[64][66] Cerca de 3/4 dos pacientes com SOP (de acordo com critérios de diagnóstico de NIH/NICHD 1990) apresentam evidências de hiperandrogenemia;[67][68]
- Infertilidade:[14] dificuldade para engravidar, dada a ausência ou dificuldade de ovulação. A infertilidade, em geral, resulta, diretamente, da anovulação crônica (falta de ovulação).[64] A SOP, não por outro motivo, é considerada a causa mais comum de infertilidade feminina;[65]
- Síndrome metabólica assinalada pela resistência à insulina:[14] esta sintomatologia aparece como uma tendência à obesidade central e outros sintomas associados à resistência à insulina.[64] A insulina sérica, a resistência à insulina e os níveis de homocisteína são, igualmente, mais elevados em pessoas portadoras da SOP.[70] É interessante observar que a resistência à insulina pode causar, na paciente com SOP, envelhecimento precoce (especialmente da pele);[71]
- Manchas de pele no pescoço, braços, seios ou coxas, as quais podem ser marrom escuras ou pretas;[65]
- Marcas na pele - retalhos de excesso de pele nas axilas ou na área do pescoço;[65]
Patologias e alterações Associadas
editarA SOP, frequentemente, está associada com:[63]
- Diabetes;
- Hipertensão arterial;
- Ataque cardíaco: arteriosclerose, pressão alta e colesterol alto, sintomatologia típica da SOP, aumentam o risco de ataque cardíaco;[72]
- Obesidade ou facilidade para engordar (inclusive em torno da cintura, isto é, gordura visceral).[65] Contudo, estudos sugerem que metade das pessoas com SOP tenham peso normal ou até mesmo estejam abaixo do peso recomendável;[20]
- Fadiga no período vespertino (pela parte da tarde);[73]
- Colesterol elevado;
- Dor pélvica;[65]
- Psoríase: Pacientes com psoríase têm um risco maior de apresentar, concomitantemente, a síndrome do ovário policístico, segundo um importante estudo divulgado em 2012;[74]
- Câncer de endométrio (tumor localizado na parede interna do útero): este tipo de câncer é 3 vezes mais frequente em pessoas com SOP do que em pessoas sem a referida síndrome;[75]
- Câncer de Mama e Câncer de Ovário: alguns estudos sugerem que a Síndrome do Ovário Policístico também pode estar relacionada e/ou favorecer o surgimento de câncer de mama, assim como câncer de ovário.[76] Considerando-se a plausibilidade da associação entre SOP e tais canceres, faz-se imperativo que todas as pessoas com SOP mantenham-se vigilantes no acompanhamento e cuidado destes tipos de carcinoma. Vale destacar que em um estudo com 217 mulheres, a proporção de mulheres com história familiar positiva para câncer de mama foi significativamente maior em mulheres com SOP.[77]
- Aumento do risco de diabetes gestacional (diabetes durante a gravidez), hipertensão arterial induzida pela gravidez e parto prematuro;[69]
- Derrames;[78]
- Aborto Espontâneo;[79][80]
- Deslipidemia;[14]
- Doença hepática gordurosa não-alcoólica (DHGNA);[14]
- Tireoidite de Hashimoto (ou tireoidite auto-imune);[81]
- Epilepsia;[47][48][49]
- inflamações crônicas:[14][82] vários investigadores chegaram a correlacionar mediadores químicos inflamatórios com anovulação e outros sintomas típicos da síndrome.[83][84] Da mesma forma, parece haver uma relação entre a SOP e o aumento do nível de estresse oxidativo (responsável, inclusive, pelo envelhecimento precoce da pele).[85]
- Acromegalia: a SOP é relativamente comum em pessoas com acromegalia (que causa, por exemplo, crescimento excessivo do queixo - mandíbula-, do nariz, lábios e perda espontânea de dentes), e pode ser responsável por alguns dos sintomas relacionados com a disfunção gonadal, independentemente do tamanho do tumor pituitário. É provável que somente o IGF-1, ou em combinação com a GH e/ou a resistência à insulina possa estar envolvido.[86]
Manifestações Psiquiátricas Associadas
editarAs manifestações psiquiátricas correlacionadas à SOP são variadas. É recomendável que pacientes com SOP estejam atentas à sintomatologia psiquiátrica causada e/ou agravada pela síndrome. Muitas vezes, por exemplo, um quadro depressivo, de grande ansiedade, TOC, etc, precisa ser avaliado em conjunto com a manifestação clínica da SOP, até mesmo para que se aponte o tratamento psiquiátrico mais adequado possível.
Eis, abaixo, algumas manifestações psiquiátricas com as quais a SOP pode se fazer acompanhar:
- Depressão[65][87][88]: a depressão é mais comum e mais grave em pessoas com SOP do que naquelas sem SOP. Tal característica foi demonstrada, desde há várias décadas, em vários estudos. Supõe-se que a depressão possa ser causada pelo perfil hormonal anormal; também parece haver uma ligação entre a satisfação corporal (que é afetada em função da SOP) e a depressão;[88]
- Ansiedade (ou Transtorno Fóbico-Ansioso): sentimentos de preocupação ou desconforto são ligeiramente mais comuns em pessoas com SOP do que naquelas sem SOP. Ainda não está claro se este sintoma estaria associado, principalmente, com as mudanças hormonais associadas à SOP ou, tão-somente, com a pressão social causada pelos sinais externados pela SOP;[87][88]
- Fobia social (ou Isolamento Social ou aversão aos valores sociais supostamente "normais" e busca por padrões "hipoteticamente alternativos" de vida);[87][89]
- Aumento da suscetibilidade nas relações interpessoais;[90]
- Comportamento neurótico (associado à dificuldade de lidar com o estress);[91]
- Pensamentos paranóicos;[90]
- Hostilidade e agressividade: estudos apontam que pessoas afetadas pela SOP seriam significativamente mais propensas a reter sentimentos de raiva;[91]
- Tendências suicidas: pesquisas demonstraram que as tentativas de suicídio foram sete vezes mais comum no grupo de pessoas com SOP;[87][89]
- Mudanças de humor: pessoas com SOP frequentemente relatam mudanças significativas de humor sem uma causa óbvia (algumas vezes alternando picos de alegria com picos de tristeza). Tal fato pode estar ligado a alterações dramáticas no nível de açúcar no sangue e aos diversos desequilíbrios hormonais que muitas vezes acompanham a SOP;[88]
- Apneia do sono e insônia: estudos sugerem que pessoas portadoras da SOP apresentam distúrbios do sono, especialmente apneia do sono e insônia. As perturbações do sono são um dos efeitos mais frustrantes e exasperantes desta condição, e podem estar relacionadas com a resistência à insulina e/ou intolerância à glicose ;[65][92][93][94]
- Disforia de género: referida condição caraterizada nas pessoas atribuidas como do sexo feminino ao nascer. Várias pesquisas recentes demonstraram que a disforia de género é frequentemente observada (em maior ou menor grau) nas pessoas acometidas pela Síndrome do Ovário Policístico (SOP).[95][96][97][98][99]
Manifestações associadas à Virilização (ou "masculinização") de pessoas atribuidas como do sexo feminino ao nascer
editarA SOP pode levar ao desenvolvimento de características masculinas, ou seja, virilização (dada a presença de andróginos em excesso no organismo feminino, mais especificamente da testosterona). Eis algumas das manifestações virilizantes que podem vir a ser observadas[63][88]:
- Voz mais profunda e/ou grave (engrossamento da voz);
- Maior quantidade de pelos (hirsutismo);
- Aumento do clítoris (ou "hipertrofia clitoriana" e/ou "clitoromegalia"). A má-formação congênita (que pode impedir o acesso ao clitóris) e a hipertrofia dos pequenos lábios (que pode encobrir o acesso à vagina),[100] pode levar à anorgasmia (que vem a ser a dificuldade da mulher alcança orgasmos; algumas pesquisas sugerem, entretanto, que pessoas com hipertrofia clitoriana alcançam mais facilmente o orgasmo clitoriano do que o vaginal). Estudos demonstram que o uso de Noretindrona (contraceptivo oral e/ou pílula anticoncepcional) durante a gravidez pode causar a masculinização do feto,[50][51] resultando, dentre outros sintomas, na hipertrofia do clitóris;
- ombros largos;
- Afinamento dos cabelos existentes no couro cabeludo;
- Calvície (ainda que suave) de padrão masculino (especialmente nas regiões fronto-temporais da cabeça, isto é, nas chamadas "entradas") ou cabelos ralos,[65] raramente chegando à calvície total;
- Aumento da libido (considerando-se, em especial, a maior circulação sanguínea de testosterona). Todavia, muitas pesquisas sugerem que pacientes com SOP também podem padecer de falta de interesse sexual por longos períodos;[102]
- Queixo mais proeminente: cabe mencionar, porque se trata de tópico interrelacionado à virilização, que pesquisadores de quatro universidades nos EUA e Canadá divulgaram uma pesquisa, publicada na revista científica "Personality And Individual Differences", intitulado The association between men’s ratings of women as desirable long-term mates and individual differences in women’s sexual attitudes and behaviors, segundo a qual pessoas com queixo mais proeminente (o que é normalmente causado por altos níveis de hormônio masculino testosterona) seriam mais sexualmente ativas do que aquelas com queixos mais suaves. Não somente isso, mas a pesquisa também demonstrou que a aparência facial mais masculina (inclusive o queixo mais proeminente) nas pessoas possa conduzir sua falta de restrição sexual, associando-as a um maior número de parceiros sexuais e, ainda, prejudicando, talvez, sua qualidade como parceira de longo prazo.[103][104] Assim, pessoas com queixos mais proeminentes (ou largos) seriam mais propensas a trair seus parceiros.
- Pescoço com circunferência maior[105]: conforme publicado no artigo Neck circumference a good predictor of raised insulin and free androgen index in obese premenopausal women: changes with weight loss (em português A circunferência do pescoço: um bom preditor de insulina elevada e índice de andrógeno livre em mulheres pré-menopáusicas obesas: mudanças com a perda de peso), A circunferência do pescoço e idade mais jovem foram preditores independentes de maior índice de andrógeno livre (FAI) (r2 = 0,36 combinado). Se a circunferência do pescoço não estiver incluída, então a idade mais jovem, maior índice de massa corporal e elevados níveis de insulina em jejum mostraram-se como preditores independentes de FAI (r2 = 0,29). A relação cintura/quadril não mostrou valor preditivo (r = 0,14). A circunferência do pescoço também foi um bom preditor clínico de irregularidade menstrual, hirsutismo, infertilidade, resistência à insulina e SOP. A circunferência do pescoço de menos de 39, 39-42 e maior que 42 centímetros reflete um baixo, intermediário e alto risco de síndromes metabólicas e SOP em pessoas pré-menopáusicas obesas. Para 42 pacientes que foram acompanhadas por um ano após a cirurgia, a perda de peso foi associada a redução da FAI, menor resistência à insulina e melhorou a regularidade menstrual e resolução da SOP em 11 dos 12 casos. Em conclusão, a circunferência do pescoço é uma boa medida preditiva de hiperinsulinemia e andrógenos em pessoas pré-menopáusicas obesas. Após a cirurgia de perda de peso, a função ovariana e risco vasculopático apresentaram melhora.[105]
Sintomatologia em pessoas com peso normal ou abaixo do peso normal
editarO senso comum aponta no sentido de que pessoas com sobrepeso teriam mais chances de desenvolver a SOP ou, até mesmo, representariam o maior grupo de pessoas diagnosticadas com a síndrome. Contudo, estudos demonstram que, na realidade, pessoas com massa magra também formam um conjunto significativo, chegando a representar até 50% do número total de pacientes diagnosticadas.[20][106][107]
Tais pessoas (com massa magra porém acometidas pela SOP), por sua vez, parecem ter sintomatologia ligeiramente diferente das pacientes com sobrepeso (e igualmente afetadas pela SOP). Isto porque as pessoas com massa magra apresentam um excesso relativo de testosterona, onde a própria testosterona não é muito alta, mas parece ser elevada em relação aos níveis de estrogênio. Nestes casos, as pessoas muitas vezes não têm o crescimento de pelos em excesso, tendem a ter um corpo atlético e magro, tem uma grande energia sexual e muitas vezes possuem experiências crônicas (e anteriores) de estresse. Nestes casos, é importante corrigir a relação de testosterona/estrogênio de modo que os ovários possam funcionar normalmente.[108]
O tratamento para pessoas magras pode, igualmente, ser ligeiramente diferente do que para pessoas obesas.[106][107]
Genes da SOP em pessoas atribuidas como do sexo masculino ao nascer
editarO gene de ovário policístico também pode estar envolvido com virilização, calvície e acne em pessoas atribuidas como do sexo masculino ao nascer.[109]
Pessoas asiáticas afetadas pela SOP
editarSabe-se que pessoas asiáticas, quando afetadas pela SOP, são menos propensas a desenvolver hirsutismo do que pessoas dotadas de outras origens étnicas.[110]
Diagnóstico
editarA constatação, através de exame de ultrassom, de que os ovários apresentam múltiplos cistos foi por muito tempo considerada a característica patognomônica para o diagnóstico da SOP, mas parece ser um achado inespecífico em aproximadamente 20% das mulheres que são assintomáticas[111]. Atualmente, considera-se o fato de apresentar ovários policísticos por si só insuficiente para diagnosticar síndrome. Também a inexistência de cistos ovarianos não descaracteriza, necessariamente, a ocorrência da síndrome[112][8]. Asso, nem todas as pacientes com SOP apresentam ovários policísticos e, da mesma forma, nem todas as mulheres com cistos ovarianos podem ser automaticamente diagnosticadas como portadoras da síndrome. Embora o exame de ultrassonografia pélvica seja uma importante ferramenta de diagnóstico, ela não é a única.[113]
Os consensos internacionais adotados hoje para o diagnóstico da SOP são apresentados abaixo[112]. Em todos eles é preciso excluir outras possíveis causas para o excesso de andrógenos, tais como a hiperplasia adrenal congênita, Síndrome de Cushing, tumores secretores de andrógenos, exposição a andrógenos exógenos, hiperprolactinemia, hipotireoidismo e hipogonadimo hipotalâmico [114].
NIH/NICHD
editarEm 1990, uma oficina de consenso promovida pela NIH/NICHD sugeriu que uma paciente possuiria SOP se ela apresentasse os seguintes sintomas:[78]
- Oligo-ovulação;
- Sinais de excesso de androgênios (clínico ou bioquímico);
- Outros fatores estariam excluídos como causas da SOP;
Rotterdam
editarEm 2003, uma oficina de consenso patrocinado pela ESHRE/ASRM, em Rotterdam, indicou que a SOP poderia ser dada como diagnosticada acaso presentes ao menos dois dos seguintes sintomas: oligo-ovulação e/ou anovulação; excesso de atividade androgênica; e ovários policísticos (por ultrassom ginecológico).[115]
Outros fatores estariam excluídos como causas da SOP;[64][116]
A definição Rotterdam é mais ampla e, atualmente, a mais utilizada, englobando um número maior de pessoas, pois abarca até pacientes que não possuem excesso de androgênios. Críticos dessa definição dizem que os resultados obtidos a partir do estudo das pessoas atribuidas como do sexo feminino ao nascer com excesso de andrógenos não podem necessariamente ser extrapolados para pessoas atribuidas como do sexo feminino ao nascer sem excesso de andrógenos.[117][118]
The Androgen Excess and PCOS (AE-PCOS SOCIETY)
editarEm 2006, a The Androgen Excess and PCOS (AE-PCOS SOCIETY) sugeriu um reforço nos critérios de diagnóstico: excesso de atividade androgênica, oligo-ovulação/ anovulação e/ou ovários policísticos; e outros fatores que possam causar excesso de atividade androgênica estariam excluídos.[64]
Avaliações de diagnóstico padrão
editarHistórico, especificamente para o padrão menstrual, obesidade, hirsutismo e a ausência de desenvolvimento de mamas. A regra de predição clínica descobriu que estas quatro perguntas podem diagnosticar a SOP com uma sensibilidade de 77,1% (95% intervalo de confiança [IC] 62,7% -88,0%) e uma especificidade de 93,8% (95% IC 82,8% -98,7%).[119]
Ultrassonografia ginecológica especificamente voltada para a localização de pequenos folículos ovarianos. Estes são acreditados como resultado da função ovariana perturbada com a ovulação falha, refletida pela menstruação infrequente ou ausente, sendo esta uma manifestação típica da doença. Em um ciclo menstrual normal, um óvulo é liberado do folículo dominante - em essência, um cisto que se rompe para liberar o óvulo. Após a ovulação, o remanescente do folículo é transformado em um corpo lúteo produtor de progesterona, que encolhe e desaparece após cerca de 12-14 dias. Na SOP, há uma assim chamada "prisão folicular", isto é, vários folículos desenvolvem-se até um determinado tamanho (geralmente entre 5-7 mm), mas não mais do que isso. Nenhum folículo atinge o tamanho pré-ovulatório (16 mm ou mais). De acordo com os critérios de Rotterdam, ao menos 12 ou mais folículos pequenos devem ser encontrados no ovário durante o exame de ultrassom.[78] Os folículos podem ser orientados na periferia, dando a aparência de uma "cadeia de pérolas". Os inúmeros folículos contribuem para o aumento do tamanho dos ovários, ou seja, cerca de 1,5 a 3 vezes maior do que o normal.
O exame Laparoscópico pode revelar uma superfície ovariana branca-perolada, espessa e lisa. Tal fato normalmente seria considerado um achado incidental acaso a laparoscopia fosse realizada por algum outro motivo.
Os níveis séricos (sangue) de androgênios(hormônios masculinos), incluindo androstenediona e testosterona, podem estar elevados.[64] DHEA-S (Sulfato de Dehidroepiandrosterona) com níveis acima de 700-800 ug/dl são altamente sugestivos de disfunção adrenal pois o DHEA-S é produzido exclusivamente pelas glândulas adrenais.[17][120] O nível de testosterona livre é considerada a melhor medida,[17][121] pois cerca de 60% das pacientes de SOP demonstram níveis supranormais.[67] O índice de androgênio livre (IAL) da relação de testosterona e a globulina ligadora de hormônios sexuais (SHBG, do inglês sex hormone-binding globulin) é alto[64][17] e se destina a ser um preditor de testosterona livre, mas é um parâmetro pobre para esta finalidade e não é melhor do que a testosterona, por si só, como um marcador para a SOP,[82] possivelmente devido ao IAL estar correlacionado com o grau de obesidade.[83]
Alguns outros exames de sangue são sugestivos, mas não servem como diagnóstico padrão. A proporção de LH (hormônio luteinizante) para a FSH (hormônio folículo-estimulante), quando medido em unidades internacionais, é elevada em pessoas com SOP. Os parâmetros comumente utilizados para designar como anormalmente elevada a relação LH/FSH são de 2:1[84] ou 3:1,[17] tal como testado no 3º dia do ciclo menstrual. O padrão não é muito específico e, em um determinado estudo, uma proporção de 2:1 ou superior estava presente em menos de 50% das pessoas com SOP.[84] Muitas vezes são verificados baixos níveis da globulina ligadora de hormônios sexuais (SHBG),[17] em particular entre as pessoas obesas ou com sobrepeso.
Condições associadas
editarRastreio bioquímico (em jejum) e perfil lipídico.[119]
O Teste de tolerância à glicose (TTG), mediante o qual uma dose padrão de glicose é ingerida oralmente e os níveis sanguíneos são verificados após duas horas, realizado em pacientes com fatores de risco (obesidade, histórico familiar, histórico de diabetes gestacional),[64] pode indicar tolerância debilitada à glicose (resistência à insulina) em 15-33% das pessoas com SOP.[119] A diabete franca pode ser vista, por outro lado, em cerca de 65-68% das pessoas com esta condição.A resistência à insulina pode ser observada em ambos os pacientes com excesso de peso e peso normais, embora seja mais comum na segunda categoria (e naqueles que correspondem aos critérios mais rigorosos do NIH/NICHD para diagnóstico); 50-80% dos pacientes com SOP podem ter, em algum nível, resistência à insulina.[64]
Nível de insulina em jejum ou TTG com níveis de insulina (também chamado de IGTT). Níveis elevados de insulina têm sido úteis para prever a resposta à medicação e podem indicar a necessidade de se administrar dosagens, em pessoas nessa condição, mais elevadas de metformina ou o uso de um segundo medicamento para obter-se níveis de insulina significativamente menores. Valores elevados de açúcar no sangue e insulina não preveem quem responde a medicamentos para baixar a insulina, a dietas de baixo índice glicêmico e a exercícios físicos. Muitas pessoas com níveis normais podem se beneficiar da terapia de combinação. A resposta hipoglicêmica, em que o nível de insulina medido nas duas horas anteriores é maior e o açúcar no sangue é mais baixo do que em jejum vem a ser consistente com a resistência à insulina. Uma derivação matemática conhecida como HOMAI, calculada a partir dos valores em jejum de glicose e concentrações de insulina, permite uma medida direta e moderadamente precisa de sensibilidade à insulina (nível de glicose x nível de insulina/22.5).
O Teste de tolerância à glicose (TTG), em vez de glicose em jejum, pode facilitar o diagnóstico de aumento da tolerância à glicose e diabete franca entre as pacientes com SOP, de acordo com um estudo prospectivo controlado.[120] Enquanto os níveis de glicose em jejum podem permanecer dentro de limites normais, testes de glicose administrados pela via oral revelaram que até 38% das pessoas assintomáticas com SOP (versus 8,5% na população em geral), na verdade apresentavam tolerância debilitada à glicose, 7,5% das quais possuem diabete franca de acordo com as diretrizes da Associação Americana de Diabetes (American Diabetes Association – ADA).[120]
Diagnóstico Diferencial
editarOutras causas da menstruação e hirsutismo irregular ou ausente, como o hipotireoidismo, a hiperplasia adrenal congênita (deficiência de 21-hidroxilase), a síndrome de Cushing, a hiperprolactinemia, neoplasias secretoras de andrógenos, assim como outros distúrbios da hipófise[24] devem ser investigados.[64][116][119] A SOP tem sido relatada em outras situações resistentes à insulina, tais como acromegalia.
Patogênese
editarOvários policísticos desenvolvem-se quando os ovários são estimulados a produzir quantidades excessivas de hormônios masculinos (androgênios), em particular a testosterona, por qualquer um ou mediante a combinação dos seguintes fatores (quase certamente combinado com susceptibilidade genética):[24]
- A liberação excessiva do hormônio luteinizante (LH) pela glândula pituitária anterior (note-se que tal glândula é igualmente conhecida como Hipófise Anterior ou Adeno-hipófise).
- Através de níveis elevados de insulina no sangue (hiperinsulinemia) em pessoas cujos ovários são sensíveis a este estímulo;[14]
Além disso, níveis reduzidos de globulina ligadora de hormônios sexuais (SHBG) pode resultar no aumento de androgênios livres.
A síndrome adquiriu seu nome mais amplamente utilizado devido ao sinal comum no exame de ultrassom de múltiplos (poli) cistos ovarianos. Estes "cistos" são na verdade folículos imaturos, não cistos. Os folículos se desenvolveram a partir de folículos primordiais, mas o desenvolvimento foi interrompido ("preso") numa fase antral precoce devido à perturbação na função ovariana. Os folículos podem ser orientados ao longo da periferia do ovário, aparecendo como um "colar de pérolas" no exame de ultrassom.
As pessoas portadoras da SOP experimentam um aumento na frequência de pulsos de GnRH do hipotálamo, que por sua vez resultam em um aumento da relação entre os hormônios LH (Hormônio luteinizante) / FSH (Hormônio folículo-estimulante).[17]
A maioria das pacientes com SOP têm a resistência à insulina e/ou são obesas. Os seus níveis elevados de insulina contribuem ou causam as alterações observadas no eixo hipotálamo-hipófise-ovariano (HHO) que levam à SOP.
A hiperinsulinemia aumenta a frequência de pulsos de GnRH, provoca a prevalência do LH sobre o FSH, majora a produção de androgênios ovarianos,[14] diminui a maturação folicular e diminui a globulina ligadora de hormônios sexuais (SHBG); todos estes passos contribuem para o desenvolvimento da SOP. A resistência à insulina é um achado comum entre as pacientes de peso normal, bem como pacientes com sobrepeso.[64][70]
Em muitos casos, a SOP é caracterizada por um ciclo de retorno positivo complexo de resistência à insulina e hiperandrogenismo. Na maioria dos casos, não é possível determinar quais (se houver) dos dois deve ser considerado o causador. Tratamentos experimentais tanto com antiandrogênicos ou agentes sensibilizadores de insulina melhoraram tanto o hiperandrogenismo quanto a resistência à insulina.
O tecido adiposo possui aromatase, uma enzima que converte androstenodiona em estrona e testosterona em estradiol. O excesso de tecido adiposo em pacientes obesos cria o paradoxo de ter ambos os andrógenos em excesso (que são responsáveis pela hirsutismo e virilização) e estrógenos (que inibe FSH via retorno negativo).[121]
A SOP pode estar, ainda, associada com inflamações crônicas,[14][82] sendo que vários investigadores chegaram a correlacionar mediadores químicos inflamatórios com anovulação e outros sintomas típicos da síndrome.[83][84] Da mesma forma, parece haver uma relação entre a SOP e o aumento do nível de estresse oxidativo (responsável, inclusive, pelo envelhecimento precoce da pele).[85]
Análises científicas chegaram a sugerir que a produção excessiva de androgênios em pessoas com SOP poderia ser causada pela redução do nível sérico do IGFBP-1 (também conhecida como proteína placentária 12 - PP12), o que, por sua vez, aumentaria o nível de IGF-1 livre, o qual estimularia a produção de androgênios ovarianos. Dados recentes, todavia, concluíram que este mecanismo seria improvável.[122]
A SOP também tem sido associada com um sub-genótipo específico conhecido como FMR1. Pesquisas sugerem que pessoas com "heterozigoto-normal/baixo" do FMR1 possuem sintomas semelhantes aos da síndrome do ovário policístico, tais como atividade folicular excessiva e função ovariana hiperativa. [123]
Tratamentos
editarA síndrome do Ovário Policístico é uma endocrinologia crônica e, até o presente momento, incurável. Há, todavia, diversos tratamentos desenvolvidos sob medida e de acordo com os objetivos de cada paciente capazes de atenuar a sintomatologia. Em termos gerais, tais objetivos podem ser divididos em 04 (quatro) grandes categorias:
- Redução dos níveis de resistência à insulina;
- Restauração da fertilidade;
- Tratamento de hirsutismo ou acne;
- Restauração da menstruação regular e prevenção de hiperplasia endometrial e câncer endometrial.
Cada uma destas áreas, todavia, envolve um debate considerável quanto ao tratamento ideal. Uma das principais razões para tanto vem a ser a falta de ensaios clínicos em grande escala capazes de comparar diferentes tratamentos. Ensaios menores tendem a ser menos confiáveis e, portanto, podem produzir resultados conflitantes.
Intervenções gerais que ajudam a reduzir o peso ou a resistência à insulina podem ser benéficas para todos os objetivos acima elencados, uma vez que abordam o que se acredita ser a causa subjacente da síndrome.
O médico adequado para avaliar a paciente e seu respectivo tratamento é o endocrinologista. Por outro lado, considerando-se que a SOP parece causar sofrimento emocional significativo, inclusive com importantes manifestações psiquiátricas associadas, o suporte a ser prestado por psicólogos e psiquiatras pode ser bastante útil.[124]
As formas de tratamento mais comuns são[19]:
- Exercícios físicos regulares;
- Dieta de emagrecimento com controle glicêmico. Perder peso diminui muito os outros sintomas;
- Uso de pílula anticoncepcional específica para SOP, que atua também nos problemas de acne e hirsutismo (pelos), além de regular o excesso de testosterona;
- Uso de antiandrógenos como Acetato de ciproterona;
- Uso de hipoglicemiantes orais, um dos mais conhecidos a metamorfina.
- Uso de estimulantes da menstruação;
- Caso a paciente deseje engravidar, uso de clomifeno pode reverter a infertilidade;
- Cosméticos específicos para diminuir a acne;
- Psicoterapia para controle do estresse, depressão e ansiedade causada pelas mudanças hormonais e na aparência.
Dieta
editarQuando a SOP está associada com excesso de peso ou obesidade, a perda de peso, se realizada de forma bem sucedida, vem a ser o método mais eficaz para restaurar a normalidade da ovulação/menstruação. Contudo, muitas pessoas acreditam ser muito difícil alcançar e manter perdas significativas de peso.
Uma revisão científica levada a efeito em 2013 revelou que, independentemente da composição da dieta, é possível alcançar-se decréscimos similares de redução de peso e da composição corporal, bem como melhoria da taxa de gravidez, da regularidade menstrual, ovulação, hiperandrogenismo, resistência à insulina, lipídios, além de aumentar a qualidade de vida.[125] Igualmente, experimentos demonstraram que dietas de baixo índice glicêmico (na qual uma parte significativa do total de carboidratos é obtido de frutas, verduras e de fontes integrais) proporcionaram o aumento da regularidade menstrual, especialmente se comparadas a dietas saudáveis baseadas em macronutrientes.[125]
A deficiência da Vitamina D pode ter papel importante no desenvolvimento da síndrome metabólica, por isso é recomendável o tratamento de tal deficiência. A esse respeito, um estudo encontrou níveis insuficientes de "25-hidroxi vitamina D" (< 30 ng / mL) em quase 75% das pacientes com SOP, com níveis mais baixos em pessoas com síndrome metabólica (17,3 ng / mL) do que naquelas sem síndrome metabólica (25,8 ng / mL).[126]
Medicamentos
editarA redução de resistência à insulina, melhorando a sensibilidade à insulina através de medicamentos como metformina [127] e o mais novo thiazolidinedione (ou glitazonas), apresentava-se como uma abordagem óbvia e estudos iniciais pareciam demonstrar sua eficácia.[14][126][128] Estudos mais atuais sugerem, todavia, que a glitazona pode duplicar o risco de fraturas ósseas em pessoas.[129]
Apesar da metformina não ter sido inicialmente licenciada para uso em pacientes com SOP, o National Institute for Health and Clinical Excellence do Reino Unido recomendou, em 2004, que pessoas diagnosticadas com a síndrome e detentoras de um índice de massa corporal acima de 25 fizessem uso da metformina quando outras terapias falhassem na produção de resultados.[130]
A metformina é o medicamento sensibilizante à insulima mais prescrito, sendo frequentemente usada para tratamento de complicações metabólicas e riscos cardiovasculares em pacientes com SOP. A metformina também melhora a fertilidade e o perfil hemostático (de coagulação) das pacientes [127] .
Revisões subsequentes, no entanto, em 2008 e 2009, notaram que estudos controlados (ou randomised control trials) não demostraram, em geral, a promessa sugerida pelo estudo observacional anterior.[131][132]
Infertilidade
editarNem todas as pessoas afetadas pela Síndrome do Ovário Policístico enfrentarão, necessariamente, dificuldade para engravidar. Entretanto, naquelas em que se verifica algum tipo de dificuldade para engravidar, percebe-se que a anovulação ou a ovulação infrequente vem a ser, para todas, uma causa em comum.
Outros fatores incluem níveis alterados de gonadotrofina, hiperandrogenemia e hiperinsulinemia.[133] A exemplo das que não possuem a síndrome, as pessoas acometidas pela SOP, mesmo conseguindo ovular, podem ser inférteis em virtude de outras condicionantes, tais como obstruções nas trompas devido a um histórico de infecções sexualmente transmissíveis.
Para as mulheres com excesso de peso e anovulatórias (em função da SOP), a perda de peso e ajustes na dieta, especialmente para reduzir a ingestão de hidratos de carbono simples,[134] poderão facilitar a retomada da ovulação natural.
Para pessoas obesas que mesmo após a perda de peso ainda continuam anovulatórias, ou até mesmo em se tratando de pessoas normalmente magras porém anovulatórias, medicamentos indutores de ovulação, a exemplo do citrato de clomifeno[126] e FSH, são indicados como os principais tratamentos para promovê-la.[14] Até recentemente, o medicamento antidiabetes metformina era o tratamento recomendado para a anovulação,[14] mas há indícios de que sua eficácia é inferior à do clomifeno.[135]
Para os pacientes não responsivos ao clomifeno associado à dieta e modificação de estilo de vida, há outras opções disponíveis, incluindo procedimentos de tecnologia de reprodução assistida, como hiperestimulação ovariana controlada com injeções de hormônio folículo-estimulante (FSH) seguidas de fertilização in vitro (FIV).
Hirsutismo e acne
editarQuando necessário (por exemplo, em pessoas em idade fértil que necessitem de contracepção), a pílula anticoncepcional padrão é frequentemente efetiva na redução do hirsutismo.[14][126] A pílula anticoncepcional comumente escolhida vem a ser a que contém acetato de ciproterona (no Reino Unido, as marcas disponíveis são Dianette/Diane). O acetato de ciproterona se caracteriza como sendo uma progesterona com efeitos antiandrógenos que bloqueiam a ação de hormônios masculinizantes, os quais, tal como se acredita, contribuem para a acne e o crescimento indesejado de pelos faciais e corporais. Por outro lado, progestagênios, tais como o norgestrel e levonorgestrel devem ser evitado devido aos seus efeitos androgênicos.[126]
É importante ressaltar que, de acordo com a ANVISA, o medicamento Diane® 35 é contra-indicado para pacientes com histórico de processos trombóticos (vide Informe SNVS/Anvisa/Nuvig/GFARM nº 01, de 29 de janeiro de 2013).[136] No referido Informe, inclusive, a ANVISA destaca que a bula do referido medicamento já possui as informações de que o mesmo não deve ser utilizado na presença ou histórico de processos trombóticos/tromboembólicos arteriais ou venosos, como por exemplo, trombose venosa profunda, embolia pulmonar, infarto do miocárdio ou de acidente vascular cerebral, bem como na presença ou história de sintomas e/ou sinais prodrômicos de trombose , como por exemplo, episódio isquêmico transitório, angina pectoris.[136]
Outras drogas com efeitos antiandrogênicos incluem flutamida,[137] e espironolactona,[14][126] as quais podem conferir alguma melhora ao hirsutismo. A espironolactona é provavelmente a droga mais comumente usada nos EUA. A metformina pode reduzir o hirsutismo, talvez por redução da resistência à insulina, e é frequentemente usada para outras funcionalidades, tais como a resistência à insulina, diabetes, ou obesidade (que também deve se beneficiar de metformina). Eflornithine (Vaniqa) é um fármaco que é aplicado à pele na forma de creme, e atua diretamente sobre os folículos pilosos para inibir o crescimento de cabelo. É geralmente aplicado à face.[126]
Os medicamentos que reduzem a acne através de efeitos hormonais indiretos também incluem agonistas dopaminérgicos tais como Bromocriptina. Inibidores da 5α-redutase (por exemplo, finasterida e dutasterida) podem também ser usados;[78] eles trabalham bloqueando a conversão de testosterona para di-hidrotestosterona (este último responsável pela maioria das alterações do crescimento de cabelo e da acne androgênica).
Embora estes agentes tenham demonstrado eficácia significativa em ensaios clínicos (para contraceptivos orais, em 60-100% dos indivíduos[126]), a redução no crescimento de cabelo pode não ser suficiente para eliminar o constrangimento social causado pelo hirsutismo, ou a inconveniência de arrancar ou fazer a barba. Indivíduos variam em sua resposta a diferentes terapias. Geralmente vale a pena tentar outros tratamentos medicamentosos se um deles não funcionar, mas os tratamentos com drogas não funcionam bem para todos os indivíduos. Para a remoção de pelos faciais, a eletrólise, ou tratamentos a laser são - pelo menos para alguns - alternativas mais rápidas e mais eficientes do que as terapias médicas acima mencionadas.
Irregularidade menstrual e hiperplasia endometrial
editarSe a fertilidade não é o objetivo principal, então a menstruação geralmente pode ser regulada mediante o uso de pílulas contraceptivas.[14][126] A finalidade de regular a menstruação, em essência, é um conveniência que diz respeito unicamente à mulher e, talvez, à sua sensação de bem-estar; não existe nenhum requisito médico para períodos regulares, desde que eles ocorram com certa frequência.
Se um ciclo menstrual regular não é desejado, então uma terapia para obter-se um ciclo irregular não é necessariamente exigida. A maioria dos especialistas julga que, se um sangramento menstrual ocorrer pelo menos a cada três meses, o endométrio (revestimento do útero), por este critério, estaria sendo suficientemente derramado para evitar-se um aumento do risco de anormalidades endometriais ou câncer.[138] Se a menstruação ocorre com menos frequência ou nem mesmo ocorre, é recomendável, de alguma forma, fazer-se a substituição da progesterona.[78] Uma alternativa é progestagênio bucal tomado em intervalos (por exemplo, de três em três meses) para induzir uma hemorragia menstrual previsível.[14]
Tramento Cirúrgico da SOP
editarAtualmente, o papel das intervenções cirúrgicas no tratamento da SOP vem ganhando novos relevos. Conquanto tenham sido praticamente postos em segundo plano durante longa data, os procedimentos cirúrgicos vêm merecendo renovada atenção da comunidade científica.
Sendo assim, analisar-se-á o papel de dos procedimentos cirúrgicos que vem sendo recomendados no tratamento da síndrome, a saber: cirurgia bariátrica e a cirurgia ovariana.
Cirurgia Bariátrica
editarConforme o estudo Role of Surgery in the management of PCOS: Rationale and Considerations for bariatric Surgery, a obesidade agravaria todas as manifestações, riscos e comorbidades metabólicas da SOP.[139]
Embora a modificação de estilo de vida e intervenções dietéticas constituam uma estratégia de gestão de primeira linha, estas abordagens não são susceptíveis de serem eficazes a longo prazo em uma proporção significativa da população. Tendo em conta que a maioria das abordagens farmacológicas, na melhor das hipóteses, apresentam benefícios modestos, a cirurgia bariátrica, por outro lado, oferece uma promissora abordagem terapêutica alternativa em obesos (inclusive obesos moderados), obesos mórbidos e, igualmente, naqueles com evidência de comorbidades metabólicas.[139]
Eis, assim, alguns pontos-chaves quanto a esta modalidade de cirurgia[139]:
- A obesidade é o principal fator responsável pelos distúrbios metabólicos em pacientes com SOP.
- A modificação do estilo de vida é eficaz para a prevenção de distúrbios metabólicos em pacientes obesos com SOP, mas raramente é eficaz a longo prazo devido à dificuldade em sustentar o estilo de vida recém-adotado pela maioria.
- A cirurgia bariátrica em pessoas com obesidade grave pode resolver inteiramente o quadro clínico da SOP.
- A Fertilidade pode ser restaurada após a perda de peso em pessoas com SOP submetidas à cirurgia bariátrica.
- Evitar os riscos relacionados à gravidez, assim como os demais riscos de vida associados à obesidade severa, ao que tudo indica, compensaria os riscos relacionados ao procedimento em pacientes adequadamente selecionados.
Apesar da promessa, no entanto, os dados existentes sobre a gestão de cirurgia bariátrica da SOP são limitados, e estudos prospectivos em larga escala abordando não só a melhoria dos sintomas SOP e sucesso reprodutivo, mas também as consequências a longo prazo são absolutamente necessários antes da cirurgia bariátrica ser considerada como parte do tratamento rotineiro paradigmático da SOP.[139]
Cirurgia Ovariana
editarA cirurgia ovariana é reservada, pelo atual consenso médico, como último recurso, caso falhem as outras fórmulas de tratamento. Nela, os ovários policísticos são tratados com o procedimento cirúrgico laparoscópico chamado de "perfuração de ovário" (punção de 4-10 pequenos folículos com eletrocautério, laser ou agulhas de biópsia).
Tal procedimento cirúrgico, frequentemente, resulta na retomada das ovulações espontâneas;[126] tratamentos adjuvantes, baseados no uso de clomifeno ou FSH, podem auxiliar, após o procedimento cirúrgico, o início das ovulações.
Atualmente, os centros cirúrgicos mais avançados obtém êxito em realizar cirurgias minimamente invasivas. A moderna técnica da videolaparoscopia, como visto, promove tão-somente algumas perfurações na membrana espessada do ovário. Em tais circunstâncias, o pós-operatório, assim como o retorno às atividades normais, é consideravelmente rápido (a alta geralmente ocorre entre 3 a 4 horas). Os resultados obtidos, especialmente quanto à ovulação, são encorajadores, pois reduzem os níveis de andrógenos e melhoram os distúrbios menstruais em pacientes com a síndrome do ovário policístico.[140]
A cirurgia também oferece a vantagem de alterar, após a sua realização, a composição hormonal das pacientes com SOP. O procedimento provoca, na maioria das vezes, uma diminuição do LH sérico, da concentração de andrógenos (inclusive a diminuição da produção de testosterona) e dos níveis de DHEA. Esta redução nos níveis de androgênios intraovarianos permite o desenvolvimento de folículos funcionais.[141][142]
A cirurgia provoca uma significativa queda nos níveis séricos de andrógenos e LH e um aumento nos níveis de FSH. Acredita-se que as alterações endócrinas após o procedimento convertem o ambiente andrógeno-dominante intrafolicular adverso em um ambiente eminentemente estrogênico, além de restaurar e/ou conduzir o ambiente hormonal ao normal através da correção de distúrbios causados pelo eixo hipotálamo-hipófise-ovariano. Assim, crê-se que ambos os efeitos, locais e sistêmicos, promovem o recrutamento folicular, maturação e a subsequente ovulação.[142]
O estudo Surgical Management of Polycystic Ovary Syndrome: A Contemporary Viewpoint on Place of Ovarian Surgery in PCOS Management, de 2014, sugeriu uma revisão do consenso em torno do procedimento cirúrgico no tratamento da SOP, explicitando que o procedimento cirúrgico para a retirada parcial de tecido ovariano em pessoas com SOP tem eficácia reconhecida perante a comunidade científica. O estroma do ovário, especialmente as células da teca, vem a ser a principal fonte de androgênios e, por conseguinte, da hiperandrogenemia. Com a excisão de populações de células de teca, obtém-se como resultado a diminuição da carga de androgênio sintetizada e secretada, resultando na melhoria da hiperandrogenemia. Na verdade, as melhorias no sistema endócrino anormal e no meio metabólico da SOP, após a remoção parcial do tecido ovariano, são bem descritas pela doutrina médica. O declínio nos níveis de andrógenos circulantes, como decorrência, é suposto para restaurar a sensibilidade do eixo hipotálamo-hipófise-ovariano; sugere-se que a normalização do eixo gonadotrófico estaria por trás da retomada da ovulação, da regularidade menstrual e da restauração da fertilidade tendo em vista a consequente diminuição de volume dos ovários policísticos.[143]
Há, no entanto, preocupações quanto aos efeitos a longo prazo da perfuração de ovário na função ovariana.[126]
Ainda assim, é importante destacar que a abordagem convencional de ressecção em cunha dos ovários tem sido substituída pelo uso de técnicas cirúrgicas minimamente invasivas (perfuração de ovário utilizando microlaparoscopia, fertiloscopia e perfuração de ovário guiada por ultrassom), as quais tanto conferem benefícios clínicos quanto reduzem as sequelas a longo prazo associadas à ressecção em cunha.[143] Ainda assim, quando o mioma apresenta-se muito grande, a técnica cirúrgica recomendada continua sendo a laparotomia.[144]
Medicina alternativa
editarNão há evidências suficientes para concluir-se pela existência de efeitos benéficos advindos da ingestão de D-chiro-Inositol.[145] Myo-inositol, no entanto, parece ser eficaz com base em uma revisão sistemática.[146]
Epidemiologia
editarConforme o estudo científico Diagnostic Criteria and Epidemiology of PCOS (em português: Critérios de Dignóstico e Epidemiológico na SOP), publicado em 2014 no livro Polycystic Ovary Syndrome: Current and Emerging Concepts" (em português: "Síndrome do Ovário Policístico: Conceitos atuais e emergentes"), a prevalência da SOP em qualquer população específica depende do critério diagnóstico utilizado,[147] mas tem alguma variação regional e étnica. Enquanto a maioria dos relatórios sobre a prevalência da SOP variam entre 2 e 20%, sabe-se, todavia, que tal prevalência varia conforme o critério de diagnóstico escolhido. A coorte de nascimento retrospectiva na Austrália encontrou uma prevalência de 8,7% de acordo com critérios do NIH, 17,8%, utilizando critérios de Rotterdam, e 12,0% usando critérios da AES. Um padrão de prevalência semelhante foi encontrado na Turquia, onde 6,1% preencheram os critérios do NIH, 19,9% preencheram os critérios de Rotterdam, e 15,3% preencheram os critérios da AES. No Irão, a prevalência estimada de SOP foi de 7% com base nos critérios do NIH, 15,2%, utilizando critérios de Rotterdam, e 7,92% utilizam critérios AES. Na América do Norte, a maioria das estimativas sobre a população em geral nos Estados Unidos variam de 4 a 8% na literatura, embora a maioria das informações venham de uma população não selecionada de pessoas brancas e negras na região sudeste. Pessoas mexicanas-americanas têm uma maior prevalência, calculada em 13% ou mais. Curiosamente, a prevalência estimada de SOP entre as mulheres no México é de 6%, apenas metade do que a encontrada em suas semelhantes nos Estados Unidos. Estas discrepâncias não destacam apenas uma diversidade étnica na prevalência da doença, mas também a importância do estilo de vida na ocorrência da SOP[147] (variando para uma linha ascendente, inclusive, conforme o maior contato da população feminina com disruptores endócrinos industriais nas sociedades mais industrializadas, dentre eles o bisfenol).
Na Índia, a SOP é relatada entre 9% dos adolescentes. Entre as pessoas indianas com 15-35 anos de idade avaliadas em uma clínica de ginecologia rural, 13% apresentaram irregularidades menstruais, tendo a SOP sido diagnosticada em metade destas pessoas (ou seja, a prevalência da SOP seria algo em torno de 6,5%). No Sri Lanka, uma prevalência semelhante de 6,3% foi observada entre as pessoas com idade entre 15-39. No Irã, a prevalência da SOP é relatada em 8,5% em uma amostra de pessoas em idade reprodutiva selecionadas para participação no Tehran Lipid and Glucose Study. Um estudo grego na ilha de Lesbos encontrou uma prevalência de 6,8%. A prevalência global da SOP em uma população de pessoas australianas indígenas urbanas, utilizando critérios do NIH, foi de 15,3%. Um estudo no Reino Unido encontrou a prevalência de 8% de acordo com critérios rigorosos do NIH, enquanto que 26% de sua população preencheram os critérios de Rotterdam, ilustrando as diferenças observadas quando se utilizam diferentes critérios de diagnósticos. Na Espanha, em uma população de pessoas brancas, as quais se apresentaram espontaneamente para doação de sangue, foi encontrada uma prevalência de 6,5%. Por qualquer medida que seja, a SOP é uma das doenças endócrinas mais comuns em todo o mundo, com variação regional e étnica óbvias.[147]
Mulheres lésbicas, homens trans e a prevalência da síndrome do ovário policístico (SOP)
editarPesquisas realizadas no Reino Unido pela The London Women's Clinic, publicada em "Prevalence of polycystic ovaries and polycystic ovary syndrome in lesbian women compared with heterosexual women", concluíram que o risco de desenvolvimento de SOP é significativamente maior em mulheres lésbicas do que em heterossexuais: Um dos resultados obtidos demonstrou que 80% das mulheres lésbicas apresentavam sintomas ou problemas ligados ao ovário, enquanto que apenas 32% das auto-declaradas heterossexuais apresentavam problemas similares.[148][149][150] De uma forma ou de outra, os resultados obtidos mostraram um maior desequilíbrio hormonal entre as mulheres lésbicas.[151]
Uma das causas residiria no hiperandrogenismo - que é associado à SOP. Constatou-se, assim, ao menos aparentemente, uma importante interligação entre esta condição e a orientação sexual deste grupo específico de mulheres (lésbicas). Note-se que tal pesquisa, liderada pela pesquisadora Ph.D Rina Agrawal, Vice-Diretora da The London Women's Clinic e Professora Honorária de Medicina Reprodutiva da Universidade de Warwick, foi apresentada na Conferência de Embriologia e Reprodução Humana da Sociedade Europeia.
Os pesquisadores fizeram questão de afirmar que não estavam tentando sugerir que ser lésbica seria causado pela SOP, aclarando, igualmente, que não estavam procurando uma "cura para ser lésbica", nem que tal seria uma "doença" que precisava ser curada. Pelo contrário, o estudo apenas trouxera à tona dados objetivos que, atualmente, vem sendo utilizados em prol das mulheres lésbicas na prevenção do desenvolvimento da SOP e suas comorbidades (especialmente a resistência à insulina, diabetes, doenças cardiovasculares e câncer).
Não por outro motivo, o Gabinete de Saúde da Mulher, da Secretaria-Adjunta de Saúde do Departamento de Saúde e Serviços Humanos dos Estados Unidos (EUA), vem alertando mulheres lésbicas e bisexuais a respeito do tema, a fim de que permaneçam vigilantes quanto aos sintomas danosos da SOP.[150]
Por outro lado, várias pesquisas recentes demonstraram que o transgeneridade é frequentemente observado (em maior ou menor grau) nas mulheres acometidas pela Síndrome do Ovário Policístico (SOP). Neste sentido, vale citar alguns estudos clínicos que evidenciaram esta condição:
- Prevalence of hyperandrogenism, polycystic ovary syndrome and metabolic syndrome in female-to-male transsexuals (em português: Prevalência de hiperandrogenismo, síndrome dos ovários policísticos e síndrome metabólica em transexuais mulher-para-homem) .[95] A conclusão deste estudo, publicado em 2014, foi a seguinte: O hiperandrogenismo, em geral, e a Síndrome do Ovário Policístico, em particular, são altamente prevalecentes em transexuais mulher-para-homem. O hiperandrogenismo e a Síndrome do Ovário Policístico (SOP) estão relacionados ao desenvolvimento precoce da Síndrome Metabólica, Resistência à Insulina e outros fatores cardiovasculares com consequências desconhecidas na idade adulta.
- Association between polycystic ovary syndrome and female-to-male transsexuality (em português: Associação entre síndrome do ovário policístico e transexualidade mulher-para-homem) .[96] Neste estudo, conclui-se o seguinte: "pacientes transexuais FTM (mulher-para-homem) têm uma elevada prevalência de SOP e hiperandrogenemia". Mais adiante, aponta-se o seguinte: Nossos resultados mostram que muitos casos de transexualidade FTM (mulher-para-homem) estão associados com SOP e hiperandrogenemia, o que sugere que eles são fatores importantes na patogênese do transexualismo FTM. Além disso, nossos resultados também sugerem que quando se administra terapia hormonal para pacientes transexuais FTM, é importante que os profissionais tenham em mente que este tratamento piora a resistência à insulina".
- Distinctive features of female-to-male transsexualism and prevalence of gender identity disorder in Japan (em português: Traços característicos distintivos do transexualismo mulher-para-homem e prevalência de transtorno de identidade de gênero no Japão).[97] Neste estudo, de 2011, chegou-se às seguintes conclusões: A Síndrome do Ovário Policístico (SOP), conhecida por estar associada com a resistência à insulina e síndrome metabólica, é muitas vezes vista em (FTM) pacientes transexuais mulher-para-homem. Consequentemente, a detecção da SOP é uma parte importante dos cuidados de saúde para esses indivíduos. A SOP e a resistência à insulina são achados comuns em pacientes transexuais FTM (mulher-para-homem) na apresentação inicial".
- Female Gender Scheme is Disturbed by Polycystic Ovary Syndrome: A Qualitative Study From Iran (em português: Esquema do Sexo Feminino é perturbado pela Síndrome do Ovário Policístico: um estudo qualitativo do Irã);[98]
- Psychological gender of patients with polycystic ovary syndrome (em português: Sexo psicológico de pacientes com síndrome dos ovários policísticos) [99] . Este último estudo, de 2012, por sinal, é eloquente ao afirmar que as mulheres com SOP têm, dependendo da idade e da gravidade da doença, problemas com identificação psicológica de gênero. A duração e a gravidade da SOP pode afetar negativamente a auto-imagem da paciente, levando-a a uma identificação perturbada do esquema gênero/fêmea e o seu respectivo papel social.[99]
Referências
- ↑ Kollmann, M.; Martins, W. P.; Raine-Fenning, N. (2014). "Terms and thresholds for the ultrasound evaluation of the ovaries in women with hyperandrogenic anovulation".Human Reproduction Update 20 (3): 463–464.doi:10.1093/humupd/dmu005. ISSN 1355-4786.
- ↑ a b Carvalho, L.M.L.; Ferreira, C.N.; Sóter, M.O.; Sales, M.F.; Rodrigues, K.F.; Martins, S.R.; Candido, A.L.; Reis, F.M.; Silva, I.F.O. (março de 2017). «Microparticles: Inflammatory and haemostatic biomarkers in Polycystic Ovary Syndrome». Molecular and Cellular Endocrinology (em inglês): 155–162. doi:10.1016/j.mce.2017.01.017. Consultado em 8 de setembro de 2022
- ↑ H Teede; A Deeks; L Moran (30 June 2010). "Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan". BMC Medicine (BioMedCentral) 8: 41. doi:10.1186/1741-7015-8-41. Retrieved 14 November 2011.
- ↑ a b c Carvalho, Laura M. L.; dos Reis, Fernando M.; Candido, Ana Lucia; Nunes, Fernanda F. C.; Ferreira, Claudia N.; Gomes, Karina B. (1 de outubro de 2018). «Polycystic Ovary Syndrome as a systemic disease with multiple molecular pathways: a narrative review». Endocrine Regulations (em inglês) (4): 208–221. ISSN 1336-0329. doi:10.2478/enr-2018-0026. Consultado em 7 de setembro de 2022
- ↑ Goldenberg N, Glueck C (2008). "Medical therapy in women with polycystic ovary syndrome before and during pregnancy and lactation". Minerva Ginecol 60 (1): 63–75.PMID 18277353
- ↑ Boomsma CM, Fauser BC, Macklon NS (2008). "Pregnancy complications in women with polycystic ovary syndrome". Semin. Reprod. Med. 26 (1): 72–84.doi:10.1055/s-2007-992927. PMID 18181085.
- ↑ Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO (June 2004). "The Prevalence and Features of the Polycystic Ovary Syndrome in an Unselected Population".Journal of Clinical Endocrinology & Metabolism 89 (6): 2745–9. doi:10.1210/jc.2003-032046. PMID 15181052.
- ↑ a b Polson Et all., 1988; Herter, Magalhães e Spritzer, 1995.
- ↑ Medical News Today: What is Polycystic Ovary Syndrome (PCOS)? [1]
- ↑ Carvalho, Laura M. L.; dos Reis, Fernando M.; Candido, Ana Lucia; Nunes, Fernanda F. C.; Ferreira, Claudia N.; Gomes, Karina B. (1 de outubro de 2018). «Polycystic Ovary Syndrome as a systemic disease with multiple molecular pathways: a narrative review». Endocrine Regulations (em inglês) (4): 208–221. ISSN 1336-0329. doi:10.2478/enr-2018-0026. Consultado em 7 de setembro de 2022
- ↑ Palomba, Stefano; Santagni, Susanna; Falbo, Angela; La Sala, Giovanni Battista (julho de 2015). «Complications and challenges associated with polycystic ovary syndrome: current perspectives». International Journal of Women's Health (em inglês). 745 páginas. ISSN 1179-1411. PMC PMC4527566 Verifique
|pmc=(ajuda). PMID 26261426. doi:10.2147/IJWH.S70314. Consultado em 7 de setembro de 2022 - ↑ Polycystic ovary syndrome. Polycystic ovaries; Polycystic ovary disease; Stein-Leventhal syndrome; Polyfollicular ovarian disease. Last reviewed: February 26, 2012 (http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0001408).
- ↑ a b c d Legro RS; Strauss JF (September 2002). "Molecular progress in infertility: polycystic ovary syndrome". Fertility and Sterility 78 (3): 569–576.doi:10.1016/S0015-0282(02)03275-2. PMID 12215335.
- ↑ a b c d e f g h i j k l m n o p q Mayo Clinic Staff (4 April 2011). "Polycystic Ovary Syndrome – All".MayoClinic.com. Mayo Clinic. Retrieved 15 November 2011 (http://www.mayoclinic.org/diseases-conditions/pcos/basics/definition/con-20028841?DSECTION=all)
- ↑ a b c Carvalho, Laura M. L.; dos Reis, Fernando M.; Candido, Ana Lucia; Nunes, Fernanda F. C.; Ferreira, Claudia N.; Gomes, Karina B. (1 de outubro de 2018). «Polycystic Ovary Syndrome as a systemic disease with multiple molecular pathways: a narrative review». Endocrine Regulations (em inglês) (4): 208–221. ISSN 1336-0329. doi:10.2478/enr-2018-0026. Consultado em 7 de setembro de 2022
- ↑ Carvalho, Laura M. L.; Ferreira, Cláudia N.; de Oliveira, Daisy K. D.; Rodrigues, Kathryna F.; Duarte, Rita C. F.; Teixeira, Márcia F. A.; Xavier, Luana B.; Candido, Ana Lúcia; Reis, Fernando M. (dezembro de 2017). «Haptoglobin levels, but not Hp1-Hp2 polymorphism, are associated with polycystic ovary syndrome». Journal of Assisted Reproduction and Genetics (em inglês) (12): 1691–1698. ISSN 1058-0468. PMC PMC5714822 Verifique
|pmc=(ajuda). PMID 28900795. doi:10.1007/s10815-017-1030-3. Consultado em 8 de setembro de 2022 - ↑ a b c d e f g http://www.ncbi.nlm.nih.gov/pubmed/21528473.
- ↑ a b Lab Tests On-line. Ovário Policístico [2]). Este artigo foi modificado pela última vez em 04 de fevereiro de 2013.
- ↑ a b Polycystic Ovary Syndrome, from Patient.co.uk (http://www.patient.co.uk/health/polycystic-ovary-syndrome)
- ↑ a b c Thin With PCOS: "How can I have PCOS if I’m not overweight?". by Dr. Sari Cohen From PCOSA Today, September/October 2007 [3].
- ↑ DIRETRIZES DA SOCIEDADE BRASILEIRA DE REPRODUÇÃO HUMANA. ENDOCRINOLOGIA DA REPRODUÇÃO. Membros da comissão: Sebastião Freitas de Medeiros (relator); Mauri José Piazza; Ricardo Melo Marinho; Alessandro Gomes Schuffener.[4] Arquivado em 19 de dezembro de 2014, no Wayback Machine..
- ↑ a b Diamanti-Kandarakis E; Kandarakis H, Legro RS (August 2006). "The role of genes and environment in the etiology of PCOS". Endocrine 30(1): 19–26. doi:10.1385/ENDO:30:1:19. PMID 17185788.
- ↑ a b Crosignani PG, Nicolosi AE (2001). "Polycystic ovarian disease: heritability and heterogeneity". Hum. Reprod. Update 7 (1): 3–7. doi:10.1093/humupd/7.1.3.PMID 11212071.
- ↑ a b c d Strauss JF 3rd (November 2003). "Some new thoughts on the pathophysiology and genetics of polycystic ovary syndrome". Annals of the New York Academy of Sciences 997: 42–48. doi:10.1196/annals.1290.005.PMID 14644808.
- ↑ a b Ada Hamosh (12 September 2011). "POLYCYSTIC OVARY SYNDROME 1; PCOS1". OMIM. McKusick-Nathans Institute of Genetic Medicine, Johns Hopkins University School of Medicine. Retrieved 15 November 2011.
- ↑ Amato P, Simpson JL (October 2004). "The genetics of polycystic ovary syndrome". Best Pract Res Clin Obstet Gynaecol 18 (5): 707–18.
- ↑ Overexpression of a DENND1A isoform produces a polycystic ovary syndrome theca phenotype. McAllister JM, Modi B, Miller BA, Biegler J, Bruggeman R, Legro RS, Strauss JF 3rd. Proceedings of the National Academy of Sciences. 2014 Apr 15;111(15):E1519-27. doi: 10.1073/pnas.1400574111. Epub 2014 Mar 31. (http://www.ncbi.nlm.nih.gov/pubmed/24706793).
- ↑ Genetics of polycystic ovary syndrome. Welt CK, Duran JM. Seminars in Reproductive Medicine. 2014 May;32(3):177-82. doi: 10.1055/s-0034-1371089. Epub 2014 Apr 8. (http://www.ncbi.nlm.nih.gov/pubmed/24715512).
- ↑ a b c d e f g h i Industrial endocrine disruptors and polycystic ovary syndrome. Palioura E, Diamanti-Kandarakis E. J Endocrinol Invest. 2013 Dec;36(11):1105-11 (http://www.ncbi.nlm.nih.gov/pubmed/24445124)
- ↑ a b c Bisphenol A (BPA) and its potential role in the pathogenesis of the polycystic ovary syndrome (PCOS). Rutkowska A, Rachoń D. Gynecol Endocrinol. 2014 Apr;30(4):260-5. doi: 10.3109/09513590.2013.871517. Epub 2014 Jan 7. PMID 24397396 [PubMed - in process] (http://www.ncbi.nlm.nih.gov/pubmed/24397396).
- ↑ Endocrine Disruptors and Polycystic Ovary Syndrome (PCOS): Elevated Serum Levels of Bisphenol A in Women with PCOS. Eleni Kandaraki, Antonis Chatzigeorgiou, Sarantis Livadas, Eleni Palioura, Frangiscos Economou, Michael Koutsilieris, Sotiria Palimeri, Dimitrios Panidis, and Evanthia Diamanti-Kandarakis. ISSN Print 0021-972X ISSN Online 1945-7197. Printed in U.S.A. The Endocrine Society. doi: 10.1210/jc.2010-1658. Received July 19, 2010. Accepted November 23, 2010. First Published Online December 30, 2010 (http://www.ncbi.nlm.nih.gov/pubmed/21193545)
- ↑ Le Corre L, Besnard P, Chagnon MC. BPA, an Energy Balance Disruptor. Crit Rev Food Sci Nutr. 2013 Sep 20 (http://www.ncbi.nlm.nih.gov/pubmed/24915348).
- ↑ Impact of early-life bisphenol A exposure on behavior and executive function in children. Braun JM, Kalkbrenner AE, Calafat AM, Yolton K, Ye X, Dietrich KN, Lanphear BP. Pediatrics. 2011 Nov;128(5):873-82. doi: 10.1542/peds.2011-1335. Epub 2011 Oct 24 (http://www.ncbi.nlm.nih.gov/pubmed/22025598).
- ↑ Sex Specific Estrogen Receptor beta (ERβ) mRNA Expression in the Rat Hypothalamus and Amygdala is Altered by Neonatal Bisphenol A (BPA) Exposure. Jinyan Cao, Linwood Joyner, Jillian A. Mickens, Stephanie M Leyrer and Heather B Patisaul. Reproduction. 2014; 147(4): 537–554. Published online Mar 4, 2014. doi: 10.1530/REP-13-0501 (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3947720/).
- ↑ Androgen excess fetal programming of female reproduction: a developmental aetiology for polycystic ovary syndrome? D.H. Abbott, D.K. Barnett, C.M. Bruns and D.A. Dumesic. Oxford Journals. Human Reproduction Update. July/August 2005. Volume 11, Issue 4. Pp. 357-374 (http://humupd.oxfordjournals.org/content/11/4/357.full).
- ↑ Fetal Programming of Polycystic Ovary Syndrome by Androgen Excess: Evidence from Experimental, Clinical, and Genetic Association Studies. Nectaria Xita, and Agathocles Tsatsoulis. The Journal of Clinical Endocrinology & Metabolism. DOI: http://dx.doi.org/10.1210/jc.2005-2757; Received: December 19, 2005; Accepted: February 23, 2006; Published Online: July 02, 2013 (http://press.endocrine.org/doi/full/10.1210/jc.2005-2757)
- ↑ Developmental Programming of Polycystic Ovary Syndrome: Role of Prenatal Androgen Excess. Agathocles Tsatsoulis. published in "Diabetes in Women - Pathophysiology and Therapy". 2010. DOI: 10.1007/978-1-60327-250-6_5; Print ISBN 978-1-60327-249-0; Online ISBN 978-1-60327-250-6. pp 83-103 (http://link.springer.com/chapter/10.1007/978-1-60327-250-6_5)
- ↑ Androgen Excess Disorders in Women: Polycystic Ovary Syndrome and Other Disorders. Contemporary Endocrinology. SpringerLink : Bücher. Author: Ricardo Azziz; Springer, 2007; ISBN 1597451797, 9781597451796.
- ↑ Polycystic ovary syndrome: do endocrine-disrupting chemicals play a role? Barrett ES, Sobolewski M. Semin Reprod Med. 2014 May;32(3):166-76. doi: 10.1055/s-0034-1371088. Epub 2014 Apr 8 (http://www.ncbi.nlm.nih.gov/pubmed/24715511).
- ↑ Bisphenol A and human health: a review of the literature. Rochester JR. Reprod Toxicol. 2013 Dec;42:132-55. doi: 10.1016/j.reprotox.2013.08.008. Epub 2013 Aug 30 (http://www.ncbi.nlm.nih.gov/pubmed/23994667).
- ↑ Bisphenol A in polycystic ovary syndrome and its association with liver-spleen axis. Tarantino G, Valentino R, Di Somma C, D'Esposito V, Passaretti F, Pizza G, Brancato V, Orio F, Formisano P, Colao A, Savastano S. Clin Endocrinol (Oxf). 2013 Mar;78(3):447-53. doi: 10.1111/j.1365-2265.2012.04500.x. (http://www.ncbi.nlm.nih.gov/pubmed/22805002).
- ↑ Phenotypes and enviromental factors: their influence in PCOS. Diamanti-Kandarakis E, Christakou C, Marinakis E. Curr Pharm Des. 2012;18(3):270-82 (http://www.ncbi.nlm.nih.gov/pubmed/22229564).
- ↑ Endocrine-Disrupting Chemicals: Some Actions of POPs on Female Reproduction. Gregoraszczuk EL, Ptak A. Int J Endocrinol. 2013;2013:828532. doi: 10.1155/2013/828532. Epub 2013 May 23. (http://www.ncbi.nlm.nih.gov/pubmed/23762054).
- ↑ a b Efeitos genéticos de drogas na gestação. Chijioke Kevin Obike-AjuluOkeke. Ciências Farmacêuticas. Genética Básica. Brasília, Julho de 2010.
- ↑ Tratamento dos Transtornos Psiquiatricos. Glen O. Gabbard. Editora: Artmed. ISBN 8536318309, 9788536318301, p. 38.
- ↑ Barbieri RL. Polycystic ovary syndrome. ACP Medicine. 2010;1-15.
- ↑ a b Polycystic Ovaries and Polycystic Ovary Syndrome in Epilepsy: Evidence for Neurogonadal Disease. Cynthia L Harden, MD. Epilepsy Curr. Jul 2005; 5(4): 142–146. doi: 10.1111/j.1535-7511.2005.00039.x. (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1198730/).
- ↑ a b The relationship between polycystic ovary syndrome and antiepileptic drugs: a review of the evidence. Rasgon N. J Clin Psychopharmacol. 2004 Jun;24(3):322-34 (http://www.ncbi.nlm.nih.gov/pubmed/15118487).
- ↑ a b A meta-analysis of polycystic ovary syndrome in women taking valproate for epilepsy. Hu X , Wang J , Dong W , Fang Q , Hu L , Liu C. Epilepsy research. 2011 (http://www.epistemonikos.org/pt/documents/e088ad4e92f975983c97618011cac98c08fa7d0f?doc_lang=en).
- ↑ a b c Human Malformations and Related Anomalies. Roger E. Stevenson Director, Judith G. Hall Professor of Pediatrics University of British Columbia. Oxford University Press, 19/10/2005. page 46.
- ↑ a b c Norethindrone (http://glowm.com/resources/glowm/cd/pages/drugs/n032.html).
- ↑ Manual Merck - Saúde para a Família (http://mmspf.msdonline.com.br/pacientes/manual_merck/secao_22/cap_247.html)
- ↑ Dermatologia e gestação. Gilvan Ferreira Alves; Lucas Souza Carmo Nogueira; Tatiana Cristina Nogueira Varella. Anais Brasileiros de Dermatologia. 1806-4841. An. Bras. Dermatol. vol.80 no.2 Rio de Janeiro Mar./Apr. 2005. (http://dx.doi.org/10.1590/S0365-05962005000200009)
- ↑ P.R. Vade-mécum. Danazol. Acesso em 27 de setembro de 2009.
- ↑ Causas raras de pseudo-hermafroditismo feminino: quando suspeitar? Margaret de Castro; Lucila Leico Elias. Arquivos Brasileiros de Endocrinologia & Metabologia. 0004-2730. Arq Bras Endocrinol Metab vol.49 no.1 São Paulo Jan./Feb. 2005 (http://dx.doi.org/10.1590/S0004-27302005000100017).
- ↑ Epigenetic Transgenerational Actions of Endocrine Disruptors and Male Fertility. Matthew D. Anway, Andrea S. Cupp, Mehmet Uzumcu e and Michael K. Skinner. Published in Science 308:5727 (June 3, 2005), pp. 1466–1469; doi 10.1126/science.1108190 (http://www.sciencemag.org/content/308/5727/1466.abstract)
- ↑ Xu N, Kwon S, Abbott DH, Geller DH, Dumesic DA, et al. (2011) Epigenetic Mechanism Underlying the Development of Polycystic Ovary Syndrome (PCOS)-Like Phenotypes in Prenatally Androgenized Rhesus Monkeys. PLoS ONE 6(11): e27286. doi:10.1371/journal.pone.0027286 (http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0027286)
- ↑ Polycystic Ovary Syndrome: Current and Emerging Concepts; Lubna Pal; Editora Springer, 2013; ISBN 1461483948, 9781461483946; página 39.
- ↑ Women at risk: Health problems linked to environmental estrogens. Lindsey Konkel. Environmental Health News. July 31, 2012 (http://www.environmentalhealthnews.org/ehs/news/2012/environmental-chemicals-and-gynecological-disorders).
- ↑ Sexual precocity after immigration from developing countries to Belgium: evidence of previous exposure to organochlorine pesticides. M. Krstevska-Konstantinova, C. Charlier, M. Craen, M. Du Caju, C. Heinrichs, C. de Beaufort, G. Plomteux and J.P. Bourguignon. Human Reproduction (2001) 16 (5): 1020-1026. doi: 10.1093/humrep/16.5.1020 (http://humrep.oxfordjournals.org/content/16/5/1020.short)
- ↑ Urinary levels of insecticide metabolites and DNA damage in human sperm. John D.Meeker; Narendra P.Singh, Louise Ryan, Susan M.Duty, Dana B.Barr, Robert F.Herrick, Deborah H.Bennett and Russ Hauser. Human Reproduction Vol.19, No.11 pp. 2573–2580, 2004. Advance Access publication August 27, 2004. doi:10.1093/humrep/deh444 (http://www.ncbi.nlm.nih.gov/pubmed/15333606).
- ↑ a b Cycle characteristics after discontinuation of oral contraceptives. Gnoth C, Frank-Herrmann P, Schmoll A, Godehardt E, Freundl G. Gynecol Endocrinol 2002:16(4): 307-17. PMID 12396560 [PubMed - indexed for MEDLINE] [5]
- ↑ a b c http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0001408/
- ↑ a b c d e f g h i j k l H Teede; A Deeks; L Moran (30 June 2010). "Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan". BMC Medicine (BioMedCentral) 8: 41. doi:10.1186/1741-7015-8-41. Retrieved 14 November 2011.
- ↑ a b c d e f g h i j Office on Women’s Health in the Office of the Assistant Secretary for Health at the U.S. Department of Health and Human Services (http://www.womenshealth.gov/publications/our-publications/fact-sheet/polycystic-ovary-syndrome.html)
- ↑ Christine Cortet-Rudelli, Didier Dewailly (Sep 21, 2006)."Diagnosis of Hyperandrogenism in Female Adolescents". Hyperandrogenism in Adolescent Girls. Armenian Health Network, Health.am. Retrieved 2006-11-21.
- ↑ a b Huang A, Brennan K, Azziz R (April 2010). "Prevalence of hyperandrogenemia in the polycystic ovary syndrome diagnosed by the National Institutes of Health 1990 criteria". Fertil. Steril. 93 (6): 1938–41.doi:10.1016/j.fertnstert.2008.12.138. PMC 2859983.PMID 19249030.
- ↑ Hiperandrogenismo na síndrome dos ovários policísticos (SOP). Revista Brasileira de Medicina. Hans Wolfgang Halbe; Ângela Maggio da Fonseca; Laudelino de Oliveira Ramos; Carlos Roberto Izzo; Sylvia A. Y. Hayashida. Trabalho realizado no LIM 058, FMUSP. Recebido para publicação em 03/2004. Aceito em 04/2004 (http://www.moreirajr.com.br/revistas.asp?fase=r003&id_materia=2796).
- ↑ a b The Canadian Women’s Health Network (CWHN). Polycystic Ovary Syndrome - PCOS (http://www.cwhn.ca/en/node/44804)
- ↑ a b Nafiye Y, Sevtap K, Muammer D, Emre O, Senol K, Leyla M (April 2010). "The effect of serum and intrafollicular insulin resistance parameters and homocysteine levels of nonobese, nonhyperandrogenemic polycystic ovary syndrome patients on in vitro fertilization outcome". Fertil. Steril. 93 (6): 1864–9.doi:10.1016/j.fertnstert.2008.12.024. PMID 19171332.
- ↑ Fattah NS, Darwish YW. Androgenetic alopecia and insulin resistance - Are they truly associated? Int J Dermatol. 2011:50(4);417-422 (http://www.ncbi.nlm.nih.gov/pubmed/21413951)
- ↑ Preventing Heart Disease When You Have PCOS. Nicole Galan, RN; Updated March 01, 2013 (http://pcos.about.com/od/callingyourdoctor/a/Preventing-Heart-Disease-When-You-Have-Pcos.htm)
- ↑ Is Your Afternoon Slump Caused by PCOS? Polycistic Ovarian Syndrome and Afternoon Fatigue. By Lahle Wolfe (http://womeninbusiness.about.com/od/balancingworkandlife/a/Is-Your-Afternoon-Slump-Caused-By-Pcos.htm).
- ↑ Psoriatic patients have an increased risk of polycystic ovary syndrome: results of a cross-sectional analysis. Moro F1, De Simone C, Morciano A, Tropea A, Sagnella F, Palla C, Scarinci E, Teti A, Caldarola G, D'Agostino M, Mancuso S, Lanzone A, Apa R. (http://www.ncbi.nlm.nih.gov/pubmed/23158933)
- ↑ [6]
- ↑ Balen A, Glass M. Bonnar John, Dunlop William., editors. What's new in polycystic ovary syndrome? Recent Advances in Obstetrics and Gynecology 23. 2005;11:147–158.
- ↑ Familial associations in women with polycystic ovary syndrome. Atiomo WU, El-Mahdi E, Hardiman P Fertil Steril. 2003 Jul; 80(1):143-5.
- ↑ a b c d e Richard Scott Lucidi (25 October 2011). "Polycystic Ovarian Syndrome". eMedicine. Retrieved 19 November 2011 (http://emedicine.medscape.com/article/256806-overview#showall).
- ↑ Goldenberg N, Glueck C (2008). "Medical therapy in women with polycystic ovary syndrome before and during pregnancy and lactation". Minerva Ginecol 60 (1): 63–75.PMID 18277353
- ↑ Boomsma CM, Fauser BC, Macklon NS (2008). "Pregnancy complications in women with polycystic ovary syndrome". Semin. Reprod. Med. 26 (1): 72–84.doi:10.1055/s-2007-992927. PMID 18181085.
- ↑ Troischt MJ, Mehlman TR, and Nield LS (November 1, 2008). "Polycystic Ovary Syndrome: An Intriguing Diagnosis". Consultant for Pediatricians. (http://www.pediatricsconsultantlive.com/)
- ↑ a b c Thozhukat Sathyapalan; Stephen L. Atkin (2010)."Mediators of Inflammation in Polycystic Ovary Syndrome in Relation to Adiposity". Mediators of Inflammation(Hindawi) 2010: 758656. doi:10.1155/2010/758656.PMC 2852606. PMID 20396393 (http://www.hindawi.com/journals/mi/2010/758656/).
- ↑ a b c Fukuoka M, Yasuda K, Fujiwara H, Kanzaki H, Mori T (1992). "Interactions between interferon gamma, tumour necrosis factor alpha, and interleukin-1 in modulating progesterone and oestradiol production by human luteinized granulosa cells in culture". Hum Reprod 7 (10): 1361–4. PMID 1291559 (https://www.ncbi.nlm.nih.gov/pubmed/1291559).
- ↑ a b c d González F, Rote N, Minium J, Kirwan J (2006). "Reactive oxygen species-induced oxidative stress in the development of insulin resistance and hyperandrogenism in polycystic ovary syndrome". J Clin Endocrinol Metab 91 (1): 336–40.doi:10.1210/jc.2005-1696. PMID 16249279 (http://press.endocrine.org/doi/abs/10.1210/jc.2005-1696).
- ↑ a b Murri, Mora; Luque-Ramírez, Manual et al. (2013). "Circulating markers of oxidative stress and polycystic ovary syndrome (PCOS): a systematic review and meta-analysis". Hum. Reprod. Update 19 (3): 268-288. doi:10.1093/humupd/dms059. PMID 23303572 (http://humupd.oxfordjournals.org/content/19/3/268)
- ↑ Polycystic ovaries and the polycystic ovary syndrome phenotype in women with active acromegaly. Kaltsas GA, Androulakis II, Tziveriotis K, Papadogias D, Tsikini A, Makras P, Dimitriou K, Stathopoulou A, Piaditis G. Clinical endocrinology (Oxford). 2007 Dec;67(6):917-22. Epub 2007 Jul 25. (http://www.ncbi.nlm.nih.gov/pubmed/17651451).
- ↑ a b c d e Women with polycystic ovary syndrome are often depressed or anxious--a case control study. Månsson M1, Holte J, Landin-Wilhelmsen K, Dahlgren E, Johansson A, Landén M. Psychoneuroendocrinology. 2008 Sep;33(8):1132-8. doi: 10.1016/j.psyneuen.2008.06.003. Epub 2008 Jul 30. (http://www.ncbi.nlm.nih.gov/pubmed/18672334).
- ↑ a b c d e SYMPTOMS OF PCOS (http://pcos-polycysticovarysyndrome.weebly.com/symptoms.html)
- ↑ a b c Insulin Resistance, Obesity, Inflammation, and Depression in Polycystic Ovary Syndrome: Biobehavioral Mechanisms and Interventions. Kristen Farrell, M.S. and Michael Antoni, Ph.D. Fertil Steril. Author manuscript; available in PMC Oct 1, 2011. Published in final edited form as: Fertil Steril. Oct 2010; 94(5): 1565–1574. Published online May 14, 2010. doi: 10.1016/j.fertnstert.2010.03.081. (http://pubmedcentralcanada.ca/pmcc/articles/PMC2941530/[ligação inativa]).
- ↑ a b c Psychiatric Symptoms in Women with Polycystic Ovary Syndrome. Hatice Harmanci; Sabri Herguner; Harun Toy. Düşünen Adam The Journal of Psychiatry and Neurological Sciences, Volume 26, Number 2, June 2013 (http://www.dusunenadamdergisi.org/ing/DergiPdf/DUSUNEN_ADAM_DERGISI_8d827be673714aca9f60b3e35da5e5d5.pdf).
- ↑ a b Testosterone and mood dysfunction in women with polycystic ovarian syndrome compared to subfertile controls. Barry JA, Hardiman PJ, Saxby BK, Kuczmierczyk A. J Psychosom Obstet Gynaecol. 2011 Jun;32(2):104-11. doi: 10.3109/0167482X.2011.568129. Epub 2011 Apr 7. (http://www.ncbi.nlm.nih.gov/pubmed/21473679).
- ↑ Fundamentals of Sleep Technology. Teofilo Lee-Chiong, M.D. Colaboradores: Cynthia Mattice, Rita Brooks, Teofilo L. Lee-Chiong. Edição: ilustrada. Editora: Lippincott Williams & Wilkins, 2012. ISBN 1451132034, 9781451132038. Page: 171.
- ↑ Impact of Obstructive Sleep Apnea on Insulin Resistance and Glucose Tolerance in Women with Polycystic Ovary Syndrome. Esra Tasali, Eve Van Cauter, Leslie Hoffman, and David A. Ehrmann. Published online Jul 22, 2008. doi: 10.1210/jc.2008-0925 (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2579653/)
- ↑ PCOS and Insomnia. Do You Suffer From PCOS and Sleep Disorders? (http://pcos.com/insomnia-and-pcos.php*.UyxTQPldX4Y[ligação inativa]).
- ↑ a b Prevalence of hyperandrogenism, polycystic ovary syndrome and metabolic syndrome in female-to-male transsexuals. A. Becerra Fernandez, R. Villar, G. Perez Lopez & M. Menacho Roman. Endocrine Abstracts (2012) 29 P957 (http://www.endocrine-abstracts.org/ea/0029/ea0029p957.htm).
- ↑ a b Association between polycystic ovary syndrome and female-to-male transsexuality. Tsuyoshi Baba, Toshiaki Endo, Hiroyuki Honnma, Yoshimitsu Kitajima, Takuhiro Hayashi, Hiroshi Ikeda, Naoya Masumori, Hirofumi Kamiya, Osamu Moriwaka and Tsuyoshi Saito. Human Reproduction Vol.22, No.4 pp. 1011–1016, 2007. Advance Access publication December 13, 2006. doi:10.1093/humrep/del474 (http://humrep.oxfordjournals.org/content/22/4/1011.full.pdf).
- ↑ a b Distinctive features of female-to-male transsexualism and prevalence of gender identity disorder in Japan. Baba T, Endo T, Ikeda K, Shimizu A, Honnma H, Ikeda H, Masumori N, Ohmura T, Kiya T, Fujimoto T, Koizumi M, Saito T. J Sex Med. 2011 Jun;8(6):1686-93. doi: 10.1111/j.1743-6109.2011.02252.x. Epub 2011 Apr 7.PMID 21477021 [PubMed - indexed for MEDLINE]. US National Library of Medicine National Institutes of Health (http://www.ncbi.nlm.nih.gov/pubmed/21477021).
- ↑ a b Female Gender Scheme is Disturbed by Polycystic Ovary Syndrome: A Qualitative Study From Iran. Fatemeh Nasiri Amiri; Fahimeh Ramezani Tehrani; Masoumeh Simbar; Reza Ali Mohammadpour Thamtan; And Niloofar Shiva. Iranian Red Crescent Medical Journal. 16(2): E12423 , DOI: 10.5812/ircmj.12423. Article Type: Research Article; Received: May 22, 2013; Revised: Jul 3, 2013; Accepted: Jul 15, 2013; Epub: Feb 7, 2014; Collection: Feb 2014 (http://ircmj.com/?page=article&article_id=12423)
- ↑ a b c Psychological gender of patients with polycystic ovary syndrome. Kowalczyk R, Skrzypulec V, Lew-Starowicz Z, Nowosielski K, Grabski B, Merk W. Acta Obstet Gynecol Scand. 2012 Mar 24. doi: 10.1111/j.1600-0412.2012.01408.x (http://www.ncbi.nlm.nih.gov/pubmed/22443151)
- ↑ ANORGASMIA - ABC da Saúde http://www.abcdasaude.com.br/artigo.php?747#ixzz2wWRFBe54; ABC da Saúde Informações Médicas Ltda.
- ↑ Correlates of increased lean muscle mass in women with polycystic ovary syndrome. Carmina E, Guastella E, Longo RA, Rini GB, Lobo RA. Eur. Endocrinol. 2009 Oct;161(4):583-9. doi: 10.1530/EJE-09-0398. Epub 2009 Jul 15 (http://www.ncbi.nlm.nih.gov/pubmed/19605540)
- ↑ PCOS and Your Sex Drive: What’s the Connection? (http://www.pcos.com/low-sex-drive-and-pcos/).
- ↑ The association between men’s ratings of women as desirable long-term mates and individual differences in women’s sexual attitudes and behaviors. Lorne Campbell, Lee Cronk, Jeffry A. Simpson, Alison Milroy, Carol L. Wilson, Bria Dunham. Personality and Individual Differences. Volume 46, Issue 4, March 2009, Pages 509–513 (http://www.sciencedirect.com/science/article/pii/S0191886908004510)
- ↑ The Science of Intimate Relationships. Garth Fletcher, Jeffry A. Simpson, Lorne Campbell, Nickola Overall. John Wiley & Sons, 2012. ISBN 1118378733, 9781118378731, p. 134.
- ↑ a b Neck circumference a good predictor of raised insulin and free androgen index in obese premenopausal women: changes with weight loss. Dixon JB, O'Brien PE. Clin Endocrinol (Oxf). 2002 Dec;57(6):769-78. [7]
- ↑ a b Skinny chicks get PCOS too. Corey Whelan (Infertility & Miscarriage Examiner). September 7, 2012 (http://www.examiner.com/article/skinny-chicks-get-pcos-too).
- ↑ a b PCOS Patient Handout on Paper (http://www.jarrettfertility.com/pcds.html).
- ↑ PCOS- Polycystic ovarian syndrome. Jessica Bourke-Natural Fertility Specialist BcL, Dip. Ac, C. Clinical Med., C. Shanghai., Dip. NT, M.BANT, M.TCMCI (http://www.rollercoaster.ie/Article/tabid/156/ArticleName/PCOS_Polycystic_ovarian_syndrome/Default.aspx Arquivado em 7 de abril de 2014, no Wayback Machine.).
- ↑ Crosignani PG, Nicolosi AE (2001). "Polycystic ovarian disease: heritability and heterogeneity". Hum. Reprod. Update 7 (1): 3–7. doi:10.1093/humupd/7.1.3. PMID 11212071.
- ↑ Carmina, E; Koyama, T; Chang, L; Stanczyk, FZ; Lobo, RA (December 1992). "Does ethnicity influence the prevalence of adrenal hyperandrogenism and insulin resistance in polycystic ovary syndrome?". American journal of obstetrics and gynecology 167 (6): 1807–12. PMID 1471702.
- ↑ Vink, J. M.; Sadrzadeh, S.; Lambalk, C. B.; Boomsma, D. I. (junho de 2006). «Heritability of Polycystic Ovary Syndrome in a Dutch Twin-Family Study». The Journal of Clinical Endocrinology & Metabolism (em inglês) (6): 2100–2104. ISSN 0021-972X. doi:10.1210/jc.2005-1494. Consultado em 7 de setembro de 2022
- ↑ a b Carvalho, Laura M. L.; dos Reis, Fernando M.; Candido, Ana Lucia; Nunes, Fernanda F. C.; Ferreira, Claudia N.; Gomes, Karina B. (1 de outubro de 2018). «Polycystic Ovary Syndrome as a systemic disease with multiple molecular pathways: a narrative review». Endocrine Regulations (em inglês) (4): 208–221. ISSN 1336-0329. doi:10.2478/enr-2018-0026. Consultado em 7 de setembro de 2022
- ↑ Marrinan, Greg (20 April 2011). "Imaging in Polycystic Ovary Disease". In Lin, Eugene C. eMedicine. eMedicine. Retrieved 19 November 2011 (http://emedicine.medscape.com/article/404754-overview)
- ↑ Wolf, Jennifer; Barnes, Courtney L.; Aubuchon, Mira (2014). Pal, Lubna, ed. «Polycystic Ovarian Syndrome: A Diagnosis of Exclusion». New York, NY: Springer New York (em inglês): 11–26. ISBN 978-1-4614-8393-9. doi:10.1007/978-1-4614-8394-6_2. Consultado em 7 de setembro de 2022
- ↑ Azziz R (March 2006). "Diagnosis of Polycystic Ovarian Syndrome: The Rotterdam Criteria Are Premature". Journal of Clinical Endocrinology & Metabolism 91 (3): 781–785. doi:10.1210/jc.2005-2153.PMID 16418211 (http://press.endocrine.org/doi/abs/10.1210/jc.2005-2153)
- ↑ a b The Rotterdam ESHRE/ASRM-sponsored PCOS consensus workshop group (2004). "Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS)". Human Reproduction 19 (1): 41–47. doi:10.1093/humrep/deh098.PMID 14688154. Retrieved 14 November 2011 (http://humrep.oxfordjournals.org/content/19/1/41.long).
- ↑ Carmina E (February 2004). "Diagnosis of polycystic ovary syndrome: from NIH criteria to ESHRE-ASRM guidelines.". Minerva ginecologica 56 (1): 1–6.PMID 14973405 (https://www.ncbi.nlm.nih.gov/pubmed/14973405).
- ↑ Hart R, Hickey M, Franks S (October 2004). "Definitions, prevalence and symptoms of polycystic ovaries and polycystic ovary syndrome". Best Practice & Research Clinical Obstetrics & Gynaecology 18 (5): 671–83.doi:10.1016/j.bpobgyn.2004.05.001. PMID 15380140 (https://www.ncbi.nlm.nih.gov/pubmed/15380140).
- ↑ a b c d "Polycystic Ovarian Syndrome Workup". eMedicine. 25 October 2011. Retrieved 19 November 2011. (http://emedicine.medscape.com/article/256806-workup#showall)
- ↑ a b c Legro RS, Kunselman AR, Dodson WC, Dunaif A (1999). "Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a prospective, controlled study in 254 affected women". J. Clin. Endocrinol. Metab. 84 (1): 165–9.doi:10.1210/jc.84.1.165. PMID 9920077 (http://press.endocrine.org/doi/full/10.1210/jcem.84.1.5393?view=long&pmid=9920077)
- ↑ a b Kumar Cotran Robbins: Basic Pathology 6th ed. / Saunders 1996.
- ↑ Kelly, C. J.; Stenton, S. R.; Lashen, H. (2010). "Insulin-like growth factor binding protein-1 in PCOS: a systematic review and meta-analysis". Human Reproduction Update 17(1): 4–16. doi:10.1093/humupd/dmq027. PMID 20634211. (http://humupd.oxfordjournals.org/content/17/1/4)
- ↑ Gleicher N, Weghofer A, Lee IH, Barad DH (2010). "FMR1 Genotype with Autoimmunity-Associated Polycystic Ovary-Like Phenotype and Decreased Pregnancy Chance". In Mailund, Thomas. PLoS ONE 5 (12): e15303.doi:10.1371/journal.pone.0015303. PMC 3002956.PMID 21179569. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3002956/).
- ↑ Veltman-Verhulst SM, Boivin J, Eijkemans MJ, Fauser BJ (2012). "Emotional distress is a common risk in women with polycystic ovary syndrome: a systematic review and meta-analysis of 28 studies". Hum. Reprod. Update 18 (6): 638–51. doi:10.1093/humupd/dms029.PMID 22824735. (http://humupd.oxfordjournals.org/content/18/6/638).
- ↑ a b Moran, LJ; Ko, H; Misso, M; Marsh, K; Noakes, M; Talbot, M; Frearson, M; Thondan, M; Stepto, N; Teede, HJ (2013 Sep-Oct). "Dietary composition in the treatment of polycystic ovary syndrome: a systematic review to inform evidence-based guidelines.". Human reproduction update19 (5): 432. PMID 23727939. (https://www.ncbi.nlm.nih.gov/pubmed/23727939).
- ↑ a b c d e f g h i j k "Polycystic Ovarian Syndrome Treatment & Management". eMedicine. 25 October 2011. Retrieved 19 November 2011. (http://emedicine.medscape.com/article/256806-treatment#showall).
- ↑ a b Carvalho, Laura M. L.; Ferreira, Cláudia N.; Candido, Ana L.; Reis, Fernando M.; Sóter, Mirelle O.; Sales, Mariana F.; Silva, Ieda F. O.; Nunes, Fernanda F. C.; Gomes, Karina Braga (outubro de 2017). «Metformin reduces total microparticles and microparticles-expressing tissue factor in women with polycystic ovary syndrome». Archives of Gynecology and Obstetrics (em inglês) (4): 617–621. ISSN 0932-0067. doi:10.1007/s00404-017-4471-0. Consultado em 8 de setembro de 2022
- ↑ Lord JM, Flight IHK, Norman RJ (2003). "Metformin in polycystic ovary syndrome: systematic review and meta-analysis". BMJ 327 (7421): 951–3.doi:10.1136/bmj.327.7421.951. PMC 259161.PMID 14576245. (http://www.bmj.com/content/327/7421/951).
- ↑ As glitazonas duplicam o risco de fractura óssea nas mulheres. Comentário à meta-análise "Long-term use of thiazolidinediones and fractures in type 2 diabetes". Por Carla Lopes da Mota, Mariana Morais, Helena Beça (CS de Espinho). MGFamiliar . - Saturday, March 20, 2010 (http://www.mgfamiliar.net/_blog/Prescri%C3%A7%C3%A3o_Racional/post/As_glitazonas_duplicam_o_risco_de_fractura_ossea_nas_mulheres/).
- ↑ National Institute for Health and Clinical Excellence. 11 Clinical guideline 11 : Fertility: assessment and treatment for people with fertility problems . London, 2004. (http://guidance.nice.org.uk/CG).
- ↑ Balen A (December 2008). "Metformin therapy for the management of infertility in women with polycystic ovary syndrome" (PDF). Scientific Advisory Committee Opinion Paper 13. Royal College of Obstetricians and Gynaecologists. Retrieved 2009-12-13. (http://www.rcog.org.uk/files/rcog-corp/uploaded-files/SAC13metformin-minorrevision.pdf Arquivado janeiro 30, 2012 no WebCite ).
- ↑ Leeman L, Acharya U (August 2009). "The use of metformin in the management of polycystic ovary syndrome and associated anovulatory infertility: the current evidence".J Obstet Gynaecol 29 (6): 467–72.doi:10.1080/01443610902829414. PMID 19697191. (http://informahealthcare.com/doi/abs/10.1080/01443610902829414).
- ↑ Qiao, J.; Feng, H. L. (2010). "Extra- and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence".Human Reproduction Update 17 (1): 17.doi:10.1093/humupd/dmq032. PMC 3001338.PMID 20639519. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3001338/).
- ↑ Hidratos de carbono. Carbs & Cals. (http://www.carbsandcals.com/pt-pt/nutrition/carb-counting Arquivado em 8 de abril de 2014, no Wayback Machine.)
- ↑ Legro RS, Barnhart HX, Schlaff WD (2007). "Clomiphene, Metformin, or Both for Infertility in the Polycystic Ovary Syndrome". N Engl J Med 356 (6): 551–66. doi:10.1056/NEJMoa063971. PMID 17287476. (http://www.nejm.org/doi/full/10.1056/NEJMoa063971).
- ↑ a b Informe SNVS/Anvisa/Nuvig/GFARM nº 01, de 29 de janeiro de 2013 (http://portal.anvisa.gov.br/wps/wcm/connect/95bd54804e5c8bdc930adfd762e8a5ec/Informe_Diane35_29012013.pdf?MOD=AJPERES Arquivado em 7 de abril de 2014, no Wayback Machine.).
- ↑ "Polycystic ovary syndrome – Treatment". United Kingdom: National Health Service. 17 October 2011. Retrieved 19 November 2011. (http://www.nhs.uk/Conditions/Polycystic-ovarian-syndrome/Pages/Treatment.aspx).
- ↑ "What are the health risks of PCOS?". Verity – PCOS Charity. Verity. 2011. Retrieved 21 November 2011 (http://www.verity-pcos.org.uk/guide_to_pcos/what_is_pcos/health_risks Arquivado em 2012-12-25 na Archive.today).
- ↑ a b c d Role of Surgery in the Management of PCOS: Rationale and Considerations for Bariatric Surgery. Héctor F. Escobar-Morreale; Book Title: Polycystic Ovary Syndrome; Subtitle: Current and Emerging Concepts; Part V; Pages: pp 277-288; Copyright: 2014; DOI: 10.1007/978-1-4614-8394-6_17; Print ISBN 978-1-4614-8393-9; Online ISBN 978-1-4614-8394-6; Publisher: Springer New York. (http://link.springer.com/chapter/10.1007/978-1-4614-8394-6_17).
- ↑ DIAGNÓSTICO E TRATAMENTO DO OVÁRIO POLICÍSTICO COM AUXILIO DA VIDEOLAPAROSCOPIA (http://laparoscopiaginecologica.net.br/2013/07/diagnostico-e-tratamento-do-ovario-policistico-com-auxilio-da-videolaparoscopia/).
- ↑ Felemban A, Tan SL, Tulandi T. Laparoscopic treatment of polycystic ovaries with insulated needle cautery: a reappraisal. Fertil Steril. 2000; 73:266-269.
- ↑ a b SURGICAL MANAGEMENT OF POLYCYSTIC OVARIAN SYNDROME. Sumathi Kotikela, MD, Michelle Tham, Alan B. Copperman, Lin Lin, MD, Michael Sellin. (http://laparoscopy.blogs.com/prevention_management_3/2010/11/surgical-management-of-polycystic-ovarian-syndrome.html)
- ↑ a b Surgical Management of Polycystic Ovary Syndrome: A Contemporary Viewpoint on Place of Ovarian Surgery in PCOS Management. Phoebe H. Leonard M.D.; Jani R. Jensen M.D.; Gaurang S. Daftary M.D.; Book Title: Polycystic Ovary Syndrome; Subtitle: Current and Emerging Concepts; Part V; Pages: pp 289-299; Copyright: 2014; DOI: 10.1007/978-1-4614-8394-6_17; Print ISBN 978-1-4614-8393-9; Online ISBN 978-1-4614-8394-6; Publisher: Springer New York. (http://link.springer.com/chapter/10.1007/978-1-4614-8394-6_17).
- ↑ Drauzio Varella explica síndrome dos ovários policísticos e mioma (http://www.febrasgo.org.br/site/?p=7738 Arquivado em 7 de abril de 2014, no Wayback Machine.).
- ↑ Galazis, N; Galazi, M; Atiomo, W (April 2011). "D-Chiro-inositol and its significance in polycystic ovary syndrome: a systematic review". Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology 27 (4): 256–62.doi:10.3109/09513590.2010.538099. PMID 21142777. (http://informahealthcare.com/doi/abs/10.3109/09513590.2010.538099).
- ↑ Unfer, V; Carlomagno, G; Dante, G; Facchinetti, F (July 2012). "Effects of myo-inositol in women with PCOS: a systematic review of randomized controlled trials".Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology 28(7): 509–15. doi:10.3109/09513590.2011.650660.PMID 22296306. (http://informahealthcare.com/doi/abs/10.3109/09513590.2011.650660).
- ↑ a b c Diagnostic Criteria and Epidemiology of PCOS; Heather R. Burks and Robert A. Wild; Book Title: Polycystic Ovary Syndrome; Subtitle: Current and Emerging Concepts; Part I; Pages: pp 03-10; Copyright: 2014; DOI: 10.1007/978-1-4614-8394-6_17; Print ISBN 978-1-4614-8393-9; Online ISBN 978-1-4614-8394-6; Publisher: Springer New York. (http://link.springer.com/chapter/10.1007/978-1-4614-8394-6_17).
- ↑ Agrawal R, Sharma S, Bekir J, Conway G, Bailey J, Balen AH, Prelevic G. (2004). "Prevalence of polycystic ovaries and polycystic ovary syndrome in lesbian women compared with heterosexual women". J Fertil Steril 82 (5): 1352–1357.doi:10.1016 / j.fertnstert.2004.04.041. PMID 15533359 (http://www.fertstert.org/article/S0015-0282(04)02227-7/abstract)[ligação inativa].
- ↑ BBC Brasil. Pesquisa liga lesbianismo a hormônios (http://www.bbc.co.uk/portuguese/ciencia/story/2003/06/030630_lesbicacs.shtml).
- ↑ a b Office on Women’s Health in the Office of the Assistant Secretary for Health at the U.S. Department of Health and Human Service. Lesbian and bisexual health fact sheet. Polycystic Ovary Syndrome (PCOS). (http://womenshealth.gov/publications/our-publications/fact-sheet/lesbian-bisexual-health.html).
- ↑ Hormone imbalance more common in lesbians (http://www.abc.net.au/science/news/health/HealthRepublish_892229.htm).
Leitura adicional
editar- Marija Kundakovic and Frances A. Champagne. Brain Behav Immun; available in PMC Jul 7, 2013. Published in final edited form as: Brain Behav Immun. Aug 2011; 25(6): 1084–1093. Published online Feb 17, 2011. doi: 10.1016/j.bbi.2011.02.005. PMCID: PMC3703316. NIHMSID: NIHMS484825 (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3703316/)
- Sex-specific epigenetic disruption and behavioral changes following low-dose in utero bisphenol A exposure. Marija Kundakovica, Kathryn Gudsnuka, Becca Franksa, Jesus Madrida, Rachel L. Millerb, Frederica P. Pererab, and Frances A. Champagnea. Published in PNAS (Proceedings of the National Academy of Sciences of the United States of America). Published online before print December 24, 2012, doi: 10.1073/pnas.1220230110. PNAS December 24, 2012. (http://www.pnas.org/content/early/2013/05/24/1214056110).
- Gestational exposure to bisphenol a produces transgenerational changes in behaviors and gene expression. Wolstenholme JT, Edwards M, Shetty SR, Gatewood JD, Taylor JA, Rissman EF, Connelly JJ. Endocrinology. 2012 Aug;153(8):3828-38. doi: 10.1210/en.2012-1195. Epub 2012 Jun 15 (http://www.ncbi.nlm.nih.gov/pubmed/22707478).
- Transgenerational effects of prenatal bisphenol A on social recognition. Wolstenholme JT, Goldsby JA, Rissman EF. Horm Behav. 2013 Nov;64(5):833-9. doi: 10.1016/j.yhbeh.2013.09.007. Epub 2013 Oct 5 (http://www.ncbi.nlm.nih.gov/pubmed/24100195).