Rede de modo padrão
Na neurociência, a rede de modo padrão (DMN, do inglês Default Mode Network, ou RMP), também rede padrão, ou rede cerebral padrão, é uma rede cerebral de larga escala de regiões do cérebro em interação, conhecidas por terem atividade altamente correlacionada entre si e distinta de outras redes no cérebro.[3]
| Rede de Modo Padrão | |
|---|---|
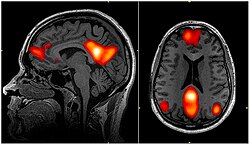 Imagem de fMRI mostrando regiões da rede de modo padrão |
Foi inicialmente assumido que a rede de modo padrão estaria mais comumente ativa quando uma pessoa não está focada no mundo exterior e o cérebro está de repouso mas em vigília, como ao "sonhar acordado" e durante divagação mental. No entanto, agora se sabe que ela pode contribuir para elementos da experiência relacionados ao desempenho de tarefas externas.[4] Também é ativa quando o indivíduo está pensando nos outros, pensando em si mesmo, lembrando-se do passado e planejando o futuro.[3][5] Embora a DMN tenha sido originalmente observada como estando desativada em certas tarefas orientadas a objetivos e às vezes seja chamada de rede negativa à tarefa (task-negative),[6] ela pode estar ativa em outras tarefas orientadas a objetivos, como memória de trabalho social ou tarefas autobiográficas.[7] A DMN demonstrou estar correlacionada negativamente com outras redes no cérebro, como as redes de atenção.[8]
As evidências apontam para disfunções na DMN de pessoas com Alzheimer e transtorno do espectro do autismo.[3]
História
editarHans Berger, o inventor do eletroencefalograma, foi o primeiro a propor a ideia de que o cérebro está constantemente ocupado. Em uma série de artigos publicados em 1929, ele mostrou que as oscilações elétricas detectadas por seu dispositivo não cessam, mesmo quando o sujeito está em repouso. No entanto, suas ideias não foram levadas a sério, e uma percepção geral se formou entre os neurologistas de que somente quando uma atividade focada é realizada é que o cérebro (ou parte do cérebro) se torna ativo.[9]
Mas na década de 1950, Louis Sokoloff e seus colegas notaram que o metabolismo no cérebro permaneceu o mesmo quando uma pessoa passou de um estado de repouso para realizar problemas matemáticos de esforço, sugerindo que o metabolismo ativo no cérebro também deveria estar ocorrendo durante o descanso.[3] Na década de 1970, Ingvar e colegas observaram que o fluxo sanguíneo na parte frontal do cérebro se tornava o mais alto quando uma pessoa está em repouso. Na mesma época, comportamento oscilatório intrínseco nos neurônios de vertebrados foi observado nas células cerebelares de Purkinje, no núcleo olivar inferior e no tálamo.[10]
Na década de 1990, com o advento da tomografia por emissão de pósitrons (PET), os pesquisadores começaram a perceber que quando uma pessoa está envolvida em tarefas de percepção, linguagem e atenção, as mesmas áreas do cérebro se tornam menos ativas em comparação ao repouso passivo, e rotularam essas áreas como se tornando "desativadas".[3]
Em 1995, Bharat Biswal, um estudante de graduação da Faculdade de Medicina de Wisconsin em Milwaukee, descobriu que o sistema sensóriomotor humano exibia "conectividade em estado de repouso", exibindo sincronicidade nas imagens de ressonância magnética funcional (fMRI) enquanto não estava envolvido em nenhuma tarefa.[11][12]
Mais tarde, experimentos do laboratório do neurologista Marcus E. Raichle, na Escola de Medicina da Universidade de Washington e de outros grupos[13] mostraram que o consumo de energia do cérebro aumenta em menos de 5% do consumo inicial de energia enquanto executa uma tarefa mental focada. Esses experimentos mostraram que o cérebro está constantemente ativo com um alto nível de atividade, mesmo quando a pessoa não está envolvida no trabalho mental focado. A partir de então, a pesquisa se concentrou em encontrar as regiões responsáveis por esse nível constante de atividade em segundo plano.[9]
Raichle cunhou o termo "modo padrão" em 2001 para descrever a função cerebral em estado de repouso;[14] o conceito rapidamente se tornou um tema central na neurociência.[15] Por essa época, foi desenvolvida a ideia de que essa rede de áreas do cérebro esteja envolvida em pensamentos direcionados internamente e seja suspensa durante comportamentos específicos direcionados a objetivos. Em 2003, Greicius e colegas examinaram os exames de ressonância magnética em estado de repouso e analisaram a correlação entre diferentes seções do cérebro. Seus mapas de correlação destacaram as mesmas áreas já identificadas pelos outros pesquisadores.[16] Isso foi importante porque demonstrou uma convergência de métodos, todos levando às mesmas áreas envolvidas na DMN. Desde então, outras redes de estado de repouso (RSNs) foram encontradas, como redes visuais, auditivas e de atenção. Algumas delas são frequentemente anticorrelacionadas com a rede de modo padrão.[8]
No início aos meados dos anos 2000, as pesquisas rotularam a rede de modo padrão como a rede negativa à tarefa,[6] porque era desativada quando os participantes precisavam realizar tarefas. Pensava-se que a DMN estaria ativa apenas durante o descanso passivo e depois desligada durante tarefas direcionadas a objetivos com foco externo. No entanto, estudos demonstraram que a DMN é ativa em tarefas externas direcionadas a objetivos, conhecidas por envolver a DMN, como memória de trabalho social ou tarefas autobiográficas.[7]
Por volta de 2007, o número de documentos referentes à rede em modo padrão disparou.[17] Em todos os anos anteriores a 2007, havia 12 artigos publicados que referenciavam “default mode network” ou “default network” no título, no entanto, entre 2007 e 2014, havia 1384 artigos publicados. Uma razão para o aumento de artigos é o resultado do efeito robusto de ter se encontrado a DMN com imagens de estado de repouso e análise de componentes independentes (ICA).[13][18] Outro motivo é que a DMN pode ser medida com uma varredura curta e fácil imageamento de estado de repouso, o que significa que pode ser realizada em qualquer população, incluindo crianças pequenas, populações clínicas e primatas não humanos.[3] Uma terceira razão é que o papel da DMN foi expandido para mais do que apenas uma rede cerebral passiva.
Função
editarA rede de modo padrão é conhecida por estar envolvida em muitas funções aparentemente diferentes:
É a base neurológica para o eu:[17]
- Informação autobiográfica: Memórias de coleção de eventos e fatos sobre si mesmo
- Autorreferência: Referir-se a características e descrições de si mesmo
- Emoção de si mesmo: Refletir sobre o próprio estado emocional
Pensar nos outros:[17]
- Teoria da mente: Pensar nos pensamentos dos outros e no que eles podem ou não saber
- Emoções de outros: Compreender as emoções de outras pessoas e empatizar com seus sentimentos
- Raciocínio moral: determinar o resultado justo e injusto de uma ação
- Avaliações sociais: Julgamentos de boas e más atitudes sobre conceitos sociais
- Categorias sociais: Refletir sobre importantes características sociais e status de um grupo
Lembrar o passado e pensar no futuro:[17]
- Lembrar o passado: Relembrar eventos que aconteceram no passado
- Imaginar o futuro: Visualizar eventos que podem acontecer no futuro
- Memória episódica: Memória detalhada relacionada a eventos específicos no tempo
- Compreensão da história: Compreender e lembrar uma narrativa
A rede de modo padrão fica ativa durante o repouso passivo e a divagação mental[3] que geralmente envolve pensar nos outros, pensar em si mesmo, lembrar-se do passado e visualizar o futuro, e não a tarefa que está sendo executada.[17] Trabalhos recentes, no entanto, desafiaram um mapeamento específico entre a rede de modo padrão e a divagação, uma vez que o sistema é importante na manutenção de representações detalhadas das informações da tarefa durante a codificação da memória de trabalho.[19] Estudos de eletrocorticografia (que envolvem colocar eletrodos na superfície do couro cabeludo de um sujeito) mostraram que a rede de modo padrão é ativada em uma fração de segundo após os participantes terminarem uma tarefa.[20] Além disso, durante tarefas que exigem atenção, a desativação suficiente da rede de modo padrão no momento da codificação da memória mostrou resultar em uma consolidação de memória de longo prazo mais bem-sucedida.[21]
Estudos mostraram que quando as pessoas assistem a um filme,[22] ouvem uma história,[23] ou lêem uma história,[24] suas DMNs estão altamente correlacionadas entre si. As DMNs não são correlacionadas se as histórias forem embaralhadas ou estiverem em um idioma que a pessoa não entende, sugerindo que a rede está altamente envolvida na compreensão e na subsequente formação de memória dessa história. A DMN é mostrada até mesmo sendo correlacionada se a mesma história for apresentada a pessoas diferentes em diferentes idiomas,[25] sugerindo ainda que a DMN esteja realmente envolvida no aspecto de compreensão da história e não no aspecto auditivo ou de linguagem.
A rede de modo padrão mostrou-se desativada durante tarefas externas orientadas a objetivos, como atenção visual ou tarefas de memória de trabalho cognitiva, levando alguns pesquisadores a rotular a rede como a rede negativa à tarefa.[6] No entanto, quando as tarefas são tarefas externas orientadas a objetivos conhecidas por serem uma função da DMN, como memória social de trabalho ou uma tarefa autobiográfica, a DMN é ativada positivamente com a tarefa e correlacionada com outras redes, como a rede envolvida na função executiva.[7]
Uma possibilidade até então insuspeita é que a rede padrão seja ativada pela imobilização inerente ao procedimento de teste (o paciente é preso em supino em uma maca e inserido por um túnel estreito em uma estrutura metálica maciça). Esse procedimento cria uma sensação de aprisionamento e, sem surpresa, o efeito colateral mais comum é a claustrofobia. Essa visão alternativa é sugerida por um artigo recente que vincula teoria da mente à imobilização.[26]
Uma pesquisa recente mostrou que a DMN está relacionada à percepção da beleza, em que a rede se torna ativa de forma generalizada ante a visão de campos esteticamente comoventes, como obras de arte, paisagens e arquitetura. Isso explicaria uma sensação interna profunda de prazer relacionada à estética interligada ao senso de identidade pessoal, devido as funções da rede relacionadas ao self.[27]
Anatomia
editarA rede de modo padrão é um conjunto de regiões cerebrais interconectadas e definidas anatomicamente.[3] A rede pode ser separada em hubs e subseções:
Hubs funcionais:[29] Informações sobre o si mesmo
- Córtex cingulado posterior (CCP) e pré-cúneo: combina atenção de baixo para cima (bottom-up, não controlada) com informações da memória e da percepção. A parte ventral (inferior) do PCC é ativada em todas as tarefas que envolvem o DMN, incluindo aquelas relacionadas ao self, relacionadas aos outros, lembrando-se do passado, pensando no futuro e conceitos de processamento, além de navegação espacial. A parte dorsal (superior) do CCP envolve conscientização e excitação involuntárias. O precuneus está envolvido em informações visuais, sensório-motoras e atencionais.
- Córtex pré-frontal medial (CPFm) : Decisões sobre autoprocessamento, como informações pessoais, memórias autobiográficas, objetivos e eventos futuros e tomada de decisão em relação a pessoas muito próximas, como a família. A parte ventral (inferior) está envolvida em informações emocionais positivas e recompensas valorizadas internamente.
- Giro angular: conecta percepção, atenção, cognição espacial e ação e ajuda com partes da recuperação de memórias episódicas
Subsistema medial dorsal: [29] Pensar nos outros
- Hubs funcionais: CCP, mPFC e giro angular
- Córtex pré-frontal medial dorsal (dmPFC): Envolvido no pensamento social direcionado, como determinar ou inferir o objetivo das ações de outras pessoas
- Junção temporoparietal (JTP): Reflete sobre crenças sobre os outros, o que também é conhecido como teoria da mente
- Córtex temporal lateral: Recobra o conhecimento social semântico e conceitual
- Polo temporal anterior: Informações conceituais abstratas de natureza particularmente social
Subsistema temporal medial:[29] Memória autobiográfica e simulações futuras
- Hubs funcionais: CCP, mPFC e giro angular
- Hipocampo (HF+): Formação de novas memórias, além de lembrar o passado e imaginar o futuro
- Parahipocampo (APS): Reconhecimento e simulação espacial e de cenas
- Córtex retroesplenial (RSC): Navegação espacial
- Lobo parietal inferior posterior (PIPL): Junção de informações e atenção auditivas, visuais e somatossensoriais
A rede de modo padrão é mais comumente definida com os dados do estado de repouso, colocando-se uma "semente" no córtex cingulado posterior e examinando quais outras áreas do cérebro se correlacionam mais com essa área.[16] A DMN também pode ser definida pelas áreas desativadas durante tarefas externas direcionadas em comparação com o repouso.[14] A análise de componentes independentes (ICA) encontra de maneira robusta a DMN para indivíduos e entre grupos e se tornou a ferramenta padrão para mapear a rede padrão.[13][18]
Foi demonstrado que a rede de modo padrão exibe a maior sobreposição em sua conectividade estrutural e funcional, o que sugere que a arquitetura estrutural do cérebro pode estar construída de tal maneira que essa rede específica seja ativada por padrão.[1] Evidências recentes de um estudo populacional de imagem cerebral de 10000 participantes do UK Biobank sugerem ainda que cada nó da DMN pode ser decomposto em sub-regiões com propriedades estruturais e funcionais complementares. Tem sido uma prática generalizada na pesquisa da DMN tratar seus nós constituintes como funcionalmente homogêneos, mas a distinção entre subnós dentro de cada nó principal da DMN foi negligenciada. No entanto, a estreita proximidade dos subnós que propagam eferências da organização de espaço-tempo (das memórias) no hipocampo e subnós que descrevem a arquitetura da rede global pode permitir funções padrão, como recordação autobiográfica ou pensamento internamente orientado.[30]
No cérebro infantil, há evidências limitadas da rede padrão, mas a conectividade de rede padrão é mais consistente em crianças de 9 a 12 anos, sugerindo que a rede padrão passa por mudanças no desenvolvimento.[8]
A análise de conectividade funcional em macacos mostra uma rede de regiões semelhante à rede de modo padrão vista em humanos.[3] O CCP também é um hub principal em macacos; no entanto, o CPFm é menor e menos bem conectado a outras regiões do cérebro, principalmente porque o CPFm humano é muito maior e bem desenvolvido.
A ressonância magnética de difusão mostra tratos de substância branca que conectam diferentes áreas da DMN.[17] As conexões estruturais encontradas na ressonância magnética por difusão e as correlações funcionais da fMRI de estado de repouso mostram o maior nível de sobreposição e concordância nas áreas da DMN.[1] Isso fornece evidências de que os neurônios nas regiões da DMN estão ligados entre si por meio de grandes extensões de axônios e isso faz com que a atividade nessas áreas se correlacione.
Fisiopatologia
editarFoi sugerido que a rede de modo padrão é relevante para distúrbios incluindo doença de Alzheimer, autismo, esquizofrenia, depressão, dor crônica, transtorno de estresse pós-traumático e outros.[3][31] Em particular, também foi relatado que a DMN mostra padrões de atividade neural sobrepostos, embora distintos, em diferentes condições de saúde mental, como ao comparar diretamente o déficit de atenção com hiperatividade e autismo.[32]
Pessoas com doença de Alzheimer mostram uma redução na glicose (uso de energia) nas áreas da rede de modo padrão.[3] Essas reduções começam com pequenas diminuições em pacientes leves e continuam a grandes reduções em pacientes graves. Surpreendentemente, as interrupções na DMN começam antes mesmo de os indivíduos mostrarem sinais da doença de Alzheimer. Gráficos do peptídeo beta amiloide, que supostamente causa a doença de Alzheimer, mostram que o acúmulo do peptídeo está dentro da DMN. Isso levou Randy Buckner e colegas a propor que a alta taxa metabólica da ativação contínua da DMN faça com que mais peptídeo beta amiloide se acumule nessas áreas de DMN. Esses peptídeos beta amiloides perturbam a rede e, como a DMN está fortemente envolvida na formação e recuperação da memória, essa interrupção leva aos sintomas da doença de Alzheimer.
Pensa-se que a DMN esteja com disrupção em indivíduos com transtorno do espectro autista.[3][33] Esses indivíduos são prejudicados na interação e comunicação social, tarefas centrais nessa rede. Estudos têm mostrado piores conexões entre áreas da DMN em indivíduos com autismo, especialmente entre o mPFC (envolvido no pensamento sobre si e os outros) e o CPP (o núcleo central do DMN).[34][35] Quanto mais grave o autismo, menos conectadas essas áreas são entre si. Não está claro se isso é causa ou resultado de autismo.
Uma menor conectividade entre as regiões do cérebro foi encontrada na rede padrão em pessoas que sofreram trauma a longo prazo, como abuso ou negligência na infância, e está associada a padrões de ligação disfuncional. Entre as pessoas que sofrem de transtorno de estresse pós-traumático, foi encontrada menor ativação no giro cingulado posterior em comparação aos controles, e o TEPT grave foi caracterizado por menor conectividade na DMN.[31][36] A hiperconectividade da rede padrão tem sido associada à ruminação na depressão em primeiro episódio[37] e à dor crônica.[38] Se a rede de modo padrão for alterada, isso poderá mudar a maneira como se percebe os eventos e seu raciocínio social e moral, tornando a pessoa mais suscetível a sintomas depressivos graves.[39]
A análise multivariada revela associações genéticas da DMN de repouso no transtorno bipolar psicótico e na esquizofrenia.[40]
Modulação
editarA rede de modo padrão (DMN) pode ser modulada pelas seguintes intervenções e processos:
- Acupuntura – Desativação das áreas cerebrais límbicas e da DMN.[41] Foi sugerido que isso se deve à resposta à dor.[42]
- Meditação – Alterações estruturais em áreas da DMN, como junção temporoparietal, córtex cingulado posterior e pre-cúneo, foram encontradas em praticantes de meditação. Há ativação reduzida e conectividade funcional reduzida da DMN em praticantes de longo prazo.[43] Várias formas de meditação não-diretiva, incluindo Meditação Transcendental[44] e Meditação Acem,[45] foram encontradas para ativar a DMN.
- Dormir e vigília em repouso
- Vigilância em repouso – A conectividade funcional entre os nós da DMN é forte.[46]
- Início do sono - Diminuição da conectividade entre a DMN e a rede positiva à tarefa.
- Estágio N2 do sono NREM - Diminuição da conectividade entre o córtex cingulado posterior e o córtex pré-frontal medial.
- Estágio N3 do sono NREM – Diminuição adicional da conectividade entre o CPP e o CPFm.
- Sono REM – Possível aumento na conectividade entre os nós da DMN.
- Privação de sono - A conectividade funcional entre os nós da DMN em seu estado de repouso é geralmente forte, mas a privação do sono resulta em uma diminuição da conectividade na DMN.[47] Estudos recentes sugerem uma diminuição na conectividade entre a DMN e a rede positiva à tarefa como resultado da perda de sono.[48]
- Drogas psicodélicas - Foi observado fluxo sanguíneo reduzido para o CPP e o CPFm sob a administração de psilocibina. Essas duas áreas são consideradas os principais nós da DMN.[49] Um estudo sobre os efeitos do LSD demonstrou que a droga dessincroniza a atividade cerebral na DMN; a atividade das regiões do cérebro que constituem a DMN se torna menos correlacionada.[50]
- Estimulação cerebral profunda - Alterações na atividade cerebral com estimulação cerebral profunda podem ser usadas para equilibrar as redes de estado em repouso.[51]
- Psicoterapia - No TEPT, as anormalidades na rede de modo padrão normalizam em indivíduos que respondem a intervenções de psicoterapia.[52][53]
- Antidepressivos - Alterações na conectividade da DMN são reduzidas após o tratamento com medicamentos antidepressivos no TEPT.
Crítica
editarAlguns argumentaram que as áreas do cérebro na rede de modo padrão só aparecem juntas por causa do acoplamento vascular de grandes artérias e veias no cérebro perto dessas áreas, não porque essas áreas estejam realmente funcionalmente conectadas umas às outras. O suporte para esse argumento vem de estudos que mostram que a mudança na respiração altera os níveis de oxigênio no sangue, que por sua vez afeta mais a DMN.[3] Esses estudos, no entanto, não explicam por que a DMN também pode ser identificado usando exames de PET medindo o metabolismo da glicose independente do acoplamento vascular e em estudos de eletrocorticografia[54] medindo a atividade elétrica na superfície do cérebro. Também na MEG, medindo-se campos magnéticos associados com a atividade eletrofisiológica do cérebro que contorna a resposta hemodinâmica.[55]
A ideia de uma "rede padrão" não é universalmente aceita.[56] Em 2007, o conceito de modo padrão foi criticado por não ser útil para entender a função cerebral, com base em uma hipótese mais simples: o cérebro em repouso efetua mais processamento do que o cérebro realizando determinadas tarefas "exigentes" e não há significado especial para a atividade intrínseca do cérebro em repouso.[57]
Ver também
editarReferências
- ↑ a b c «The structural-functional connectome and the default mode network of the human brain». NeuroImage. 102. PMID 24099851. doi:10.1016/j.neuroimage.2013.09.069
- ↑ «Aberrant default mode functional connectivity in schizophrenia». Am. J. Psychiatry. 164. PMID 17329470. doi:10.1176/ajp.2007.164.3.450
- ↑ a b c d e f g h i j k l m «The Brain's Default Network: Anatomy, Function, and Relevance to Disease». Annals of the New York Academy of Sciences. 1124. CiteSeerX 10.1.1.689.6903 . PMID 18400922. doi:10.1196/annals.1440.011
- ↑ «Default mode network can support the level of detail in experience during active task states». Proceedings of the National Academy of Sciences. 115. PMC 6140531 . PMID 30150393. doi:10.1073/pnas.1721259115
- ↑ Lieberman, Matthew (2 de setembro de 2016). Social. [S.l.: s.n.] ISBN 978-0-307-88910-2
- ↑ a b c «The human brain is intrinsically organized into dynamic, anticorrelated functional networks». Proceedings of the National Academy of Sciences of the United States of America. 102. ISSN 0027-8424. PMC 1157105 . PMID 15976020. doi:10.1073/pnas.0504136102
- ↑ a b c «The fallacy of a "task-negative" network». Frontiers in Psychology. 3. ISSN 1664-1078. PMC 3349953 . PMID 22593750. doi:10.3389/fpsyg.2012.00145
- ↑ a b c «Default-mode brain dysfunction in mental disorders: A systematic review». Neuroscience & Biobehavioral Reviews. 33. PMID 18824195. doi:10.1016/j.neubiorev.2008.09.002
- ↑ a b «The Brain's Dark Energy». Scientific American. 302. doi:10.1038/scientificamerican0310-44
- ↑ «Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective». Front Cell Neurosci. 8. PMC 4219458 . PMID 25408634. doi:10.3389/fncel.2014.00320
- ↑ «Functional connectivity in the motor cortex of resting human brain using echoplanar MRI.». Magn Reson Med. 34. PMID 8524021. doi:10.1002/mrm.1910340409
- ↑ «Core Concepts: Resting State Connectivity». Proceedings of the National Academy of Sciences. 112. PMC 4655520 . PMID 26578753. doi:10.1073/pnas.1518785112
- ↑ a b c «Independent component analysis of nondeterministic fMRI signal sources». NeuroImage. 19. PMID 12814576. doi:10.1016/S1053-8119(03)00097-1
- ↑ a b «Inaugural Article: A default mode of brain function». Proceedings of the National Academy of Sciences. 98. PMC 14647 . PMID 11209064. doi:10.1073/pnas.98.2.676
- ↑ «A default mode of brain function: A brief history of an evolving idea». NeuroImage. 37. PMID 17719799. doi:10.1016/j.neuroimage.2007.02.041
- ↑ a b «Functional connectivity in the resting brain: a network analysis of the default mode hypothesis». Proceedings of the National Academy of Sciences of the United States of America. 100. ISSN 0027-8424. PMC 140943 . PMID 12506194. doi:10.1073/pnas.0135058100
- ↑ a b c d e f «The brain's default network and its adaptive role in internal mentation». The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 18. ISSN 1089-4098. PMC 3553600 . PMID 21677128. doi:10.1177/1073858411403316
- ↑ a b «fMRI resting state networks define distinct modes of long-distance interactions in the human brain». NeuroImage. 29. PMID 16260155. doi:10.1016/j.neuroimage.2005.08.035
- ↑ «Default mode network can support the level of detail in experience during active task states». Proceedings of the National Academy of Sciences. 115. ISSN 0027-8424. PMC 6140531 . PMID 30150393. doi:10.1073/pnas.1721259115
- ↑ «Differential electrophysiological response during rest, self-referential, and non-self-referential tasks in human posteromedial cortex». Proceedings of the National Academy of Sciences of the United States of America. 108. ISSN 1091-6490. PMC 3041085 . PMID 21282630. doi:10.1073/pnas.1017098108
- ↑ «Imagery-Mediated Verbal Learning Depends on Vividness–Familiarity Interactions: The Possible Role of Dualistic Resting State Network Activity Interference». Brain Sciences. 9. ISSN 2076-3425. doi:10.3390/brainsci9060143
- ↑ «Enhanced intersubject correlations during movie viewing correlate with successful episodic encoding». Neuron. 57. ISSN 0896-6273. PMC 2789242 . PMID 18255037. doi:10.1016/j.neuron.2007.12.009
- ↑ «Topographic mapping of a hierarchy of temporal receptive windows using a narrated story». The Journal of Neuroscience. 31. ISSN 1529-2401. PMC 3089381 . PMID 21414912. doi:10.1523/JNEUROSCI.3684-10.2011
- ↑ «Selective and invariant neural responses to spoken and written narratives». The Journal of Neuroscience. 33. ISSN 1529-2401. PMC 3787506 . PMID 24089502. doi:10.1523/JNEUROSCI.1580-13.2013
- ↑ «Not lost in translation: neural responses shared across languages». The Journal of Neuroscience. 32. ISSN 1529-2401. PMC 3525075 . PMID 23115166. doi:10.1523/JNEUROSCI.1800-12.2012
- ↑ «Theory of Mind: Towards an Evolutionary Theory». Evolutionary Psychological Science. 4. doi:10.1007/s40806-017-0112-xPdf.
- ↑ Starr, G. Gabrielle; Stahl, Jonathan L.; Belfi, Amy M.; Isik, Ayse Ilkay; Vessel, Edward A. (4 de setembro de 2019). «The default-mode network represents aesthetic appeal that generalizes across visual domains». Proceedings of the National Academy of Sciences (em inglês). 201902650 páginas. ISSN 0027-8424. PMID 31484756. doi:10.1073/pnas.1902650116
- ↑ «Functional Brain Networks Develop from a 'Local to Distributed' Organization». PLoS Computational Biology. 5. PMC 2671306 . PMID 19412534. doi:10.1371/journal.pcbi.1000381
- ↑ a b c «The default network and self-generated thought: component processes, dynamic control, and clinical relevance». Annals of the New York Academy of Sciences. 1316. ISSN 1749-6632. PMC 4039623 . PMID 24502540. doi:10.1111/nyas.12360
- ↑ Kernbach, J.M., Yeo, B.T.T., Smallwood, J., Margulies, D.S., Thiebaut de Schotten, M., Walter, H., Sabuncu, M.R., Holmes, A.J., Gramfort, A., Varoquaux, G., Thirion, B., Bzdok, D., 2018. Subspecialization within default mode nodes characterized in 10,000 UK Biobank participants. Proc. Natl. Acad. Sci. 115, 12295 LP-12300. doi:10.1073/pnas.1804876115; https://www.pnas.org/content/115/48/12295
- ↑ a b «Default mode network abnormalities in posttraumatic stress disorder: A novel network-restricted topology approach». NeuroImage. 176. ISSN 1053-8119. PMC 5976548 . PMID 29730491. doi:10.1016/j.neuroimage.2018.05.005
- ↑ Kernbach, J.M., Satterthwaite, T.D., Bassett, D.S., Smallwood, J., Margulies, D., Krall, S., Shaw, P., Varoquaux, G., Thirion, B., Konrad, K., Bzdok, D., 2018. Shared endo-phenotypes of default mode dysfunction in attention deficit/hyperactivity disorder and autism spectrum disorder. Transl. Psychiatry 8, 133. doi:10.1038/s41398-018-0179-6; https://www.nature.com/articles/s41398-018-0179-6
- ↑ Identifying differences in brain activities and an accurate detection of autism spectrum disorder using resting state functional-magnetic resonance imaging: A spatial filtering approach. 2017;35:375–389. doi:10.1016/j.media.2016.08.003.
- ↑ «Dysmaturation of the default mode network in autism». Human Brain Mapping. 35. ISSN 1097-0193. PMC 3651798 . PMID 23334984. doi:10.1002/hbm.22252
- ↑ «Default mode network segregation and social deficits in autism spectrum disorder: Evidence from non-medicated children». NeuroImage: Clinical. 9. PMC 4573091 . PMID 26484047. doi:10.1016/j.nicl.2015.07.018
- ↑ Dr. Ruth Lanius, Brain Mapping conference, London, November 2010
- ↑ «Evidence of a dissociation pattern in resting-state default mode network connectivity in first-episode, treatment-naive major depression patients». Biological Psychiatry. 71. PMID 22177602. doi:10.1016/j.biopsych.2011.10.035
- ↑ «Enhanced medial prefrontal-default mode network functional connectivity in chronic pain and its association with pain rumination». Journal of Neuroscience. 34. PMID 24623774. doi:10.1523/JNEUROSCI.5055-13.2014
- ↑ «Default mode network in depression: A pathway to impaired affective cognition?» (PDF). Clinical Neuralpyschiatry. 10
- ↑ «Multivariate analysis reveals genetic associations of the resting default mode network in psychotic bipolar disorder and schizophrenia». Proceedings of the National Academy of Sciences. 111. ISSN 0027-8424. PMC 4024891 . PMID 24778245. doi:10.1073/pnas.1313093111
- ↑ «Characterizing Acupuncture Stimuli Using Brain Imaging with fMRI – A Systematic Review and Meta-Analysis of the Literature». PLOS ONE. 7. PMC 3322129 . PMID 22496739. doi:10.1371/journal.pone.0032960
- ↑ «Inserting Needles Into the Body: A Meta-Analysis of Brain Activity Associated With Acupuncture Needle Stimulation». The Journal of Pain. 14. PMID 23395475. doi:10.1016/j.jpain.2012.11.011
- ↑ «Is meditation associated with altered brain structure? A systematic review and meta-analysis of morphometric neuroimaging in meditation practitioners». Neuroscience & Biobehavioral Reviews. 43. PMID 24705269. doi:10.1016/j.neubiorev.2014.03.016
- ↑ «The exploration of meditation in the neuroscience of attention and consciousness». Cognitive Processing. 11. PMID 20041276. doi:10.1007/s10339-009-0354-z
- ↑ «Nondirective meditation activates default mode network and areas associated with memory retrieval and emotional processing». Front. Hum. Neurosci. 8. PMC 3935386 . PMID 24616684. doi:10.3389/fnhum.2014.00086
- ↑ «Sleep and the functional connectome». NeuroImage. 80. PMC 3733088 . PMID 23707592. doi:10.1016/j.neuroimage.2013.05.067
- ↑ «Overlapping prefrontal systems involved in cognitive and emotional processing in euthymic bipolar disorder and following sleep deprivation: A review of functional neuroimaging studies». Clinical Psychology Review. 32. PMC 3922056 . PMID 22926687. doi:10.1016/j.cpr.2012.07.003
- ↑ «Sleep deprivation and neurobehavioral dynamics». Current Opinion in Neurobiology. 23. PMC 3700596 . PMID 23523374. doi:10.1016/j.conb.2013.02.008
- ↑ «Neural correlates of the psychedelic state as determined by fMRI studies with psilocybin». PNAS. 109. PMC 3277566 . PMID 22308440. doi:10.1073/pnas.1119598109
- ↑ «Neural correlates of the LSD experience revealed by multimodal neuroimaging». Proceedings of the National Academy of Sciences. 113. PMC 4855588 . PMID 27071089. doi:10.1073/pnas.1518377113
- ↑ «Balancing the Brain: Resting State Networks and Deep Brain Stimulation». Frontiers in Integrative Neuroscience. 5. PMC 3088866 . PMID 21577250. doi:10.3389/fnint.2011.00008
- ↑ «Neural Dysregulation in Posttraumatic Stress Disorder». Psychosomatic Medicine. 74. ISSN 0033-3174. PMC 3498527 . PMID 23115342. doi:10.1097/PSY.0b013e318273bf33
- ↑ «A Network-Based Neurobiological Model of PTSD: Evidence From Structural and Functional Neuroimaging Studies». Current Psychiatry Reports. 19. ISSN 1523-3812. PMC 5960989 . PMID 28924828. doi:10.1007/s11920-017-0840-4
- ↑ «Resting oscillations and cross-frequency coupling in the human posteromedial cortex». NeuroImage. 60. ISSN 1095-9572. PMC 3596417 . PMID 22227048. doi:10.1016/j.neuroimage.2011.12.019
- ↑ Morris, Peter G.; Smith, Stephen M.; Barnes, Gareth R.; Stephenson, Mary C.; Hale, Joanne R.; Price, Darren; Luckhoo, Henry; Woolrich, Mark; Brookes, Matthew J. (4 de outubro de 2011). «Investigating the electrophysiological basis of resting state networks using magnetoencephalography». Proceedings of the National Academy of Sciences (em inglês). 108 (40): 16783–16788. ISSN 0027-8424. PMID 21930901. doi:10.1073/pnas.1112685108
- ↑ «The maturing architecture of the brain's default network». Proceedings of the National Academy of Sciences. 105. PMC 2268790 . PMID 18322013. doi:10.1073/pnas.0800376105
- ↑ «Does the brain have a baseline? Why we should be resisting a rest» (PDF). NeuroImage. 37. PMID 17052921. doi:10.1016/j.neuroimage.2006.09.013