Cloreto de cobre(I)
composto químico
(Redirecionado de Cloreto de cobre (I))
| Cloreto de cobre(I) Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | Cloreto de cobre(I) |
| Outros nomes | Cloreto cuproso |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | GL6990000 |
| SMILES |
|
| InChI | 1/ClH.Cu/h1H;/q;+1/p-1
|
| Propriedades | |
| Fórmula molecular | CuCl |
| Massa molar | 98.999 g/mol |
| Aparência | white powder, slightly green from oxidized impurities |
| Densidade | 4.145 g/cm3 |
| Ponto de fusão |
426 °C, 699 K, 799 °F |
| Ponto de ebulição |
1490 °C, 1763 K, 2714 °F ((decomposes)) |
| Solubilidade em água | 0.0062 g/100 mL (20 °C) |
| Equilíbrio de solubilidade, Ksp | 1.72 x 10−7 |
| Solubilidade | insoluble in ethanol acetone; soluble in concentrated HCl, NH4OH |
| Índice de refracção (nD) | 1.930[1] |
| Estrutura | |
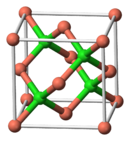
| Estrutura cristalina | Zinc blende structure |
| Riscos associados | |
| MSDS | JT Baker |
| Classificação UE | Harmful (Xn) Dangerous for the environment (N) |
| Índice UE | 029-001-00-4 |
| NFPA 704 | |
| Frases R | R22, R35 |
| Frases S | S2, S22, S60, S61 |
| Ponto de fulgor | Non-flammable |
| LD50 | 140 mg/kg |
| Compostos relacionados | |
| Outros aniões/ânions | Copper(I) bromide Copper(I) iodide |
| Outros catiões/cátions | Copper(II) chloride Silver(I) chloride |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cloreto de cobre (I) ou cloreto cuproso, é um composto químico inorgânico de fórmula CuCl. Apresenta-se como um sólido incolor. É um precursor para outros compostos de cobre, incluindo alguns de significância comercial. Ocorre naturalmente como o mineral raro nantokita. Diferentemente de outros haletos de metais de transição da primeira linha da tabela periódica, forma complexos com monóxido de carbono.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
