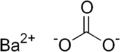Carbonato de bário
Carbonato de bário BaCO3, é um composto químico. O mineral é nomeado após William Withering, que em 1784 reconheceu que ele fosse quimicamente distinto da barita. Ocorre em veias de minério de chumbo. A witherita é facilmente alterada para sulfato de bário pela ação da água contendo sulfato de cálcio e, portanto, são freqüentemente chamados de barita.
Usos editar
É utilizado em pesticidas, fabricação de porcelanas, vidros e antigamente para refinação de açúcar.
É usado para fogos de artifício e preparação de sinalizadores.[1]
É a principal fonte de bário e seus sais. É também usado para controlar o cromato em cromagem de peças industriais e decorativas em metal.
Propriedades editar
Ele reage com muitos ácidos formando sais solúveis de bário, por exemplo, com o ácido clorídrico, o cloreto de bário. Apesar de reagir bem com o ácido clorídrico ou o ácido nítrico, não reage tão bem com ácido sulfúrico, que é o único ácido que não faz reação com o carbonato de bário devido ao sulfato de bário ser insolúvel em água.
Segurança editar
É bastante tóxico por ingestão pelo fato de reagir com o ácido clorídrico do estômago, produzindo cloreto de bário, que sendo solúvel, entra na corrente sanguínea e nos mais diversos processos do metabolismo.
Num caso de erro na fabricação de sulfato de bário a partir do carbonato de bário, no Brasil, causou por esta reação a morte de diversas pessoas.[2][3][4]
Referências
- ↑ «Barium carbonate 513-77-9 wiki». GuideChem (em inglês). Consultado em 22 de setembro de 2023
- ↑ Laudo indica presença de sais solúveis de bário no Celobar - www1.folha.uol.com.br
- ↑ ACIDENTE CELOBAR: A TOXICOLOGIA EXPERIMENTAL COMO FERRAMENTA NO ESTABELECIMENTO DE NEXO CAUSAL DE INTOXICAÇÃO MEDICAMENTOSA MACIÇA; OLIVEIRA, Rodrigo Borges de; CUNHA, Luiz Carlos da, VALADARES, Marize Campos; FILHO, Marco Júnio Peres, ARAÚJO, Denisson Machado de; Revista Eletrônica de Farmácia, Suplemento Vol 2 (2), 140-142, 2005. ISSN 1808-0804 - www.revistas.ufg.br
- ↑ Matthieu Tubino, José de Alencar Simoni; Refletindo sobre o caso celobar®; Quím. Nova vol.30 no.2 São Paulo Mar./Apr. 2007; doi: 10.1590/S0100-40422007000200048 - www.scielo.br