Potencial de ação
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Março de 2010) |
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
O potencial de ação é uma inversão do potencial de membrana que percorre a membrana de uma célula. Potenciais de ação são essenciais para a vida animal, porque transportam rapidamente informações entre e dentro dos tecidos. Eles podem ser gerados por muitos tipos de células, mas são utilizados mais intensamente pelo sistema nervoso, para comunicação entre neurônios e para transmitir informações dos neurônios para outro tecido do organismo, como os músculos ou as glândulas.
Muitas plantas também exibem potenciais de ação. Eles viajam por meio de seu floema para coordenar atividades. A principal diferença entre os potenciais de ação de animais e vegetais são os íons. As plantas utilizam primariamente íons de potássio e cálcio, enquanto animais utilizam mais íons de potássio e sódio.
Potenciais de ação são mensageiros essenciais para a linguagem neuronal. Provêem controle rápido e centralizado, além de coordenação, de órgãos e tecidos. Eles podem guiar a maneira em que a anatomia vai se modificar.
Considerações gerais
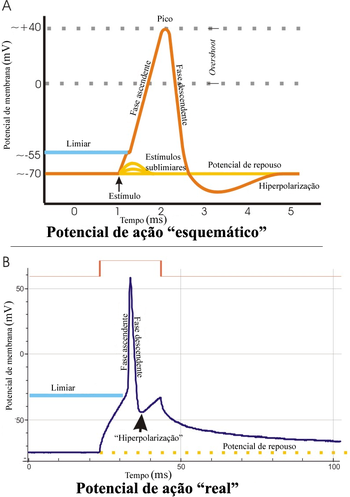
editarUma tensão elétrica, ou diferença de potencial, sempre existe entre o interior e o exterior de uma célula. Esse fato é causado por uma distribuição de íons desigual entre os dois lados da membrana e da permeabilidade da membrana a esses íons. A tensão elétrica de uma célula inativa permanece em um valor negativo — considerando o interior da célula em relação ao exterior ― e varia muito pouco. Quando a membrana de uma célula excitável é despolarizada além de um limiar, a célula dispara um potencial de ação, comumente chamado de espícula (leia Limiar e início).
Um potencial de ação é uma alteração rápida na polaridade da tensão elétrica, de negativa para positiva e de volta para negativa. Esse ciclo completo dura poucos milisegundos. Cada ciclo — e, portanto, cada potencial de ação, possui uma fase ascendente, uma fase descendente e, ainda, uma curva de tensão elétrica inferior a do potencial de repouso de membrana. Em fibras musculares cardíacas especializadas, uma fase de platô, com tensão elétrica intermediária, pode preceder a fase descendente.
Potenciais de ação podem ser medidos por meio de técnicas de registro de eletrofisiologia e, mais recentemente, por meio de neurochips que contêm EOSFETs (transistores de efeito de campo de semicondutor eletrólito-óxido). Um osciloscópio que esteja registrando o potencial de membrana de um único ponto em um axônio mostra cada estágio do potencial de ação à medida que a onda passa. Suas fases traçam um arco que se assemelha a uma senóide distorcida. Sua ordenada depende se a onda do potencial de ação atingiu aquele ponto da membrana, ou se passou por ele e, se for o caso, há quanto tempo isso ocorreu.
O potencial de ação não permanece em um local da célula, ele percorre a membrana (leia Propagação). Ele pode percorrer longas distâncias no axônio, por exemplo para transmitir sinais da medula espinal para os músculos do pé. Em grandes animais, como as girafas e baleias, a distância percorrida pode ser de vários metros.
Tanto a velocidade quanto a complexidade do potencial de ação variam entre diferentes tipos de células. Entretanto, a amplitude das alterações de tensão elétrica tende a ser rigorosamente a mesma. Dentro da mesma célula, potenciais de ação consecutivos são tipicamente indistinguíveis. Neurônios transmitem informação gerando seqüências de potenciais de ação, chamadas trens de pulsos (“spike trains” em inglês). Variando a freqüência ou o intervalo de tempo dos disparos de potencial de ação gerados, os neurônios podem modular a informação que eles transmitem.
Mecanismos da despolarização neuronal
editarO potencial de ação é causado pela despolarização da membrana dos neurônios. Assim sendo, quando neurotransmissores são liberados na fenda sináptica, eles se ligam a receptores (1) Ionotrópicos; (2) Metabotrópicos. No primeiro caso, a ligação do neurotransmissor com seu receptor específico altera, de forma conformacional, proteínas de canal. Exemplo: Na+, causando influxo de sódio (Potencial Pós-Sináptico Excitatório - PPSE). Além disso, podemos ter PPSI pela ação de neurotransmissores inibitórios como o GABA, causando a abertura de proteínas de canal K+ (efluxo) ou Cl- (influxo), gerando uma hiperpolarização do neurônio. No segundo caso, a ligação do neurotransmissor ao receptor desencadeia processos que envolvem "mensageiros secundários". O principal processo é o que envolve a Proteina-G.
Limiar e início
editarPotenciais de ação são disparados quando uma despolarização inicial atinge o potencial limiar excitatório. Esse potencial limiar varia, mas normalmente gira em torno de 15 milivolts acima do potencial de repouso de membrana da célula e ocorre quando a entrada de íons de sódio na célula excede a saída de íons de potássio. O influxo líquido de cargas positivas devido aos íons de sódio causa a despolarização da membrana, levando à abertura de mais canais de sódio dependentes de tensão elétrica . Por esses canais passa uma grande corrente de entrada de sódio, que causa maior despolarização, criando um ciclo de realimentação positiva (feedback positivo) que leva o potencial de membrana a um nível bastante despolarizado.
O potencial limiar pode ser alcançado ao alterar-se o balanço entre as correntes de sódio e potássio. Por exemplo, se alguns canais de sódio estão em um estado inativado (comportas de inativação fechadas), então um dado nível de despolarização irá ocasionar a abertura de um menor número de canais de sódio (os que não estão inativados) e uma maior despolarização será necessária para iniciar um potencial de ação. Essa é a explicação aceita para a existência do período refratário (veja o tópico sobre Período refratário).
Potenciais de ação são determinados pelo equilíbrio entre os íons de sódio e potássio (embora haja uma menor contribuição de outros íons como cloreto e cálcio, este último especialmente importante na eletrogênese miocárdica), e são usualmente representados como ocorrendo em células contendo apenas dois canais iônicos transmembranares (um canal de sódio tensão elétrica -dependente e um canal de potássio, não-tensão elétrica -dependente). A origem do potencial limiar pode ser estudada utilizando curvas de corrente versus tensão elétrica (figura à direita) que representam a corrente através de canais iônicos em função do potencial celular transmembranar. Note que a curva ilustrada é uma relação corrente-tensão elétrica “instantânea”; ela representa a corrente de pico através dos canais iônicos a uma dada tensão elétrica antes de qualquer inativação ter acontecido, isto é, aproximadamente 1 ms após aquela tensão elétrica para a corrente de sódio (Na) ter sido atingida. As voltagens mais positivas neste gráfico apenas são alcançadas pelas células por meios artificiais, isto é, voltagens impostas por aparelhos de estimulação elétrica.
Quatro importantes pontos no gráfico i/V estão indicados por setas na figura:
- A seta verde indica o potencial de repouso da célula e também o valor do potencial de equilíbrio para o potássio (Ek). Como o canal de K+ é o único aberto em voltagens tão negativas, a célula permanecerá no potencial Ek. Note que um potencial de repouso estável será observado em qualquer tensão elétrica na qual a soma i/V (linha verde) ultrapassa o ponto de corrente nula (eixo das abscissas) com um ângulo positivo, como na seta verde. Consideremos: qualquer perturbação do potencial de membrana na direção negativa resultará em um influxo de íons que despolarizará a célula de volta ao ponto de cruzamento, enquanto qualquer perturbação do potencial de membrana celular na direção positiva resultará em um efluxo de íons que irá hiperpolarizar a célula de volta ao ponto inicial. Portanto, qualquer perturbação do potencial de membrana em torno de uma inclinação positiva tenderá a retornar a tensão elétrica ao ponto de cruzamento.
- A seta amarela indica o potencial de equilíbrio para o Na+ (ENa). Neste sistema de dois íons, ENa é o limite natural do potencial de membrana, o qual uma célula não pode ultrapassar. Valores de corrente ilustrados neste gráfico que excedem ENa são medidos artificialmente estimulando a célula além de seu limite natural. Note, entretanto, que ENa apenas poderia ser atingido se a corrente de potássio cessasse completamente.
- A seta azul indica a tensão elétrica máxima que o pico do potencial de ação pode atingir. Este é, na verdade, o maior potencial de membrana que esta célula pode alcançar. Não é possível atingir ENa por causa da influência contrária da corrente de potássio.
- A seta vermelha indica o potencial limiar. É a partir deste potencial que a corrente iônica passa a ter resultado líquido em direção ao interior da célula. Note que este cruzamento se dá a uma corrente nula, mas exibe uma inclinação negativa. Qualquer tensão elétrica menor que o limiar tende a fazer a célula retornar ao potencial de repouso e qualquer tensão elétrica maior que o limiar faz com que a célula se despolarize. Esta despolarização leva a um maior influxo de íons, desta forma a corrente de sódio se regenera. O ponto no qual a linha verde atinge seu valor mais negativo é o ponto no qual todos os canais de sódio estão abertos. Despolarizações além desse ponto diminuem o influxo de sódio, conforme a força eletroquímica (driving force) diminui com a aproximação do potencial de membrana do ENa.
O potencial limiar excitatório é comumente confundido com o “limiar” para a abertura dos canais de sódio. Esse conceito está incorreto, pois os canais de sódio não possuem um limiar de abertura. Pelo contrário, eles se abrem em resposta à despolarização de uma maneira aleatória. A ocorrência de despolarização não só abre o canal, mas também aumenta a probabilidade dele ser aberto. Até mesmo em potenciais hiperpolarizados, um canal de sódio se abrirá ocasionalmente. Além disso, o potencial limiar excitatório não é a tensão elétrica na qual a corrente de sódio se torna significante, é a tensão elétrica na qual a corrente de sódio ultrapassa a de potássio.
Em neurônios, despolarizações tipicamente se originam nos dendritos pós-sinápticos e potenciais de ação, nos cones de implantação ( leia mais sobre cone de implantação e ZID). Teoricamente, entretanto, um potencial de ação pode ter início em qualquer lugar de uma fibra nervosa.
Propagação
editarO potencial de ação, gerado no cone de implantação axonal (zona de gatilho), se propaga de maneira semelhante a uma chama ao longo do pavio, que, ao se tornar suficientemente quente, acende em uma extremidade do pavio e queima até a outra extremidade (em um sentido). Quando essa porção da membrana do axônio é despolarizada e atinge o limiar, os canais de sódio dependentes de tensão elétrica se abrem, iniciando o potencial de ação. As cargas positivas fluem para dentro do axônio e se espalham ao longo dele, despolarizando os segmentos adjacentes da membrana, e, quando atinge o limiar, os canais de sódio dependentes de tensão elétrica desse segmento se abrem, promovendo a propagação do potencial de ação. É importante ressaltar que o potencial de ação se propaga sem decaimento visto que a membrana axonal é excitável (capaz de gerar potenciais de ação) ao longo de toda sua extensão.[1]
Período Refratário
editarUma vez que o potencial de ação foi disparado numa região da membrana, essa região precisa de tempo para se recuperar antes de disparar novamente. Esse tempo é chamado de período refratário e ele limita a frequência de disparo de potenciais de ação, além de promover a unidirecionalidade da propagação do potencial de ação. Como definido por Lucindo José (2009), o período refratário divide-se em absoluto e relativo. No absoluto, qualquer estímulo para gerar potencial de ação é inútil, pois os canais de sódio estão em estado inativo (comporta rápida aberta e comporta lenta fechada). No relativo, alguns destes canais já estarão de volta ao repouso ativável (comporta rápida fechada e comporta lenta aberta), mas nem todos. Estímulos supralimiares conseguem gerar potenciais de ação no período refratário relativo. A transição entre os dois períodos ocorre aproximadamente quando a repolarização do potencial de ação atinge o potencial limiar excitatório, que é quando as comportas lentas do canal de sódio dependente de tensão elétrica começam a abrir.[2]
Segundo Lucindo José (2009), nas células miocárdicas, o período refratário é estendido por um platô, que é mantido pelo influxo de íons cálcio na célula. Esse alargamento do período refratário permite um maior descanso destas células, além de participar na sincronização dos batimentos. Quando há um estímulo destas células na hiperpolarização pós-potencial, também conhecida como período de supra-normalidade, pode ocorrer fibrilação.[2]
Velocidade
editarA velocidade de propagação do potencial de ação varia, pois depende do diâmetro e do comprimento do axônio, da quantidade de canais dependentes de tensão elétrica, da presença da bainha de mielina e sua espessura; porém, a velocidade típica é de 10 m/s[1]. Considerando então que o potencial de ação dura cerca de 2ms, é possível calcular o comprimento da membrana:
10 m/s x 2 x 10-3 s = 2 x 10-2 m.
Portanto, um potencial de ação andando a 10 m/s percorre um axônio de 2 cm.[1]
Segundo Lucindo José (2009), em alguns axônios do polvo atlântico Loligo pealei, a velocidade de propagação do potencial de ação alcança velocidades superiores a 100 m/s, em virtude do calibre elevado e da mielina espessa.[2]
Bainha de mielina e nódulo de Ranvier
editarComo conceituado por Lucindo José (2009), a bainha de mielina é uma membrana lipídica modificada e espessada. Ela pode ser sintetizada por duas células: os oligodendrócitos, no sistema nervoso central, e as células de Schwann, no sistema nervoso periférico. A espessura da bainha de mielina é de acordo com o número de voltas que a membrana das células de Schwann ou dos oligodendrócitos dão em torno do axônio. Em axônios de calibre pequeno, não há mielina envolvendo. Nestes, a corrente local induz outro potencial de ação na membrana adjacente, se movimentando como uma onda - mudar. Já em axônios de calibre grande, a mielina é mais espessada que os outros menores que a possuem. Ela fornece um aumento do isolamento celular (aumento da resistência de membrana), em virtude de não haver canais de vazamento de membrana onde há mielina, impedindo a entrada e saída de íons.[2]
A bainha de mielina permite uma maior velocidade da propagação do potencial de ação (diminui a capacitância de membrana e aumenta a resistência de membrana). A bainha de mielina apresenta quebras no isolamento chamadas de nódulos de Ranvier, onde há concentração de canais de sódio dependentes de tensão elétrica possibilitando a indução do potencial de ação nessa região e sua propagação, o que permite a ocorrência do potencial de ação. A distância entre os nódulos de Ranvier deve ser muito bem calculada pelas células, de modo que o potencial passivo chegue com íons suficientes para provocar o potencial de ação.[2]
Diante disso, há a impressão de um movimento saltatório, parecendo que os potenciais de ação saltam de nódulo em nódulo, mas o que acontece é o aumento da velocidade da propagação da corrente local que induz o potencial de ação nos nódulos.
Patologias
editarAlgumas patologias prejudicam a condução saltatória e reduzem a velocidade de propagação do potencial de ação, produzindo um aumento no tempo de resposta. A mais conhecida é a esclerose múltipla, que ataca as bainhas de mielina dos feixes de axônios do encéfalo, da medula espinhal e dos nervos ópticos. Conforme conceituado em Bear (2002), a palavra esclerose é derivada do grego para definir “endurecimento”, que descreve as lesões que se desenvolvem ao redor de feixes de axônios, e a esclerose é múltipla porque a doença atinge muitos locais no sistema nervoso ao mesmo tempo. Existem vários testes que fazem o diagnóstico da EM e demonstram a importância da mielina e como ela aumenta a velocidade da condução. Um deles envolve estimular o olho e medir o tempo da resposta elétrica, visto que pessoas com EM caracteristicamente têm um retardo na velocidade de condução do nervo óptico.[1]
Potencial de ação de placa motora
editarA junção neuromuscular é um local de estudo relativamente simples e acessível à experimentação. Neste local, o neurônio motor inerva o músculo em uma região especializada da membrana muscular chamada de placa motora. Nesta área, os terminais do neurônio motor formam expansões chamadas de botões sinápticos, de onde o neurônio motor libera seu neurotransmissor. Cada botão é posicionado sobre uma dobra juncional, uma dobra profunda na superfície da fibra muscular pós-sináptica que contém os receptores para o neurotransmissor acetilcolina (ACh). A fenda sináptica possui uma enzima chamada acetilcolinesterase, que é produzida tanto pelo neurônio como pela fibra muscular, e possui a função de inativar a ACh, a fim de que esta substância não fique sempre ligada ao seu receptor provocando estimulação constante.
A liberação do neurotransmissor ACh depende da despolarização do neurônio motor, pois dessa forma ativará os canais de Ca2+, fazendo com que este íon entre na célula e permita que as vesículas sinápticas da região terminal se fundam com a membrana plasmática e assim liberem seu conteúdo (ACh) na fenda sináptica. A liberação de ACh pelo terminal do nervo motor ocorre também sem a necessidade de despolarização. Assim, pequenas quantidades de ACh são liberadas sempre na fenda sináptica, fazendo com que sempre haja o potencial miniatura de placa motora (cerca de 3mV, uma espécie de “standby” da célula).
A liberação de ACh das vesículas sinápticas na fenda faz com que a membrana da célula muscular se despolarize, pois a ligação da ACh no canal nicotínico ativado pela ACh provoca a entrada de íons Na+ na célula muscular e, consequentemente, sua despolarização. Esta despolarização ativa um outro tipo de canal de Na+, os chamados canais de Na+ tensão elétrica -dependentes. Eles são ativados quando a despolarização local produzida pelos canais nicotínicos se propaga passivamente ao longo da fibra muscular e atinge esses canais, fazendo com que mais íons Na+ entre na célula. A abertura desses dois tipos de canais (tensão elétrica -dependentes e os nicotínicos ativados por ACh) é necessária, pois a amplitude do potencial de placa motora é muito alto (cerca de 70mV), assim, deve-se abrir um número suficiente de canais de Na+ para ultrapassar o limiar da célula. Este fato também garante que a transmissão sináptica aconteça com um alto grau de segurança.
Um ponto importante a ser considerado é a constituição macromolecular distinta dos canais ativados pela ACh e os tensão elétrica -dependentes. Este fato pode ser verificado pelo uso de drogas e toxinas, por exemplo, a tetrodotoxina (TTX)¹, este veneno provoca bloqueio dos canais de Na+ tensão elétrica dependentes. Isto pode ser fatal, pois a despolarização do neurônio motor ficará prejudicada e consequentemente a transmissão neuromuscular. A α-bungarotoxina (proteína do veneno da cobra) e o curare (toxina de algumas plantas) são drogas que bloqueiam os canais de Na+ dependentes da ACh, mas não bloqueia os canais Na+ tensão elétrica -dependentes, assim, mesmo possuindo ACh na fenda sináptica, a transmissão do potencial de ação do neurônio motor para a fibra muscular ficará grandemente prejudicada, podendo levar a morte.
Em certas doenças, como a miastenia grave (doença autoimune), ocorre a produção de anticorpos contra o receptor de ACh, diminuindo assim o número de canais ativados pela ACh e comprometendo seriamente a transmissão na junção neuromuscular. Em alguns casos a neostigmina (inibidor da acetilcolinesterase) é usada no tratamento da doença, assim a ACh permanecerá mais tempo na fenda sináptica e terá maior probabilidade de se ligar aos poucos receptores de ACh restantes.
¹A TTX é um veneno encontrado em peixes do pacífico e que faz parte da iguaria japonesa chamada Fugu. No Brasil o peixe que produz este veneno é o baiacu.
Influências externas
editarComo pode ser percebido em Mecanismos básicos, a transmissão de potenciais de ação depende de concentrações iônicas pré-determinadas. Assim sendo, depende do meio extracelular.
Hipocaliemia e hipercaliemia
editarBaixas concentrações extracelulares de potássio promovem uma hiperpolarização no potencial de repouso de membrana da célula, pois os canais repouso de potássio estão sempre abertos. A hiperpolarização faz com que o limiar excitatório da célula aumente. Portanto, serão necessários estímulos muito grandes para a geração do potencial de ação. Essa alteração, no músculo cardíaco, leva a deficiência na contratilidade.
Já o aumento da concentração extracelular de potássio resulta na despolarização do potencial de membrana das células. Essa despolarização abre canais de sódio tensão elétrica dependentes, mas em quantidade insuficiente para gerar um potencial de ação. Os canais de sódio então entram em período refratário aumentando assim o potencial de repouso de membrana da célula. Dessa forma há uma diminuição gradativa do limiar excitatório da célula. Ou seja, serão necessários estímulos cada vez menores para gerar um potencial de ação. Isso pode causar danos cardíacos, neuromusculares e gastrintestinais. No coração, pode levar a fibrilação ventricular ou assistolia.
Venenos
editarVenenos atuantes na formação do impulso nervoso
editarDevido à importância dos canais iônicos, principalmente de sódio e potássio, no sistema nervoso central, vários animais desenvolveram mecanismos de defesa e ataque que atuam nos mesmos. Como exemplo dessas substâncias, tem-se:
• Tetrodotoxina: atua bloqueando os canais de sódio, impedindo que o potencial de ação seja gerado e, consequentemente, paralisando os organismos que a ingerem. Tal substância é encontrada em algumas espécies de peixe-balão.
• Saxitoxina: possui efeito muito semelhante ao da tetrodotoxina, pois é um homólogo químico da mesma. É produzida pelos dinoflagelados, constituindo um malefícios da maré vermelha, pois pode contaminar os bivalves que a ingerem através dos dinoflagelados.
• Tetraetilamônio (TEA): bloqueia os canais de potássio, interferindo na corrente de saída, prejudicando a repolarização. Outras drogas com efeito similar são o Césio e a 4-aminopiridina
• Alfa-toxinas: prolongam o potencial de ação, causando distúrbios nos SNC, uma espécie de confusão do SNC. É encontrada no veneno de escorpião.
• Beta-toxinas: altera a diferença de potencial nas quais os canais de sódio são ativados (abertos), diminuindo drasticamente tais valores, o que novamente causa distúrbios ao SNC. Também é encontrada no veneno de escorpião.
• Batracotoxina: é uma toxina alcalóide que combina os efeitos das alfa e beta-toxinas. É produzida por algumas rãs da América do Sul. É usada na ponta de flechas por tribos indígenas sul-americanas.
• Dendrotoxina, apamina e caibdotoxina: tais toxinas tem como efeito primordial o bloqueio dos canais de potássio.
Tais tipos de venenos não são produzidos exclusivamente por animais, algumas espécies de vegetais produzem substâncias semelhantes, como por exemplo a aconitina e a veratridina.
Venenos atuantes na liberação dos neurotransmissores
editarNovamente como mecanismos de defesa e ataque os animais desenvolveram estratégias contras os sistemas nervosos de seus adversários sendo, nestes casos, os neurotransmissores o alvo.
• Toxinas clostridiais: atuam bloqueando a liberação de neurotransmissores na fenda sináptica; são proteases extremamente específicas que clivam proteínas da membrana pré-sináptica fundamentais para a fusão das vesículas com a membrana plasmática do neurônio pré-sináptico. São toxinas bacterianas produzidas por espécies do género Clostridium, extremamente potentes, responsáveis por doenças como o botulismo e o tétano.
• Alfa-latrotoxina: liga-se à membrana pré-sináptica facilitando a ligação das vesículas contendo neurotransmissores com a mesma, o que promove uma descarga abundante de neurotransmissores. É produzida pelas fêmeas da espécie de aranha viúva negra (género Latrodectus).
• Alfa-bungarotoxina: é um peptídeo que se liga de forma permanente aos receptores colinérgicos pós-sinápticos, o que impede a abertura dos canais iônicos da placa-motora pela acetilcolina, paralisando o alvo. É produzido pela cobra Bungarus multicinctus.
• Alfa-neurotoxina, erabutoxina e curare (mistura de toxinas vegetais): os três venenos citados tem efeito semelhante ao da alfa-bungarotoxina.
• Conotoxinas: tal classe de venenos possui efeito vasto, podendo bloquear desde os canais de sódio e cálcio até receptores para glutamato e acetilcolina. O efeito primordial é a paralisia total de presa. São produzidas por caracóis marinhos do género Conus.
• Estricnina: é um alcalóide que atua nas sinapses de glicina, causando hiperatividade, espasmos, convulsões, podendo levar à morte. É extraído da semente do vegetal Strychnos nux-vomica.
Potencial de ação e evolução
editarCom a evolução, alguns organismos tornaram-se complexos e maiores. Houve, então, necessidade de manter fidedigna as informações das porções mais distais do organismo. Para tal, o potencial de ação tornou-se um mecanismo muito eficiente, pois sua informação está contida na freqüência, que é uma propriedade que depende da fonte somente, ou seja, não se altera até chegar ao seu destino. Diferente do potencial passivo, que tem sua informação contida na amplitude, sujeita a várias alterações pelo meio. Comparando-se com as ondas de rádio, pode-se dizer que o potencial de ação equivale à FM (freqüência modulada), enquanto o potencial passivo equivale à AM (amplitude modulada).
Referências
editar- ↑ a b c d F., Bear, Mark (2007). Neurociências : desvendando o sistema nervoso. [S.l.]: Lippincott Williams & Wilkins. OCLC 817081328
- ↑ a b c d e Júnior, Lucindo José Quintans (2009). Fisiologia Básica (PDF). [S.l.: s.n.]
- ↑ Schmidt-Nielsen, Knut (1997). Animal physiology : adaptation and environment Fifth edition ed. Cambridge: [s.n.] OCLC 35744403
- ↑ Hursh, J. B. (31 de julho de 1939). «CONDUCTION VELOCITY AND DIAMETER OF NERVE FIBERS». American Journal of Physiology-Legacy Content (em inglês) (1): 131–139. ISSN 0002-9513. doi:10.1152/ajplegacy.1939.127.1.131. Consultado em 5 de novembro de 2022
- ↑ Rushton, W. A. H. (28 de setembro de 1951). «A theory of the effects of fibre size in medullated nerve». The Journal of Physiology (1): 101–122. ISSN 0022-3751. doi:10.1113/jphysiol.1951.sp004655. Consultado em 5 de novembro de 2022
Fontes gerais
editar- Bear, M.F., B.W. Connors, and M.A. Paradiso. 2001. Neuroscience: Exploring the Brain. Baltimore: Lippincott.
- Kandel ER, Schwartz JH, Jessell TM. Principles of Neural Science, 4th ed. McGraw-Hill, New York (2000). ISBN 0-8385-7701-6
- Dale Purves, et al. Neuroscience, 2nd ed. 2001. Sinauer Associates, Inc. Ion Channels Underlying Action Potentials. [1]
- Kent, M., Advanced Biology. 2000. United Kingdom: Oxford University Press.
- Taylor, D.J., Green, N.P.O., & Stout, G.W. 2003. Biological Sciences, 3rd ed. United Kingdom : Cambridge University Press.
Fontes primárias
editar- Hodgkin AL, Huxley AF. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J Physiol. 1952 Apr;116(4):449-72. PMID 14946713
- Hodgkin AL, Huxley AF. The components of membrane conductance in the giant axon of Loligo. J Physiol. 1952 Apr;116(4):473-96. PMID 14946714
- Hodgkin AL, Huxley AF. The dual effect of membrane potential on sodium conductance in the giant axon of Loligo. J Physiol. 1952 Apr;116(4):497-506. PMID 14946715
- Hodgkin AL, Huxley AF. A quantitative description of membrane current and its application to conduction and excitation in nerve. J Physiol. 1952 Aug;117(4):500-44. PMID 12991237
- Clay JR. Axonal excitability revisited. Prog Biophys Mol Biol. 2005 May;88(1):59-90. PMID 15561301