Cetona
Cetona é uma função química importante na química orgânica, caracterizados pela presença da ligação dupla carbono oxigênio ( C=O), chamado carbonila, ligado a dois radicais orgânicos.[1]
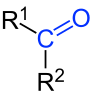
A fórmula geral das cetonas é R—C(=O)—R', R e R' podem ser radicais iguais (cetonas simples ou simétricas) ou diferentes (cetonas mistas ou assimétricas). Os radicais podem ser alifáticos ou aromáticos; saturados ou insaturados[2] e R e R' podem também estar unidos, resultando em uma cetona cíclica.[1][2] Se R ou R' é um átomo de hidrogênio, trata-se de um aldeído.
Estrutura
editarOs grupos ligados à carbonila ( C=O ) definem um plano trigonal ao redor do carbono cetônico, com ângulos de ligação de aproximadamente 120 °. As cetonas diferem dos aldeídos porque o grupo carbonila está ligado a dois carbonos dentro de um esqueleto de carbono. O grupo carbonila é polar pela maior eletronegatividade do oxigênio (3,5) em relação ao carbono (2,5). O polo negativo é o oxigênio e o polo positivo é o carbono.
A ligação C=O é mais forte (178 kcal/mol) do que a ligação C=C (144 kcal/mol) e esta diferença é atribuída ao caráter iônico parcial desta ligação. Além disso, a ligação C=O é mais curta que a ligação C=C.
Nomenclatura
editarA nomenclatura IUPAC das cetonas utiliza a cadeia principal que contenha o grupo carbonila. De acordo com o número de carbonos, se usa prefixo ( 3C = prop; 4C= but), adiciona-se o infixo an (se houver a presença de ligações duplas usa-se en e indica-se a posição da ligação dupla) e o sufixo -ona. A partir de 5 carbonos, é necessário indicar a posição da ligação dupla na cadeia. Se a ligação C=O estiver no primeiro carbono, a função é aldeído, e não cetona. Se a ligação C=O estiver no ciclo, utiliza-se o prefixo ciclo. Seguem alguns exemplos de cetonas:
- propanona (popularmente acetona): CH3-CO-CH3
- butan-2-ona: CH3-CO-CH2-CH3
- pentan-2-ona: CH3-CO-CH2-CH2-CH3
- pentan-3-ona: CH3-CH2-CO-CH2-CH3
- hexan-2-ona: CH3-CO-(CH2)3-CH3
- hexan-3-ona: CH3-CH2-CO-(CH2)2-CH3
- butanodiona (também conhecido por diacetilo): CH3-CO-CO-CH3
- pentan-2,4-diona: CH3-CO-CH2-CO-CH3
Quando o composto tiver mais de uma função e uma delas tiver maior precedência que a função cetona, deve-se usar o prefixo oxo. Por exemplo:
- CH3-CO-CH2-COOH: ácido 3-oxobutanóico (também chamado de ácido acetoacético).
- CH3-CH2-CO-CH(CH3)-COH: 2-metil-3-oxopentanal.
Nomenclatura usual
editarA nomenclatura usual "(radical menor)(radical maior)cetona tem caído em desuso para cetonas.
Exemplo:
- CH3–CO–CH2CH2CH3: metil-n-propilcetona. A nomenclatura oficial correspondente seria pentan-2-ona.
Propriedades Físicas
editarAs cetonas são tipicamente mais solúveis em água do que os compostos de metileno relacionados, porque o oxigênio interage com a água por ligação de hidrogênio, contudo não interagem por ligações de hidrogênio entre si, uma vez que são apenas aceitadoras de ligações de hidrogênio, e interagem entre si por dipolo-dipolo. Assim, as cetonas têm ponto de ebulição maiores que hidrocarbonetos e menores que álcoois de massa molecular semelhante. Esses fatores estão relacionados à difusão de cetonas na perfumaria e como solventes.
Síntese e obtenção de cetonas
editarExistem muitos métodos para a preparação de cetonas em escala industrial e em laboratórios acadêmicos. As cetonas também são produzidas por rotas bioquímicas.
Na indústria, o método mais importante provavelmente envolve a oxidação de hidrocarbonetos, geralmente com o ar. Por exemplo, um bilhão de quilogramas de ciclohexanona são produzidos anualmente por oxidação aeróbica do ciclohexano, enquanto a acetona é preparada por oxidação do ar com cumeno.
Para aplicações sintéticas orgânicas especializadas ou de pequena escala, as cetonas são frequentemente preparadas por oxidação de álcoois secundários:
Oxidantes fortes típicos (fonte de "O" na reação acima) incluem permanganato de potássio ou um composto Cr (VI). Condições mais leves fazem uso dos métodos de periodinano de Dess-Martin ou de Moffatt-Swern.
Muitos outros métodos foram desenvolvidos,[3] exemplos incluem:
- Por hidrólise por halogeneto geminal (ex: na reação de Reimer-Tiemann).
- Por hidratação de alcinos. Tais processos ocorrem via enóis e requerem a presença de um ácido e HgSO4. A tautomerização subsequente do ceto-enol produz uma cetona. Essa reação sempre produz uma cetona, mesmo com um alcino terminal, a única exceção é a hidratação do acetileno, que produz acetaldeído.
- A partir de amidas de Weinreb usando reagentes organometálicos estequiométricos.
- As cetonas aromáticas podem ser preparadas na acilação de Friedel-Crafts, na reação de Houben-Hoesch relacionada, e no rearranjo de Fries.
- A ozonólise e as seqüências relacionadas à di-hidroxilação / oxidação clivam alcenos para dar aldeídos ou cetonas, dependendo do padrão de substituição do alceno.
- No rearranjo Kornblum – DeLaMare, as cetonas são preparadas a partir de peróxidos e base.
- Na ciclização de Ruzicka, cetonas cíclicas são preparadas a partir de ácidos dicarboxílicos.
- Na reação de Nef, as cetonas se formam por hidrólise de sais de compostos nitro secundários.
- No acoplamento de Fukuyama, as cetonas são formadas a partir de um tioéster e um composto de organozinco.
- Pela reação de um cloreto de ácido com compostos de organocádmio ou compostos de organocobre.
- A reação de Dakin-West fornece um método eficiente para a preparação de certas metil cetonas a partir de ácidos carboxílicos.
- As cetonas também podem ser preparadas pela reação dos reagentes de Grignard com nitrilos, seguidos pela hidrólise.
- Por descarboxilação do anidrido carboxílico.
- As cetonas podem ser preparadas a partir de halocetonas na desalogenação redutiva de halo cetonas.
- Na descarboxilação cetônica, cetonas simétricas são preparadas a partir de ácidos carboxílicos.
- Oxidação de aminas com cloreto de ferro (III).
- Hidrólise de amidas secundárias não saturadas, ésteres de β-cetoácidos ou β-dicetonas.
- Rearranjo catalisado por ácido de 1,2-dióis.
Utilidade
editarA cetona mais comum é a propanona, mais conhecida como acetona. Ela é usada como solvente de esmaltes, graxas, vernizes e resinas. Também é utilizada na extração de óleos de sementes vegetais, na fabricação de anidrido acético e medicamentos.
A propanona é um líquido inflamável, incolor, com cheiro agradável e solúvel em água.
As cetonas são encontradas na natureza em flores e frutos. Em geral, são líquidos de odor agradável. Muitas cetonas artificiais e naturais são usadas como perfumes e alimentos. Algumas são substâncias medicinais, como os compostos cetônicos da urina.
Algumas cetonas presentes em compostos naturais:
Reações de Cetonas
editarComportamento ácido-básico
editarOs compostos carbonílicos apresentam o equilíbrio ceto-enol,[4] conforme o desenho:
Na maior parte dos compostos, o equilíbrio favorece a forma ceto e as constantes de equilíbrio são da ordem de 108, favoráveis à forma ceto. Em alguns casos, como o fenol, a forma enol é favorecida.
As cetonas têm um comportamento ácido fraco, com valores de pKa médios próximos a 20, porém são muito mais ácidas do que os alcanos (pKa ≈ 50). Esta diferença é atribuída à estabilização da base conjugada por ressonância, que dispersa a carga entre o carbono e o átomo de oxigênio. O ânion formado é chamado de íon enolato.
A acidez do α-hidrogênio também permite que as cetonas e outros compostos carbonílicos reajam como nucleófilos em reações de substituição nucleofílica, adição à compostos carbonilados, entre outros. Em cetonas assimétricas ocorre a possibilidade de abstração de próton dos dois lados da carbonila, que pode ser modulada de acordo com as condições de reação utilizadas. Usando bases muito fortes como diisopropilamida de lítio (LDA, pKa do ácido conjugado ~ 36) em condições não equilibradas (–78 ° C, 1,1 equiv LDA em THF, cetona adicionada à base), o enolato cinético menos substituído é gerado seletivamente, enquanto as condições que permitem o equilíbrio (temperatura mais alta, base adicionada à cetona, usando bases fracas ou insolúveis, por exemplo, NaOEt em EtOH ou NaH) fornecem o enolato termodinâmico mais substituído.
As cetonas também são bases fracas, submetidas a protonação no oxigênio carbonílico na presença de ácidos de Brønsted. Os íons cetônio (ou seja, cetonas protonadas) são ácidos fortes, com valores de pKa estimados entre -5 e -7.[5] [6] [7] Embora os ácidos encontrados na química orgânica raramente sejam fortes o suficiente para protonar completamente as cetonas, a formação de concentrações de equilíbrio de cetonas protonadas é, no entanto, um passo importante nos mecanismos de muitas reações orgânicas comuns, como a formação de um acetal, por exemplo. Ácidos tão fracos quanto o cátion piridínio (como encontrado no tosilato de piridínio) com um pKa de 5,2 são capazes de servir como catalisadores nesse contexto, apesar da constante de equilíbrio altamente desfavorável para a protonação (Keq <10-10).
Reações diversas
editarAs cetonas se envolvem em muitas reações orgânicas.[6] As reações mais importantes decorrem da suscetibilidade do carbono carbonil à adição nucleofílica e à tendência dos enolatos de se adicionarem aos eletrófilos. As adições nucleofílicas incluem em ordem aproximada de sua generalidade:
- Com água (hidratação), são obtidos dióis geminais, que geralmente não são formados em quantidades apreciáveis (ou observáveis);
- Com um acetileto para dar o α-hidroxialquino;
- Com amônia ou uma amina primária, dá uma imina;
- Com amina secundária dá uma enamina;
- Com reagentes de Grignard e organolítio para obter, após tratamento aquoso, um álcool terciário;
- Com um álcoois ou alcóxidos, obtém-se o hemicetal ou sua base conjugada. Com um diol para o cetal. Esta reação é empregada para proteger cetonas;
- Com a amida de sódio resultando na clivagem da ligação C-C com a formação da amida RCONH2 e do alcano R'H, uma reação chamada reação de Haller-Bauer;
- Com agentes oxidantes fortes para dar ácidos carboxílicos;
- Adição eletrofílica: a reação com um eletrófilo produz um cátion estabilizado por ressonância;
- Com ilídios de fosfônio na reação de Wittig para formar alcenos;
- Com tióis para dar o tioacetal;
- Com hidrazina ou derivados 1-dissubstituídos de hidrazina para dar hidrazonas;
- Com um hidreto de metal (NaBH4 ou LiAlH4), obtém-se um sal alcóxido de metal, cuja hidrólise fornece o álcool, um exemplo de redução de cetona;
- Com halogênios para formar uma α-halocetona, uma reação que prossegue através de um enol (consulte Reação de halofórmio);
- Com outro composto carbonilado, forma um aldol ou após desidratação, uma enona ou enal;
- Com água pesada para dar uma cetona α-deuterada;
- Fragmentação na reação fotoquímica de Norrish;
- Reação de 1,4-aminodicetonas a oxazóis por desidratação na síntese de Robinson-Gabriel;
- No caso das aril-alquil-cetonas, com enxofre e uma amina, produzem amidas na reação de Willgerodt;
- Com hidroxilamina para produzir oximas;
- Com agentes redutores para formar álcoois secundários;
- Com peróxidos para formar ésteres na oxidação de Baeyer-Villiger
Caracterização
editarAldeídos e cetonas apresentam o mesmo grupo carbonila, porém o aldeído difere de uma cetona pelo átomo de hidrogênio ligado ao seu grupo carbonil, facilitando a oxidação . As cetonas não possuem um átomo de hidrogênio ligado ao grupo carbonil e são mais resistentes à oxidação. Eles são oxidados apenas por poderosos agentes oxidantes que têm a capacidade de clivar as ligações carbono-carbono. Esta diferença resulta em métodos que permitem diferenciar estes grupos funcionais.
Espectroscopia
editarCetonas e aldeídos absorvem fortemente no espectro infravermelho próximo a 1730 cm- 1. A conjugação com ligações duplas ou anéis aromáticos diminui a frequência de 20 a 30 cm-1.
De acordo com a espectroscopia de 1H RMN geralmente não é útil para estabelecer a presença de uma cetona, os espectros de 13C RMN exibem sinais um pouco abaixo de 200 ppm, dependendo da estrutura. Tais sinais são tipicamente fracos devido à ausência de efeitos nucleares do Overhauser. Uma vez que os aldeídos ressoam em desvios químicos semelhantes, várias experiências de ressonância são empregadas para distinguir definitivamente aldeídos e cetonas.[7]
Testes orgânicos qualitativos
editarAs cetonas apresentam resultados positivos no teste de Brady, a reação com 2,4-dinitrofenilhidrazina para obter a hidrazona correspondente. As cetonas podem ser distinguidas dos aldeídos, dando um resultado negativo com o reagente de Tollens ou com a solução de Fehling. Metil cetonas fornecem resultados positivos para o teste de iodofórmio.[8] As cetonas também apresentam resultados positivos quando tratadas com meta dinitrobenzeno (m-dinitrobenzeno) na presença de hidróxido de sódio diluído para dar coloração violeta.
Referências
- ↑ a b Lucas Martins. «Função Cetona». InfoEscola. Consultado em 6 de agosto de 2013
- ↑ a b Líria Alves. «Cetonas». R7. Brasil Escola. Consultado em 6 de agosto de 2013
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure(6th ed.), New York: Wiley-Interscience ISBN 978-0-471-72091-1
- ↑ Fundamentos de Química Orgânica- Ciências da Vida e Saúde, Lazzarotto, Márcio, Editora Paco
- ↑ Evans, David A. (4 November 2005). "Evans pKa table"(PDF). Evans group website.
- ↑ Química Orgânica Vol. 2: Volume 1, 2012, Craig B. Fryhle, T. W. Graham Solomons
- ↑ Silverstein, Robert M. (Robert Milton), 1916- (2007). Identificação espectrométrica de compostos orgânicos. [S.l.]: LTC. OCLC 124031126
- ↑ Vogel, Arthur Israel. (2000). Vogel's textbook of quantitative chemical analysis. 6th ed. Harlow: Prentice Hall. OCLC 41504508