Ácido fosfórico
As referências deste artigo necessitam de formatação. (Setembro de 2020) |
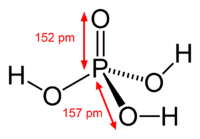
Ácido fosfórico ou ácido ortofosfórico é um composto químico de fórmula molecular H3PO4. É o ácido de fósforo mais importante. Dentre os ácidos minerais, sua força pode ser considerada moderada.[carece de fontes] A partir do ácido fosfórico derivam-se o ácido difosfórico ou pirofosfórico, o ácido metafosfórico e o ácido polifosfórico.
Características
editarO ácido H3PO4 é trivalente, isto é, os três hidrogênios ácidos podem ser convertidos por substituição gradual a fosfatos primários, secundários e terciários. Os valores respectivos de pKa são 2,15 / 7,1 e 12,4. O ácido fosfórico é, portanto, um ácido que varia de fraco a medianamente forte. Seus sais são chamados de fosfatos.
É muito solúvel em água e solúvel em etanol. O ácido fosfórico é muito deliquescente e é geralmente fornecido como uma solução aquosa concentrada a 85%.
É o derivado do fósforo mais importante comercialmente, respondendo por mais de 90% da rocha fosfática que é extraída.[carece de fontes]
O ácido fosfórico origina três séries de sais contendo os íons fosfato (V) cujos ânions são: [(HO)2PO2]-, [(HO)PO3]2- e PO43-. Estes sais apresentam um carácter respectivamente ácido, neutro e alcalino e são muitas vezes utilizados para se obter soluções tampão.
Fabricação
editarNa indústria, o ácido fosfórico pode ser feito por dois métodos:
- via úmida;
- via seca ou térmica;
A via úmida é responsável pela maior parte da produção industrial de ácido fosfórico. Nesse processo, rochas sedimentares ou magmáticas portadoras do mineral apatita (Ca5(PO4)3(X)), sendo X = F, OH ou Cl, reagem com ácido sulfúrico. Os subprodutos do processo são o CaSO4 (gesso, anidrita ou gipsita) e o H2SiF6.
A via seca ou térmica consiste na queima de fósforo branco ao ar, com a formação de P4O10 e sua hidrólise subsequente. O ácido fosfórico produzido dessa forma é de grau farmacêutico.
Propriedades
editar- Densidade: 1,69 típica.
- Massa molecular: 97,97 g/mol.
- pH: < 1.
- Ponto de congelamento: 25 °C.
- Ponto de ebulição: 158 °C.
- Pressão de vapor: (mmHg, 25 °C) 2,24 (água).
- Solubilidade em água: Incompleta, 93%.
- Concentração: 75-85%.
- Inalação: Remover a pessoa para local mais ventilado e a manter em uma posição que não dificulte a respiração. Procurar assistência médica e informar os agentes de saúde sobre o produto inalado.
- Contato com a pele: Retirar as roupas contaminadas e lavar com água em abundância por pelo menos 20 minutos.
- Contato com os olhos: Lave imediatamente os olhos com água corrente em abundância, por no mínimo 20 minutos, mantendo as pálpebras separadas. Procurar assistência médica.
- Ingestão: Não provocar vômito. Enxaguar a boca com água. Deitar a pessoa com a cabeça em posição lateral (de lado) e solicitar auxílio médico imediato.
Principais usos
editar- Indústria de fertilizantes, indústria de produção de sal mineral para alimentação animal, formulação de detergentes, decapante, refrigerantes.
- Indústria de bebidas.
- Odontologia: utilizado para condicionamento de tecido dentário para fixação de sistemas adesivos.
- Recentemente, hobbyistas, geralmente sem recursos industriais para efetuar soldas de elevada temperatura, estão a utilizá-lo para unir aços inoxidáveis e convencionais em conjunto com ligas de estanho/chumbo (solda de fios de eletricidade). Tais ligas possuem a vantagem de se fundirem a temperaturas inferiores a 200℃ e acabam por se unir ao aço inoxidável com ajuda do ácido fosfórico, possibilitando o uso de um simples ferro de solda (conhecido popularmente como "estanhador").
- Indústria farmacêutica.
Fonte: https://sites.google.com/site/scientiaestpotentiaplus/acido-fosforico
Referências
- ↑ «CETESB - Emergencias Quimica - Produtos». sistemasinter.cetesb.sp.gov.br. Consultado em 26 de setembro de 2020
- ↑ http://downloads.labsynth.com.br/FISPQ/rv2012/FISPQ-%20Acido%20Fosforico.pdf