Reação SN2
A reação SN2 é um tipo de mecanismo de reação comum na química orgânica e significa substituição nucleofílica bimolecular. [1]
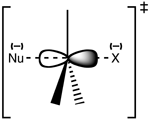
Na reação, a ligação com o grupo de saída é quebrada e se forma uma nova ligação química com um nucleófilo através de seu par de elétrons em uma única etapa. Neste processo não existem intermediários. O nome bimolecular indica que a velocidade da reação depende da concentração do substrato orgânico e do nucleófilo e que ambas espécies estão presentes no estado de transição. [2][3][4]
Neste mecanismo, o tipo de reação é não elementar por ocorrer a etapa lenta e a rápida.
Neste mecanismo, uma ligação é quebrada e uma ligação é formada de forma síncrona, em uma única etapa. SN2 é um tipo de mecanismo de reação de substituição nucleofílica. Outros mecanismos são a substituição nucleofílica unimolecular ( SN1 )[5] e a substituição nucleofílica aromática.
Mecanismo de reação
editarA reação ocorre com mais frequência em um centro de carbono sp3 alifático com um grupo eletronegativo e estável a ele ligado (geralmente designado X). Os casos mais típicos de SN2 ocorrem quando X é um halogênio. A quebra da ligação C-X e a formação da nova ligação (geralmente denominada C-Y ou C-Nu) ocorrem simultaneamente através de um estado de transição no qual um carbono sob ataque nucleofílico é trigonal e considera-se que tenha uma hibridização sp2. O nucleófilo ataca o carbono a 180° em relação ao grupo de saída, pois isso fornece a melhor sobreposição entre o par solitário do nucleófilo e o orbital C-X σ * antiligante. O grupo de saída é então empurrado para o lado oposto e o produto é formado com inversão da geometria tetraédrica no átomo central.
Se o substrato sob ataque nucleofílico é quiral, isso geralmente leva à inversão da configuração (estereoquímica), chamada inversão de Walden.
Em um exemplo da reação SN2, o ataque de Br− (o nucleófilo) a um cloreto de etila (o eletrófilo) resulta em brometo de etila, com o cloreto ejetado como grupo de saída.
O ataque SN2 ocorre quando a aproximação do nucleófilo pelo lado oposto ao grupo de saída não é estereoquimicamente impedida por substituintes no substrato. Portanto, esse mecanismo geralmente ocorre em centros de carbono primário e secundário desimpedidos. Se houver aglomeração estérica no substrato próximo ao grupo de saída, como em um centro de carbono terciário, a substituição segue por um mecanismo SN1 em vez de um mecanismo SN2 (um SN1 também seria mais provável nesse caso porque um intermediário de carbocátion suficientemente estável pode ser formado).
Fatores que afetam a velocidade da reação
editarSubstrato
editarO substrato desempenha o papel mais importante para o avanço da reação, porque o nucleófilo se aproxima pela parte de trás do substrato, rompendo a ligação do grupo que sai do carbono e formando a ligação do carbono-nucleófilo e quanto mais acessível, maior a velocidade da reação pelo mecanismo SN2. No geral, isso significa que os substratos metílico e primário reagem mais rapidamente, seguidos pelos substratos secundários. Substratos terciários não reagem pelo mecanismo SN2, devido ao impedimento estéreo. Estruturas que podem formar cátions altamente estáveis por simples perda do grupo de saída, por exemplo, como um carbocátion estabilizado por ressonância, têm maior probabilidade de reagir por uma via SN1 em competição com SN2.
Nucleófilo
editarA força do nucleófilo é importante nos reações que seguem o mecanismo SN2.[1] A força nucleófila também é afetada pela carga e pela eletronegatividade: a nucleofilicidade aumenta com o aumento da carga negativa e a diminuição da eletronegatividade. Por exemplo, OH- é um nucleófilo melhor que a água e I- é um nucleófilo melhor que Br− (em solventes próticos polares).
Por fim, fatores estéreos também são importante. O ânion metóxido, por exemplo, é uma base forte e nucleófilo, porque é um nucleófilo metílico e, portanto, é muito desimpedido. o terc-butóxido, por outro lado, é uma base forte, mas um nucleófilo pobre, devido aos seus três grupos metil que dificultam sua abordagem ao carbono.
Solvente
editarA interação do nucleófilo com o solvente diminui a velocidade da reação pela disposição de camadas de moléculas de solvente entre o nucleófilo e o substrato, o que dificulta a aproximação de ambos.[6] Os solventes apróticos polares, como o tetrahidrofurano, são melhores solventes para essa reação do que os solventes próticos polares, porque os solventes próticos polares se ligam ao hidrófilo ao nucleófilo, impedindo-o de atacar o carbono com o grupo de saída. Um solvente aprótico polar com baixa constante dielétrica ou uma extremidade dipolar impedida favorecerá a maneira SN2 da reação de substituição nucleofílica. Exemplos: dimetilsulfóxido, dimetilformamida, acetona etc.
Grupo que sai
editarA estabilidade do grupo de saída e a energia de ligação ao átomo de carbono afetam a taxa de reação. Quanto mais estável o grupo de saída, mais favorecida será a sua saída e o padrão de comparação é a acidez do ácido. Quanto mais forte for o ácido, mais estável é a base conjugada. Por exemplo, o HCl tem pKa = -5 e o Cl- é um melhor grupo de saída do que o F-, e o pKa do HF é 4. Exemplos de bons grupos de saída são, portanto, os halogenetos (exceto o fluoreto, devido à sua forte ligação ao átomo de carbono), e os ésteres sulfônicos como o tosilato, enquanto HO- e H2N- não são.
Cinética da reação
editarA taxa de uma reação SN2 é de segunda ordem, pois a etapa de determinação da taxa depende da concentração de nucleófilos, [Nu−], bem como da concentração de substrato, [RX].
v = k [RX] [Nu−]
Essa é o critério para diferenciar entre os mecanismos SN1 e SN2. Na reação SN1, o nucleófilo não participa da etapa limitante da velocidade da reação, enquanto no SN2 o nucleófilo força o grupo de saída na etapa limitante. Existem dois fatores que complicam a determinação do mecanismo de reações de substituição nucleofílica em carbonos secundários:
1) Muitas reações estudadas são reações de solvólise em que uma molécula de solvente - geralmente um álcool, é o nucleófilo. Embora ainda seja uma reação de segunda ordem mecanicamente, a reação é cineticamente de primeira ordem, pois a concentração do nucleófilo - a molécula do solvente é efetivamente constante durante a reação. Esse tipo de reação é freqüentemente chamado de reação pseudo-primeira ordem.
2) Nas reações em que o grupo de saída também é um bom nucleófilo, por exemplo, o grupo de saída pode executar uma reação de SN2 em uma molécula de substrato. Se o substrato é quiral, isso inverte a configuração do substrato antes da solvólise, levando a um produto racemizado - o produto que seria esperado de um mecanismo SN1. No caso de um grupo de saída de brometo em solvente alcoólico Cowdrey et al.[7] mostraram que o brometo pode ter uma velocidade de SN2 100-250 vezes maior que a velocidade para o etanol. Assim, depois de um pequeno avanço na solvólise de um substrato enantiospecífico, torna-se racêmico.
Os exemplos em livros didáticos de substratos secundários utilizados pelo mecanismo SN1 envolvem invariavelmente o uso de brometo (ou outro bom nucleófilo), pois o grupo de partida confundiu o entendimento das reações de substituição de alquil nucleofílico em carbonos secundários por 80 anos [3]. Trabalho com o sistema 2-adamantil (SN2 não é possível) por Schleyer e colaboradores,[8] o uso de azida (um excelente grupo de nucleófilos, mas muito pobre) por Weiner e Sneen, [8] [9] o desenvolvimento de grupos de saída de sulfonato (grupos de saída boa não nucleofílicos) e a demonstração de problemas experimentais significativos na reivindicação inicial de um mecanismo SN1 na solvólise de 2-bromooctano opticamente ativo por Hughes et al.[9] demonstraram conclusivamente que substratos secundários passam exclusivamente (exceto em casos incomuns, mas previsíveis) pelo mecanismo SN2.
Competição E2
editarUma reação lateral comum que ocorre com as reações SN2 é a eliminação de E2: o ânion de entrada pode atuar como base e não como nucleófilo, abstraindo um próton e levando à formação do alceno. Esta via é favorecida com nucleófilos estereoquimicamente impedidos. As reações de eliminação são geralmente favorecidas a temperaturas elevadas[10] por causa do aumento da entropia. Este efeito pode ser demonstrado na reação de fase gasosa entre um sulfonato e um brometo de alquila simples ocorrendo dentro de um espectrômetro de massa:
Com o brometo de etila, o produto da reação é predominantemente o produto de substituição. À medida que aumenta o impedimento estérico ao redor do centro eletrofílico, como no brometo de isobutil, a substituição é desfavorecida e a eliminação é a reação predominante. Outros fatores que favorecem a eliminação são a força da base. Com o substrato de benzoato menos básico, o brometo de isopropil reage com 55% de substituição. Em geral, as reações em fase gasosa e as reações em fase de solução desse tipo seguem as mesmas tendências, embora no primeiro, os efeitos do solvente sejam eliminados.
Referências
editar- ↑ a b Fundamentos de Química Orgânica- Ciências da Vida e Saúde, Lazzarotto, Márcio, Editora Paco
- ↑ Ana Júlia de Aquino Silveira; Substituição Nucleofílica Bimolecular; Universidade Federal do Pará - www.ufpa.br
- ↑ Mecanismos de reações Arquivado em 28 de março de 2007, no Wayback Machine. - www.unirio.br
- ↑ Ricardo Elias de Miranda Candeiro; Unidade Compacta para Produção de Radiotraçador Gasoso CH382Br e Desenvolvimento de Metodologia para Inspeção em Instalações Industriais[ligação inativa]; Tese de doutorado defendida em 2008; COPPE/UFRJ - www.con.ufrj.br
- ↑ MCMURRY_John._Química_Orgânica 4.ed. Rio de Janeiro LTC 1997
- ↑ Hamlin, Trevor A.; van Beek, Bas; Wolters, Lando P.; Bickelhaupt, F. Matthias (2018). "Nucleophilic Substitution in Solution: Activation Strain Analysis of Weak and Strong Solvent Effects". Chemistry – A European Journal. 24 (22): 5927–5938. doi:10.1002/chem.201706075. ISSN 1521-3765. PMC 5947303. PMID 29457865
- ↑ Relation of Steric orientation to Mechanism in Substitution Involving Halogen Atoms and Simple or Substituted Hydroxyl Groups, W. A. Cowdrey, E. D. Hughes, C. K. Ingold, S. Masterman, A. D. Scott, J. Chem. Soc.; 1937; 1252–1271. 10.1039/JR9370001252
- ↑ The 2-Adamantyl System, a Standard for Limiting Solvolysis in a Secondary Substrate J. L. Fry, C. J. Lancelot, L. K. M. Lam, J. M Harris, R. C. Bingham, D. J. Raber, R. E. Hill, P. v. R. Schleyer, J. Am. Chem. Soc.,; 1970; 92, pp 1240-42 (Article); doi: 10.1021/ja00478a031
- ↑ Homogeneous Hydrolysis and Alcoholysis of β-n-Octyl halides, E. D. Hughes, C. K. Ingold, S. Masterman, J. Chem. Soc.; 1937; pp 1196–1201; (Article) doi: 10.1039/JR9370001196
- ↑ Elimination Reactions Are Favored By Heat — Master Organic Chemistry". www.masterorganicchemistry.com. Retrieved 13 April 2018.
- BRESLOW, R.; Organic Reaction Mechanisms, an Introduction; New York: W. A. Benjamin, 1969 - cap. 3.
- ENGBERSEN, J.F.J. en de GROOT, A.E.; Inleiding in de Bio-organische Chemie; Wageningen: Pudoc 1986 - cap. 6.
- HARRIS, J.M. and WANSER, C. C.; Fundamentals of Organic Reaction Mechanisms; New York: Wiley&Sons, 1976 - cap. 4.