Neuroimagiologia
Neuroimagem ou imagem cerebral é o uso de várias técnicas para imagem, direta ou indiretamente, da estrutura, função/farmacologia do sistema nervoso. Essa é uma disciplina relativamente nova dentro da medicina, neurociência e psicologia.[1] Os médicos que se especializam no desempenho e na interpretação da neuroimagem no cenário clínico são denominados neuroradiologistas.

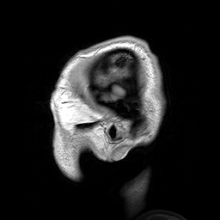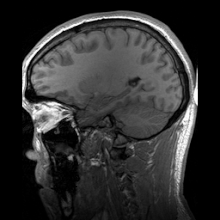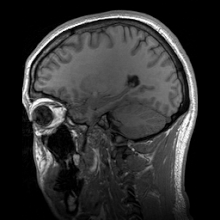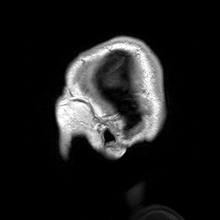
A neuroimagiologia ajusta-se em duas grandes categorias:
- Imagem estrutural, que trata da estrutura do sistema nervoso e do diagnóstico de doença intracraniana bruta (grande escala) como tumor e lesão.
- Imagem funcional, que é usada para diagnosticar doenças metabólicas e lesões em uma escala mais fina (como a doença de Alzheimer) e também para pesquisas de psicologia neurológica e cognitiva e construção de interfaces cérebro-computador.
A imagem funcional permite, por exemplo, o processamento de informações por centros no cérebro para serem visualizados diretamente. Esse processamento faz com que a área envolvida do cérebro aumente o metabolismo e "acenda" na varredura. Um dos usos mais controversos da neuroimagem tem sido a pesquisa sobre a "identificação do pensamento" ou a leitura mental.
História
editarO primeiro capítulo da história dos traços da neuroimagem de volta ao neurocientista italiano Angelo Mosso, que inventou o "equilíbrio da circulação humana", que poderia medir de forma não invasiva a redistribuição do sangue durante a atividade emocional e intelectual.[2] No entanto, mesmo que apenas brevemente mencionado por William James em 1890, os detalhes e o funcionamento preciso deste equilíbrio e os experimentos realizados com Mosso permaneceram em grande parte desconhecidos até a recente descoberta do instrumento original, bem como os relatórios de Mosso de Stefano Sandrone e colegas.[3]
Em 1918, o neurocirurgião americano Walter Dandy introduziu a técnica de ventriculografia. As imagens de raios-X do sistema ventricular dentro do cérebro foram obtidas por injeção de ar filtrado diretamente em um ou ambos os ventrículos laterais do cérebro. Dandy também observou que o ar introduzido no espaço subaracnóideo através da punção espinhal lombar pode entrar nos ventrículos cerebrais e também demonstrar os compartimentos do líquido cefalorraquidiano em torno da base do cérebro e sobre a superfície. Esta técnica foi chamada de pneumoencefalografia.
Em 1927, Egas Moniz introduziu a angiografia cerebral, em que os vasos sangüíneos normais e anormais dentro e ao redor do cérebro poderiam ser visualizados com grande precisão.
No início da década de 1970, Allan McLeod Cormack e Godfrey Newbold Hounsfield introduziram tomografia axial computadorizada (tomografia computadorizada ou tomografia computadorizada) e imagens anatômicas cada vez mais detalhadas do cérebro se tornaram disponíveis para fins de diagnóstico e pesquisa. Cormack e Hounsfield ganharam o Prêmio Nobel de Fisiologia ou Medicina de 1979 por seu trabalho. Logo após a introdução do CAT no início dos anos 80, o desenvolvimento de radioligandos permitiu a tomografia computadorizada de emissão de fótons (SPECT) e a tomografia por emissão de positrons (PET) do cérebro.
Mais ou menos simultaneamente, a ressonância magnética (MRI ou MR scanning) foi desenvolvida por pesquisadores, incluindo Peter Mansfield e Paul Lauterbur, que receberam o Prêmio Nobel de Fisiologia ou Medicina em 2003. No início dos anos 80, a RM foi introduzida clinicamente e durante esse período, ocorreu uma verdadeira explosão de refinamentos técnicos e aplicações diagnósticas de MR. Os cientistas logo descobriram que as grandes alterações do fluxo sanguíneo medidas pelo PET também poderiam ser imaginadas pelo tipo correto de ressonância magnética. A ressonância magnética funcional (FMRI) nasceu, e desde a década de 1990, o IRMF passou a dominar o campo de mapeamento cerebral por sua baixa invasividade, falta de exposição à radiação e disponibilidade relativamente ampla.
No início dos anos 2000, o campo da neuroimagem atingiu o estágio em que as aplicações práticas limitadas da imagem cerebral funcional tornaram-se viáveis. A área de aplicação principal é uma forma bruta de interface cérebro-computador.
Indicações
editarNeuroimagem segue um exame neurológico em que um médico encontrou uma causa para investigar mais profundamente um paciente que teve ou pode ter uma doença neurológica.
Um dos problemas neurológicos mais comuns que uma pessoa pode experimentar é a síncope.[4][5] Em casos de síncope em que a história do paciente não sugere outros sintomas neurológicos, o diagnóstico inclui um exame neurológico, mas a imagem neurológica de rotina não é indicada porque a probabilidade de encontrar uma causa no sistema nervoso central é extremamente baixa e o paciente é improvável para se beneficiar do procedimento.
A neuroimagem não é indicada para pacientes com dores de cabeça estáveis que são diagnosticadas como enxaqueca.[6] Estudos indicam que a presença de enxaqueca não aumenta o risco de doença intracraniana do paciente.[6] Um diagnóstico de enxaqueca que assinala a ausência de outros problemas, como papiledema, não indicaria necessidade de neuroimagem.[6] No decurso da realização de um diagnóstico cuidadoso, o médico deve considerar se a dor de cabeça tem uma causa diferente da enxaqueca e pode exigir neuroimagem.[7]
Outra indicação para a neuroimagem é a cirurgia estereotáxica guiada por CT, MRI e PET ou radiocirurgia para o tratamento de tumores intracranianos, malformações arteriovenosas e outras condições tratáveis cirurgicamente.[8][9][10][11]
Técnicas de imagem cerebral
editarTomografia axial computorizada
editarA tomografia computadorizada (CT) ou a tomografia axial computorizada (CAT) usam uma série de raios-x da cabeça retirados de várias direções diferentes. Usado tipicamente para visualizar rapidamente lesões cerebrais, a tomografia computadorizada usa um programa de computador que realiza um cálculo numérico integral (a transformada de Radônio inversa) na série de raios-x medidos para estimar quanto de um raio de raio-x é absorvido em um pequeno volume do cérebro. Normalmente, a informação é apresentada como seções transversais do cérebro.[12]
Imagem óptica difusa
editarA imagem óptica difusa (DOI) ou a tomografia óptica difusa (DOT) é uma modalidade de imagem médica que usa luz infravermelha próxima para gerar imagens do corpo. A técnica mede a absorção óptica da hemoglobina e depende do espectro de absorção da hemoglobina variando com o seu estado de oxigenação. A tomografia óptica difusa de alta densidade (HD-DOT) foi comparada diretamente ao FMRI usando a resposta à estimulação visual em indivíduos estudados com ambas as técnicas, com resultados tranquilizáveis semelhantes.[13] O HD-DOT também foi comparado ao FMRI em termos de tarefas de linguagem e conectividade funcional do estado de repouso.[14]
Sinal óptico relacionado ao evento
editarO sinal óptico relacionado ao evento (EROS) é uma técnica de varredura cerebral que usa luz infravermelha através de fibras ópticas para medir mudanças nas propriedades ópticas das áreas ativas do córtex cerebral. Enquanto técnicas como a imagem óptica difusa (DOT) e a espectroscopia de infravermelho próximo (NIRS) medem a absorção óptica da hemoglobina e, portanto, são baseadas no fluxo sanguíneo, a EROS aproveita as propriedades de dispersão dos próprios neurônios e, portanto, fornece uma direta mais direta da atividade celular. O EROS pode identificar a atividade no cérebro em milímetros (espacialmente) e em milissegundos (temporariamente). Sua maior desvantagem é a incapacidade de detectar atividades com mais de alguns centímetros de profundidade. O EROS é uma nova técnica relativamente barata que não é invasiva para o assunto do teste. Foi desenvolvido na Universidade de Illinois em Urbana-Champaign, onde agora é usado no Laboratório de Neuroimagem Cognitiva do Dr. Gabriele Gratton e Dr. Monica Fabiani.
Imagem de ressonância magnética
editarA ressonância magnética (MRI) usa campos magnéticos e ondas de rádio para produzir imagens de duas ou três dimensões de estruturas cerebrais de alta qualidade sem uso de radiação ionizante (raios-X) ou traçadores radioativos.
Ressonância magnética funcional
editarA ressonância magnética funcional (FMRI) e a rotulagem de rotação arterial (ASL) dependem das propriedades paramagnéticas da hemoglobina oxigenada e desoxigenada para ver imagens de alteração do fluxo sanguíneo no cérebro associado à atividade neural. Isso permite a geração de imagens que refletem quais estruturas cerebrais são ativadas (e como) durante o desempenho de diferentes tarefas ou em estado de repouso. De acordo com a hipótese de oxigenação, as mudanças no uso de oxigênio no fluxo sanguíneo cerebral regional durante a atividade cognitiva ou comportamental podem ser associadas aos neurônios regionais como diretamente relacionados às tarefas cognitivas ou comportamentais atendidas.
A maioria dos scanners de FMRI permite que os indivíduos sejam apresentados com diferentes imagens visuais, sons e estímulos de toque, e para fazer diferentes ações, como pressionar um botão ou mover um joystick. Consequentemente, o FMRI pode ser usado para revelar estruturas cerebrais e processos associados à percepção, pensamento e ação. A resolução do FMRI é de aproximadamente 2-3 milímetros no presente, limitada pela disseminação espacial da resposta hemodinâmica à atividade neural. Ele substituiu em grande parte o PET para o estudo dos padrões de ativação cerebral. O PET, no entanto, retém a vantagem significativa de ser capaz de identificar receptores específicos do cérebro (ou transportadores) associados a neurotransmissores específicos através da sua capacidade de imagem de "ligandos" de receptores radiomarcados (os ligandos do receptor são quaisquer produtos químicos que se encaixam nos receptores).
Além da pesquisa em assuntos saudáveis, o FMRI é cada vez mais utilizado para o diagnóstico médico da doença. Como o FMRI é esquisitamente sensível ao uso de oxigênio no fluxo sanguíneo, é extremamente sensível às mudanças iniciais no cérebro resultantes da isquemia (fluxo sanguíneo anormalmente baixo), como as mudanças que se seguem ao AVC. O diagnóstico precoce de certos tipos de acidente vascular cerebral é cada vez mais importante na neurologia, uma vez que as substâncias que dissolvem coágulos sanguíneos podem ser usadas nas primeiras horas após a ocorrência de certos tipos de acidente vascular cerebral, mas são perigosas para uso posterior. As alterações cerebrais observadas no FMRI podem ajudar a tomar a decisão de tratar com esses agentes. Com uma precisão de 72% a 90%, onde a chance alcançaria 0,8%,[15] as técnicas de FMRI podem decidir qual de um conjunto de imagens conhecidas que o sujeito está visualizando.[16]
Magnetoencefalografia
editarA magnetoencefalografia (MEG) é uma técnica de imagem usada para medir os campos magnéticos produzidos pela atividade elétrica no cérebro através de dispositivos extremamente sensíveis, como dispositivos de interferência quântica supercondutores (SQUIDs). O MEG oferece uma medida muito direta da atividade elétrica neural (em comparação com FMRI, por exemplo) com resolução temporal muito alta, mas resolução espacial relativamente baixa. A vantagem de medir os campos magnéticos produzidos pela atividade neural é que eles provavelmente serão menos distorcidos pelo tecido circundante (particularmente o crânio e couro cabeludo) em comparação com os campos elétricos medidos por eletroencefalografia (EEG). Especificamente, pode-se mostrar que os campos magnéticos produzidos por atividade elétrica não são afetados pelo tecido da cabeça circundante, quando a cabeça é modelada como um conjunto de conchas esféricas concêntricas, sendo cada um um condutor homogêneo isotrópico. As cabeças reais não são esféricas e têm condutividades em grande parte anisotrópicas (particularmente matéria branca e crânio). Enquanto a anisotropia do crânio tem efeito insignificante sobre MEG (ao contrário do EEG), a anisotropia de substância branca afeta fortemente as medições de MEG para fontes radiais e profundas..[17] Nota-se, no entanto, que o crânio foi assumido de forma uniforme anisotrópica neste estudo, o que não é verdade para uma cabeça real: as espessuras absolutas e relativas das camadas de diploe e tabelas variam entre e dentro dos ossos do crânio. Isso faz com que seja provável que o MEG também seja afetado pela anisotropia[18] do crânio, embora provavelmente não no mesmo grau que o EEG.
Existem muitos usos para o MEG, incluindo a assistência aos cirurgiões na localização de uma patologia, auxiliando os pesquisadores na determinação da função de várias partes do cérebro, neurofeedback e outros.
Tomografia por emissão de positrons
editarA tomografia por emissão de positrons (PET) mede as emissões de substâncias químicas metabólicamente marcadas radioativamente que foram injetadas na corrente sanguínea. Os dados de emissão são processados por computador para produzir imagens de 2 ou 3 dimensões da distribuição dos produtos químicos em todo o cérebro.[19] Os radioisótopos emissores de pósitron utilizados são produzidos por um ciclotron, e os produtos químicos são rotulados com esses átomos radioativos. O composto marcado, chamado de radiotraçador, é injetado na corrente sanguínea e eventualmente abre caminho para o cérebro. Os sensores no scanner de PET detectam a radioatividade à medida que o composto se acumula em várias regiões do cérebro. Um computador usa os dados coletados pelos sensores para criar imagens multicoloridas de 2 ou 3 dimensões que mostram onde o composto atua no cérebro. Especialmente úteis são uma ampla gama de ligandos utilizados para mapear diferentes aspectos da atividade do neurotransmissor, sendo que o marcador de PET com maior freqüência é uma forma de glicose rotulada.
O maior benefício da varredura de PET é que diferentes compostos podem mostrar fluxo sanguíneo e metabolismo de oxigênio e glicose nos tecidos do cérebro em funcionamento. Essas medidas refletem a quantidade de atividade cerebral nas várias regiões do cérebro e permitem aprender mais sobre como o cérebro funciona. As varreduras de PET foram superiores a todos os outros métodos de imagem metabólica em termos de resolução e velocidade de conclusão (até 30 segundos), quando ficaram disponíveis. A resolução aprimorada permitiu que se estudasse melhor a área do cérebro ativada por uma determinada tarefa. A maior desvantagem da digitalização de PET é que, devido à deterioração da radioatividade rapidamente, é limitada ao monitoramento de tarefas curtas.[20] Antes da tecnologia FMRI entrar em linha, a PET scanning era o método preferido da imagem cerebral funcional (ao contrário do estrutural), e continua a fazer grandes contribuições para a neurociência.
A varredura de PET também é usada para o diagnóstico de doenças cerebrais, sobretudo porque tumores cerebrais, acidentes vasculares cerebrais e doenças prejudiciais aos neurônios que causam demência (como a doença de Alzheimer) causam grandes mudanças no metabolismo cerebral, o que, por sua vez, provoca mudanças facilmente detectáveis em PET digitaliza. O PET é provavelmente o mais útil nos primeiros casos de certas demências (com exemplos clássicos de doença de Alzheimer e doença de Pick), onde o dano precoce é muito difuso e faz pouca diferença no volume do cérebro e estrutura bruta para mudar a TC e as imagens de ressonância magnética padrão o suficiente para ser capaz de diferenciá-lo de forma confiável da faixa "normal" de atrofia cortical que ocorre com o envelhecimento (em muitas, mas não todas) pessoas e que não causa demência clínica.
Tomografia computadorizada de emissão de fotón único
editarA tomografia computadorizada de emissão de fotón único (SPECT) é semelhante ao PET e usa radioisótopos emissores de raios gama e uma câmera gama para registrar dados que um computador usa para construir imagens bidimensionais ou tridimensionais de regiões cerebrais ativas.[21] O SPECT depende de uma injeção de rastreador radioativo, ou "agente SPECT", que é rapidamente ocupada pelo cérebro, mas não redistribui. A absorção do agente SPECT é quase 100% completa dentro de 30 a 60 segundos, refletindo o fluxo sanguíneo cerebral (CBF) no momento da injeção. Essas propriedades do SPECT tornam-se particularmente adequadas para imagens de epilepsia, o que geralmente é dificultado por problemas com movimentos do paciente e tipos de crises variáveis. O SPECT fornece um "instantâneo" do fluxo sanguíneo cerebral, uma vez que as varreduras podem ser adquiridas após o término da convulsão (desde que o rastreador radioativo tenha sido injetado no momento da convulsão). Uma limitação significativa do SPECT é a sua má resolução (cerca de 1 cm) em comparação com a da ressonância magnética. Hoje, as máquinas SPECT com Dual Detector Heads são comumente usadas, embora as máquinas Triple Detector Head estejam disponíveis no mercado. A reconstrução tomográfica (principalmente usada para "instantâneos" funcionais do cérebro) requer múltiplas projeções de Detector Heads que rodam em torno do crânio humano, então alguns pesquisadores desenvolveram 6 e 11 máquinas Detector Head SPECT para cortar o tempo de imagem e dar maior resolução.[22][23]
Como o PET, SPECT também pode ser usado para diferenciar diferentes tipos de processos de doenças que produzem demência, e cada vez mais é usado para esse propósito. Neuro-PET tem uma desvantagem de exigir o uso de traçadores com meias-vidas de no máximo 110 minutos, como FDG. Estes devem ser feitos em um ciclotron e são caros ou mesmo indisponíveis se necessário, os tempos de transporte são prolongados mais do que algumas meias-vidas. O SPECT, no entanto, é capaz de fazer uso de traçadores com semi-vidas muito mais longas, como o tecnécio-99m e, como resultado, está muito mais disponível.
Ultra-som craniano
editarA ultra-sonografia craniana geralmente é usada apenas em bebês, cujas fontanelas abertas fornecem janelas acústicas que permitem imagens de ultra-som do cérebro. As vantagens incluem a ausência de radiação ionizante e a possibilidade de escaneamento de cabeceira, mas a falta de detalhes de tecido mole significa que a RM pode ser preferida para algumas condições.
Comparação de tipos de imagem
editarA Imagem de Ressonância Magnética (MRI) depende da atividade magnética no cérebro e não usa raios-X, por isso é considerado mais seguro que as técnicas de imagem que usam os raios-X. O SPECT usa raios gama, que são caracteristicamente mais seguros do que outros sistemas de imagem usando raios alfa ou beta. As varreduras de PET e SPECT exigem a injeção de materiais radioativos, mas as meias-vidas dos isótopos usados no SPECT podem ser mais facilmente gerenciadas.
Crítica e precauções
editarAlguns cientistas criticaram as alegações criadas por imagens cerebrais feitas em revistas científicas e na imprensa popular, como a descoberta de "a parte do cérebro responsável" por funções como talentos, memórias específicas ou gerando emoções como o amor. Muitas técnicas de mapeamento têm uma resolução relativamente baixa, incluindo centenas de milhares de neurônios em um único voxel. Muitas funções também envolvem várias partes do cérebro, o que significa que este tipo de reivindicação é provavelmente não verificável com o equipamento utilizado e, geralmente, com base em uma suposição incorreta sobre como as funções do cérebro estão divididas. Pode ser que a maioria das funções do cérebro só seja descrita corretamente depois de ser medido com medidas muito mais finas que não parecem em grandes regiões, mas sim em um número muito grande de minúsculos circuitos cerebrais individuais. Muitos desses estudos também têm problemas técnicos, como tamanho de amostra pequeno ou calibração de equipamento ruim, o que significa que eles não podem ser reproduzidos - considerações que às vezes são ignoradas para produzir um artigo de jornal sensacional ou manchete de notícias. Em alguns casos, as técnicas de mapeamento cerebral são usadas para fins comerciais, detecção de mentiras ou diagnóstico médico de maneiras que não foram cientificamente validadas.[24]
Ver também
editar- Mapeamento do cérebro
- Esboço do mapeamento cerebral
- Connectogram
- Integração funcional (neurobiologia)
- Espectroscopia funcional do infravermelho próximo
- Neuroimagem funcional
- História da neuroimagem
- Cérebro humano
- Neurociência cognitiva
- Esboço do cérebro humano
- Lista de software de neuroimagem
- Lista de bancos de dados de neurociências
- Imagem de ressonância magnética
- Magnetoencefalografia
- Computação de imagem médica
- Imagem médica
- Revisões de neuroimagem
- Mapeamento paramétrico estatístico
- Estimulação magnética transcraneal
- Morfometria baseada em Voxel
Referências
- ↑ Filler, Aaron (12 de julho de 2009). «The History, Development and Impact of Computed Imaging in Neurological Diagnosis and Neurosurgery: CT, MRI, and DTI». Nature Precedings (em inglês). doi:10.1038/npre.2009.3267.5
- ↑ Sandrone, Stefano; Bacigaluppi, Marco; Galloni, Marco R.; Martino, Gianvito (1 de novembro de 2012). «Angelo Mosso (1846–1910)». Journal of Neurology (em inglês). 259 (11): 2513–2514. ISSN 0340-5354. doi:10.1007/s00415-012-6632-1
- ↑ Sandrone, Stefano; Bacigaluppi, Marco; Galloni, Marco R.; Cappa, Stefano F.; Moro, Andrea; Catani, Marco; Filippi, Massimo; Monti, Martin M.; Perani, Daniela (1 de fevereiro de 2014). «Weighing brain activity with the balance: Angelo Mosso's original manuscripts come to light». Brain. 137 (2): 621–633. ISSN 0006-8950. doi:10.1093/brain/awt091
- ↑ Miller, Thomas H.; Kruse, Jerry E. (15 de outubro de 2005). «Evaluation of syncope». American Family Physician. 72 (8): 1492–1500. ISSN 0002-838X. PMID 16273816
- ↑ «Guidelines for the diagnosis and management of syncope (version 2009)The Task Force for the Diagnosis and Management of Syncope of the European Society of Cardiology (ESC)». European Heart Journal. 30 (21): 2631–2671. 1 de novembro de 2009. ISSN 0195-668X. PMID 19713422. doi:10.1093/eurheartj/ehp298
- ↑ a b c Silberstein, Stephen D.; Consortium, for the US Headache (26 de setembro de 2000). «Practice parameter: Evidence-based guidelines for migraine headache (an evidence-based review) Report of the Quality Standards Subcommittee of the American Academy of Neurology». Neurology (em inglês). 55 (6): 754–762. ISSN 0028-3878. PMID 10993991. doi:10.1212/wnl.55.6.754
- ↑ Lewis, Donald W.; Dorbad, David (1 de setembro de 2000). «The Utility of Neuroimaging in the Evaluation of Children With Migraine or Chronic Daily Headache Who Have Normal Neurological Examinations». Headache: The Journal of Head and Face Pain (em inglês). 40 (8): 629–632. ISSN 1526-4610. doi:10.1046/j.1526-4610.2000.040008629.x
- ↑ Thomas, D. G.; Anderson, R. E.; Boulay, G. H. du (1 de janeiro de 1984). «CT-guided stereotactic neurosurgery: experience in 24 cases with a new stereotactic system.». Journal of Neurology, Neurosurgery & Psychiatry (em inglês). 47 (1): 9–16. ISSN 0022-3050. PMID 6363629. doi:10.1136/jnnp.47.1.9
- ↑ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH Jr, Cosman E, Ganz E (1987). «Brown-Roberts-Wells stereotactic frame modifications to accomplish magnetic resonance imaging guidance in three planes». Applied Neurophysiology. 50 (1–6): 143–152. PMID 3329837. doi:10.1159/000100700
- ↑ Leksell, L.; Leksell, D.; Schwebel, J. (1 de janeiro de 1985). «Stereotaxis and nuclear magnetic resonance.». Journal of Neurology, Neurosurgery & Psychiatry (em inglês). 48 (1): 14–18. ISSN 0022-3050. PMID 3882889. doi:10.1136/jnnp.48.1.14
- ↑ Levivier, Marc; Massager, Nicolas; Wikler, David; Lorenzoni, José; Ruiz, Salvador; Devriendt, Daniel; David, Philippe; Desmedt, Françoise; Simon, Stéphane (Julho de 2004). «Use of stereotactic PET images in dosimetry planning of radiosurgery for brain tumors: clinical experience and proposed classification». Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 45 (7): 1146–1154. ISSN 0161-5505. PMID 15235060
- ↑ Jeeves, Malcolm A. (1994). Mind Fields: Reflections on the Science of Mind and Brain. Grand Rapids, MI: Baker Books., p. 21
- ↑ Eggebrecht, AT; White, BR; Ferradal, SL; Chen, C; Zhan, Y; Snyder, AZ; Dehghani, H; Culver, JP (16 de julho de 2012). «A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping.». NeuroImage. 61 (4): 1120–8. PMC 3581336 . PMID 22330315. doi:10.1016/j.neuroimage.2012.01.124
- ↑ Eggebrecht AT, Ferradal SL, Robichaux-Viehoever A, Hassanpour MS, Dehghani H, Snyder AZ, Hershey T, Culver JP. «Mapping distributed brain function and networks with diffuse optical tomography». Nat Photonics. 8: 448–454. PMC 4114252 . PMID 25083161. doi:10.1038/nphoton.2014.107
- ↑ Smith, Kerri (5 de Março de 2008). «Mind-reading with a brain scan». Nature News. Nature Publishing Group. Consultado em 5 de março de 2008
- ↑ Keim, Brandon (5 de Março de 2008). «Brain Scanner Can Tell What You're Looking At». Wired News. CondéNet. Consultado em 16 de setembro de 2015
- ↑ Wolters, C. H.; Anwander, A.; Tricoche, X.; Weinstein, D.; Koch, M. A.; MacLeod, R. S. (15 de abril de 2006). «Influence of tissue conductivity anisotropy on EEG/MEG field and return current computation in a realistic head model: A simulation and visualization study using high-resolution finite element modeling». NeuroImage. 30 (3): 813–826. doi:10.1016/j.neuroimage.2005.10.014
- ↑ Ramon, Ceon; Haueisen, Jens; Schimpf, Paul H. (2006). «Influence of head models on neuromagnetic fields and inverse source localizations». BioMedical Engineering OnLine. 5. 55 páginas. ISSN 1475-925X. doi:10.1186/1475-925x-5-55
- ↑ Lars-Goran Nilsson and Hans J. Markowitsch (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers., page 57
- ↑ Lars-Goran Nilsson and Hans J. Markowitsch (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers., pg. 60
- ↑ Philip Ball Brain Imaging Explained
- ↑ «SPECT Systems for Brain Imaging». Consultado em 24 de Julho de 2014
- ↑ «SPECT Brain Imaging». Consultado em 12 de Janeiro de 2016
- ↑ Sally Satel; Scott O. Lilienfeld (2015). Brainwashed: The Seductive Appeal of Mindless Neuroscience. [S.l.]: Basic Books. ISBN 978-0465062911
Ligações externas
editar- The Whole Brain Atlas @ Harvard
- A Neuroimaging portal
- "Transcranial Magnetic Stimulation". by Michael Leventon in association with MIT AI Lab.