Tuberculose
Tuberculose é uma doença infeciosa geralmente causada pela bactéria Mycobacterium tuberculosis (MTB).[1] A tuberculose afeta geralmente os pulmões, embora possa também afetar outras partes do corpo.[1] A maioria das infeções não manifesta sintomas, sendo nesses casos denominada tuberculose latente.[1] Cerca de 10% das infeções latentes evoluem para tuberculose ativa. Se não for tratada, a tuberculose ativa causa a morte a metade das pessoas infetadas.[1] Os sintomas clássicos da tuberculose ativa são tosse crónica com expulsão de sangue, escarro, febre, suores noturnos e perda de peso.[1][4] A infeção de outros órgãos pode causar vários outros sintomas.[5]
| Tuberculose | |
|---|---|
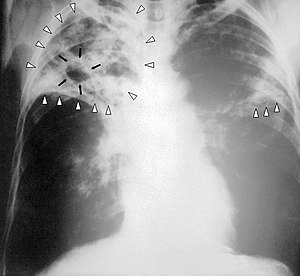
| Radiografia ao peito de uma pessoa com tuberculose avançada. As setas brancas assinalam a infeção em ambos os pulmões. As setas pretas assinalam a formação de uma cavidade. | |
| Especialidade | Infectologia, pneumologia |
| Sintomas | tosse crónica, febre, expectoração com sangue, perda de peso[1] |
| Causas | Mycobacterium tuberculosis[1] |
| Fatores de risco | Tabagismo, VIH/SIDA[1] |
| Método de diagnóstico | Radiografia torácica, cultura microbiológica, prova de tuberculina[1] |
| Condições semelhantes | Pneumonia necrotizante, histoplasmose, sarcoidose, coccidioidomicose[2] |
| Prevenção | Vacina BCG |
| Tratamento | Antibióticos[1] |
| Frequência | 33% da população (latente)[1] |
| Mortes | 1,3 milhão (2016)[3] |
| Classificação e recursos externos | |
| CID-11 | 2072728114 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077, 000624 |
| eMedicine | 230802 |
| MeSH | D014376 |
A tuberculose é transmitida por via aérea quando as pessoas com tuberculose ativa nos pulmões tossem, cospem, falam ou espirram.[1][6] As pessoas com tuberculose latente não transmitem a doença.[1] A infeção ativa é mais comum entre fumadores e pessoas com VIH/SIDA.[1] O diagnóstico de tuberculose ativa é apoiado por radiografias ao peito, exames microscópicos e culturas de fluidos corporais.[7] O diagnóstico de tuberculose latente baseia-se na prova da tuberculina ou análises ao sangue.[7]
Entre as medidas de prevenção estão o rastreio de grupos de risco, deteção e tratamento atempados dos casos e vacinação com o bacilo Calmette-Guérin (vacina BCG).[8][9][10] Os grupos de risco incluem as pessoas que partilham casa ou local de trabalho com pessoas com tuberculose ativa.[10] O tratamento consiste na administração de vários antibióticos durante um longo período de tempo.[1] A resistência antibiótica é um problema crescente, estando a aumentar o número de casos de tuberculose multirresistente (MDR-TB) e a tuberculose extensivamente resistente (XDR-TB).[1]
Estima-se que cerca de um terço da população mundial esteja infetada com tuberculose latente.[1] Todos os anos ocorrem novos casos de infeção em cerca de 1% da população.[11] Em 2016 ocorreram em todo o mundo mais de 10 milhões de casos de tuberculose ativa, tendo sido a causa de cerca de 1,3 milhão de mortes.[3] Isto faz com que a tuberculose seja a principal causa de morte por doenças infeciosas.[3] Mais de 95% destas mortes ocorreram em países em vias de desenvolvimento, principalmente na Índia, China, Indonésia, Paquistão e Filipinas.[3] Desde o ano 2000 que o número de novos casos em cada ano tem vindo a diminuir.[1] Em muitos países africanos e asiáticos cerca de 80% da população apresenta prova de tuberculina positiva, enquanto nos Estados Unidos este valor é de apenas 5–10% da população.[12] A doença está presente nos seres humanos desde a Antiguidade.[13]
Sinais e sintomas editar
Entre seus sintomas, pode-se mencionar tosse com secreção, febre (mais comumente ao entardecer), suores noturnos, falta de apetite, emagrecimento, cansaço fácil e dores musculares. Dificuldade na respiração, eliminação de sangue (Hemoptise) e acúmulo de secreção na pleura pulmonar são características em casos mais graves.
Transmissão editar
A tuberculose é transmitida pelos bacilos expelidos por um indivíduo contaminado quando tosse, fala, espirra ou cospe.[14] A tuberculose se dissemina através de aerossóis no ar que são expelidas quando pessoas com tuberculose infecciosa tossem, espirram. Contactos próximos (pessoas que tem contato frequente) têm alto risco de se infectarem. A transmissão ocorre somente a partir de pessoas com tuberculose infecciosa activa (e não de quem tem a doença latente).
A probabilidade da transmissão depende do grau de infecção da pessoa com tuberculose e da quantidade expelida, forma e duração da exposição ao bacilo, e a virulência.
A cadeia de transmissão pode ser interrompida isolando-se pacientes com a doença ativa e iniciando-se uma terapia antituberculose eficaz.
A tuberculose resistente é transmitida da mesma forma que as formas sensíveis a medicamentos. A resistência primária se desenvolve em pessoas infectadas inicialmente com micro-organismos resistentes. A resistência secundária (ou adquirida) surge quando a terapia contra a tuberculose é inadequada ou quando não se segue ou se interrompe o regime de tratamento prescrito.
Infecção editar
A infecção pelo M. tuberculosis se inicia quando o bacilo atinge os alvéolos pulmonares e pode espalhar-se para os nódulos linfáticos e daí, através da corrente sanguínea para tecidos mais distantes onde a doença pode desenvolver-se: a parte superior dos pulmões, os rins, o cérebro e os ossos. Isto quando está em seu estado primário.[15]
A resposta imunológica do organismo mata a maioria dos bacilos, levando à formação de um granuloma. Os "tubérculos", ou nódulos de tuberculose são pequenas lesões que consistem em tecidos mortos de cor acinzentada contendo a bactéria da tuberculose.
Normalmente, o sistema imunológico é capaz de conter a multiplicação do bacilo, evitando sua disseminação em 90% dos casos.
Evolução editar
Entretanto, em algumas pessoas, o bacilo da tuberculose supera as defesas do sistema imunológico e começa a se multiplicar, resultando na progressão de uma simples infecção por tuberculose para a doença em si. Isto pode ocorrer logo após a infecção (tuberculose primária – 1 a 5% dos casos), ou vários anos após a infecção (reativação da doença tuberculosa, ou bacilo dormente – 5 a 9%).
Cerca de 5% das pessoas infectadas vão desenvolver a doença nos dois primeiros anos, e outras 5% vão desenvolvê-la ainda mais tarde. No total, cerca de 10% dos infectados com sistema imunológico normalmente desenvolverão a doença durante a vida.[16]
Algumas situações aumentam o risco de progressão da tuberculose. Em pessoas infectadas com o HIV ou outras doenças que deprimem o sistema imunológico tem muito mais chances de desenvolverem complicações. Outras situações de risco incluem: o abuso de drogas injetáveis; infecção recente de tuberculose nos últimos 2 anos; raio-x do tórax que sugira a existência de tuberculose (lesões fibróticas e nódulos); diabetes mellitus, silicose, terapia prolongada com corticosteróides e outras terapias imunossupressivas, câncer na cabeça ou pescoço, doenças no sangue ou reticuloendoteliais (leucemia e doença de Hodgkin), doença renal em estágio avançado, gastrectomia, síndromes de mal-absorção crônicas, ou baixo peso corporal (10% ou mais de peso abaixo do ideal).
A tuberculose afeta principalmente os pulmões,[17] (75% ou mais) e é chamada de tuberculose pulmonar.
Os sintomas incluem tosse prolongada com duração de mais de três semanas, dor no peito e hemoptise. Outros sintomas incluem febre, calafrios, suores noturnos, perda de apetite e de peso, e cansaço fácil. A palavra consunção (consumpção, em Portugal) surgiu porque os doentes pareciam ter sido "consumidos por dentro" pela doença.
Outros locais do corpo que são afetados incluem a pleura, o sistema nervoso central (meninges), o sistema linfático, o sistema geniturinário, ossos e articulações, ou pode ser disseminada pelo corpo (tuberculose miliar - assim chamada porque as lesões que se formam parecem pequenos grãos de milho). Estas são mais comuns em pessoas com supressão imunológica e em crianças. A tuberculose pulmonar também pode evoluir a partir de uma tuberculose extrapulmonar.
Diagnóstico editar
Uma avaliação médica completa para a tuberculose ativa inclui um histórico médico, um exame físico, a baciloscopia de escarro, uma radiografia do tórax e culturas microbiológicas. A prova tuberculínica (também conhecida como teste tuberculínico ou teste de Mantoux) está indicada para o diagnóstico da infecção latente, mas também auxilia no diagnóstico da doença em situações especiais, como no caso de crianças com suspeita de tuberculose. Toda pessoa com tosse por três semanas ou mais é chamada sintomática respiratória (SR) e pode estar com tuberculose.
Baciloscopia editar
A baciloscopia é um exame realizado com o escarro do paciente suspeito de ser vítima de tuberculose, colhido em um potinho estéril. Para o exame são necessárias duas amostras. Uma amostra deve ser colhida no momento da identificação do sintomático respiratório e a outra na manhã do dia seguinte, com o paciente ainda em jejum após enxaguar a boca com água. É importante orientar o paciente a não cuspir, mas sim escarrar. No Brasil, esse exame está disponível no SUS e pode ser solicitado por enfermeiros e médicos.
Histórico médico editar
O histórico médico inclui a obtenção de sintomas da tuberculose pulmonar:
- tosse intensa e prolongada por três ou mais semanas;
- dor no peito; e
- hemoptise.
Sintomas sistêmicos incluem:
Outras partes do histórico médico incluem:
- exposição anterior à tuberculose, na forma de infecção ou doença;
- tratamento anterior de tuberculose;
- fatores de risco demográficos para a tuberculose; e
- condições médicas que aumentem o risco de infecção por tuberculoses, tais como a infecção por HIV.
Deve-se suspeitar de tuberculose quando uma doença respiratória persistente - num indivíduo que de outra forma seria saudável - não estiver respondendo aos antibióticos regulares.
Exame físico editar
Um exame físico é feito para avaliar a saúde geral do paciente e descobrir outros fatores que podem afetar o plano de tratamento da tuberculose. Não pode ser usado como diagnosticador da tuberculose.
Radiografia do tórax editar
Uma radiografia postero-anterior do tórax é a tradicionalmente feita; outras vistas (lateral ou lordótico) ou imagens de tomografia computadorizada podem ser necessárias.
Em tuberculose pulmonar ativa, infiltrações ou consolidações e/ou cavidades são frequentemente vistas na parte superior dos pulmões com ou sem linfadenopatia (doença nos nódulos linfáticos) mediastinal ou hilar. No entanto, lesões podem aparecer em qualquer lugar nos pulmões. Em pessoas com HIV e outras imunossupressões, qualquer anormalidade pode indicar a tuberculose, ou o raio-x dos pulmões pode até mesmo parecer inteiramente normal.
Em geral, a tuberculose anteriormente tratada aparece no raio-x como nódulos pulmonares na área hilar ou nos lóbulos superiores, apresentando ou não marcas fibróticas e perda de volume. Bronquiectasia (isto é, dilatação dos brônquios com a presença de catarro) e marcas pleurais podem estar presentes.
Nódulos e cicatrizes fibróticas podem conter bacilos de tuberculose em multiplicação lenta, com potencial para progredirem para uma futura tuberculose ativa. Indivíduos com estas características em seus exames, se tiverem um teste positivo de reação subcutânea à tuberculina, devem ser consideradas candidatos de alta prioridade ao tratamento da infecção latente, independentemente de sua idade. De modo oposto, lesões granulares calcificadas (granulomas calcificados) apresentam baixíssimo risco de progressão para uma tuberculose ativa.
Anormalidades detectadas em radiografias do tórax podem sugerir, porém, nunca são exatamente o diagnóstico, de tuberculose. Entretanto, estas radiografias podem ser usadas para descartar a possibilidade de tuberculose pulmonar numa pessoa que tenha reação positiva ao teste de tuberculina mas que não tenha os sintomas da doença.
Detecção editar
Desde 2008, que uma equipe de cientistas treina na Tanzânia 77 ratos-africanos-gigantes para detectar a tuberculose. A primeira experiência que foi desenvolvida mostrou que em 910 amostras de 456 pacientes, dez ratos encontraram 67 por cento de pessoas com tuberculose e 48 por cento foram encontrados pelos microscópios dos laboratórios.[18] Os ratos aumentaram as taxas de detecção em mais de 30%. A tecnologia começou em 2013 a ser aplicada em Maputo[19] e esses ratos heróis passaram a contribuir para identificar a doença que, apesar de curável, ainda faz cerca de 1 milhão de vítimas fatais ao redor do mundo; Brasil e Moçambique estão no grupo dos 22 países onde ocorrem 80% dos casos de tuberculose do mundo.[20]
Teste de biossensor magnético baseado em nanopartículas editar
Uma abordagem usa nanopartículas magnéticas e manchas bacterianas misturadas[21] com amostras de escarro dos pacientes. Os profissionais de saúde misturam a secreção de muco em um frasco e o expõem a um ímã. A visualização das amostras através de um microscópio revela aglomerados vermelhos de nanopartículas carregadas (positivas) ou nanopartículas marrons dispersas (negativas). Os cientistas desenvolveram um aplicativo para smartphone usando um algoritmo de inteligência artificial que também pode revisar as amostras.[22] A precisão é alta (85%), e o aplicativo serve como uma ótima ferramenta para estender a cobertura em grandes áreas remotas. Os pesquisadores relatam que o teste detecta tuberculose em 10 a 20 minutos com precisão de 95% a 99% e custa apenas 10 centavos de dólar por teste.
Estudos microbiológicos editar
Análises de amostras de escarro e culturas microbiológicas devem ser feitas para detectar o bacilo, caso o paciente esteja produzindo secreção. Se não estiver produzindo-a, uma amostra coletada na laringe, uma broncoscopia ou uma aspiração por agulha fina podem ser consideradas. O bacilo pode ser cultivado, apesar de crescer lentamente e então, ou imediatamente após colheita da amostra corado (com a técnica de Ziehl-Neelsen) e observado ao microscópio óptico.
Prova tuberculínica (teste tuberculínico ou de Mantoux) editar
O teste intradérmico de Mantoux é usado no Brasil, nos Estados Unidos e no Canadá. O teste de Heaf é usado no Reino Unido. Um resultado positivo indica que houve contato com o bacilo (infecção latente da tuberculose), mas não indica doença, já que, após o contágio, o indivíduo apresenta 5% de chances de desenvolver a doença nos primeiros 2 anos. Este teste é utilizado para fins de controle epidemiológico e profilaxia em contactantes de pacientes com tuberculose. Em situações específicas, como no caso do diagnóstico da doença em crianças, pode auxiliar no diagnóstico.
O derivado de proteína purificada (ou PPD), que é um precipitado obtido de culturas filtradas e esterilizadas, é injetado de forma intradérmica (isto é, dentro da pele) e a leitura do exame é feita entre 48 e 96 horas (idealmente 72 horas) após a aplicação do PPD. Um paciente que foi exposto à bactéria deve apresentar uma resposta imunológica na pele, a chamada "enduração".
Classificação da reação à tuberculina editar
Os resultados são classificados como Reator Forte, Reator Fraco ou Não Reator. Um endurecimento de mais de 5–15 mm (dependendo dos fatores de risco da pessoa) a 10 unidades de Mantoux é considerado um resultado positivo, indicando infecção pelo M. tuberculosis.
- 5 mm ou mais de tamanho são positivos para a tuberculose em:
- pacientes positivos para o HIV
- contatos com casos recentes de tuberculose
- pessoas com mudanças nodulares ou fibróticas em raios-X do tórax, consistentes com casos antigos de tuberculose curada
- Pacientes com órgãos transplantados e outros pacientes imunossuprimidos
- 10 mm ou mais é positivo em:
- Pessoas recém-chegadas (menos de 5 anos) de países com alta incidência da doença (isso inclui quem mora no Brasil)
- Utilizadores de drogas injetáveis
- Residentes e empregados de locais de aglomerações de alto risco (exemplos: prisões, enfermarias, hospitais, abrigos de sem-tetos, etc.)
- Pessoal de laboratórios onde se faça testes com Mycobacterium
- Pessoas com condições clínicas de alto risco (exemplosː diabetes, terapias prolongadas com corticosteroides, leucemia, falência renal, síndromes de mal-absorção crônicas, reduzido peso corporal etc.)
- Crianças com menos de 4 anos de idade, ou crianças e adolescentes expostos a adultos nas categorias de alto risco
- 15 mm ou mais é positivo em: (não utilizado no Brasil)
- Pessoas sem fatores de risco conhecidos para a tuberculose
- (Nota: programas de testes cutâneos normalmente são conduzidos entre grupos de alto risco para a doença)
Um teste negativo não exclui tuberculose ativa, especialmente se o teste foi feito entre 6 e 8 semanas após adquirir-se a infecção; se a infecção for intensa, ou se o paciente tiver comprometimento imunológico.
Um teste positivo não indica doença ativa, apenas que o indivíduo teve contato com o bacilo.
Não há relação entre a eficácia da vacina BCG e um teste de Mantoux positivo.[23]
Uma BCG é suficiente; a revacinação não é útil. Uma vacinação prévia por BCG dá, por vezes, resultados falso-positivos. Isto torna o teste de Mantoux pouco útil em pessoas vacinadas por BCG.
A fim de melhorar o Teste de Mantoux, outros testes estão sendo desenvolvidos. Um dos considerados promissores observa a reação de linfócitos-T aos antígenos ESAT6 e CFP10.
- Teste de Heaf
O Teste de Heaf é usado no Reino Unido, e também injeta a proteína purificada (PPD) na pele, observando-se a reação resultante.
Quando alguém é diagnosticado com tuberculose, todos os seus contatos próximos devem ser investigados com um teste de Mantoux e, principalmente, radiografias de tórax, a critério médico.
Sistema de classificação editar
O sistema de classificação para a tuberculose mostrado abaixo é baseado no grau de patogenia da doença.
Os agentes de saúde devem obedecer às leis de cada país no tocante à notificação de casos de tuberculose. As situações descritas em 3 ou 5 na tabela abaixo devem ser imediatamente notificadas às autoridades de saúde locais.
| Sistema de classificação para a tuberculose. | ||
|---|---|---|
| Classe | Tipo | Descrição |
| 0 | Nenhuma exposição à tuberculose Não infectado |
Nenhum histórico de exposição Reação negativa ao teste de tuberculina dérmico |
| 1 | Exposição à tuberculose Nenhuma evidência de infecção |
Histórico de exposição Reação negativa ao teste dérmico de tuberculina |
| 2 | Infecção de tuberculose Sem doença |
Reação positiva ao teste dérmico de tuberculina Estudos bacteriológicos negativos (caso tenham sido feitos) Nenhuma evidência clínica, bacteriológica ou radiográfica de tuberculose |
| 3 | Tuberculose clinicamente ativa | Cultura de M. tuberculosis (caso tenha sido feita) Evidências clínicas, bacteriológicas, ou radiográficas da doença |
| 4 | Tuberculose não ativa clinicamente |
Histórico de episódio(s) de tuberculose ou Sinais anormais porém estáveis nas radiografias Reação positiva ao teste dérmico de tuberculina Estudos bacteriológicos negativos (se feitos) e Nenhuma evidência clínica ou radiográfica de presença da doença |
| 5 | Suspeita de tuberculose | Diagnóstico pendente A doença deve ser confirmada ou descartada dentro de 3 meses |
Prevenção editar
A imunização com vacina BCG dá entre 50% a 80% de resistência à doença. Em áreas tropicais onde a incidência de micobactérias atípicas é elevada (a exposição a algumas "micobactérias" não transmissoras de tuberculose dá alguma proteção contra a tuberculose), a eficácia da BCG é bem menor. No Reino Unido, adolescentes de 15 anos são normalmente vacinadas durante o período escolar.
Tratamento editar
O artigo ou secção Tuberculostático deverá ser fundido aqui. (desde setembro de 2022) Se discorda, discuta sobre esta fusão na página de discussão deste artigo. |
Pessoas com infecção de tuberculose (classes 2 ou 4), mas que não têm a doença (como nas classes 3 ou 5), não espalham a infecção para outras pessoas. A infecção por tuberculose numa pessoa que não tem a doença não é considerada um caso de tuberculose e normalmente é relatada como uma infecção latente de tuberculose. Esta distinção é importante porque as opções de tratamento são diferentes para quem tem a infecção latente e para quem tem a doença ativa.
Tratamento de infecção latente de tuberculose editar
O tratamento da infecção latente é essencial para o controle e eliminação da tuberculose, pela redução do risco de a infecção vir a tornar-se doença ativa. Uma avaliação para descartar tuberculose ativa é necessária antes que um tratamento para tuberculose latente seja iniciado.
Candidatos ao tratamento de tuberculose latente são aqueles grupos de muito alto risco, com reação positiva à tuberculina de 5 mm ou mais, assim como aqueles grupos de alto risco com reações cutâneas de 10 mm ou mais. Veja em inglês na Wikipédia, classification of tuberculin reaction.
Há vários tipos de tratamento disponíveis, a critério médico.
- Por décadas, o tratamento indicado consistia no uso de isoniazida por 180 a 270 doses diariamente (seis a nove meses), porém havia problemas decorrentes da baixa adesão e efeitos adversos do medicamento. Inúmeros esforços têm sido realizados de forma a alterar esse esquema de tratamento para períodos inferiores e minimizando as intercorrências.
- As recentes alterações sugeridas incluem o tratamento, em casos específicos, com monoterapia com rifampicina em, no mínimo, 120 doses (quatro meses).
- Contatos próximos
Contatos próximos são aqueles que dividem a mesma habitação ou outros ambientes fechados. Aqueles com riscos maiores são as crianças com idade inferior a 4 anos, pessoas imunodeprimidas e outros que possam desenvolver a tuberculose logo após uma infecção. Contatos próximos que tenham tido uma reação negativa ao teste de tuberculina (menos de 5 mm) devem ser novamente testados 10 a 12 semanas após sua última exposição à tuberculose. O tratamento da tuberculose latente pode ser descontinuado a critério médico.
- Crianças
Crianças com menos de 4 anos de idade têm grande risco de progressão de uma infecção para a doença, e de desenvolverem formas de tuberculose potencialmente fatais. Estes contatos próximos normalmente devem receber tratamento para tuberculose latente mesmo quando os testes de tuberculina ou o raio-X do tórax não sugerem tuberculose.
Um segundo teste de tuberculina normalmente é feito de 10 a 12 semanas após a última exposição à tuberculose infecciosa, para que se decida se o tratamento será descontinuado ou não.
Tratamento de tuberculose ativa editar
Os tratamentos recentes para a tuberculose ativa incluem uma combinação de drogas e remédios, às vezes num total de quatro, que são reduzidas após certo tempo, a critério médico. Não se utiliza apenas uma droga, pois, neste caso, todas as bactérias sensíveis a ela morrem, e, três meses depois, o paciente sofrerá infecção de bactérias que conseguiram resistir a esta primeira droga. Alguns medicamentos matam a bactéria, outros agem contra a bactéria infiltrada em células, e outros, ainda, impedem a sua multiplicação. Ressalve-se que o tratamento deve seguir uma continuidade com acompanhamento médico, e não deve ser suspenso pelo paciente após uma simples melhora. Com isto, evita-se que cepas da bactéria mais resistentes sobrevivam no organismo, e retornem posteriormente com uma infecção mais difícil de curar. O tratamento dura seis meses, porém, nos casos de tuberculose multirresistente, pode durar até um ano e gerar efeitos colaterais como surdez, náusea e psicose.[24]
Epidemiologia editar
Todos os anos, milhões de pessoas são infectadas com tuberculose. Embora, atualmente, esta doença tenha tratamento, ainda mata, anualmente, 1,7 milhão de pessoas, principalmente na África e no Sudeste Asiático.[16]
Com controle feito pela Organização Mundial da Saúde (OMS) e outras organizações de saúde, e com tratamentos cada vez mais eficazes para doenças imunes, o número de casos no mundo vem caindo consideravelmente em todos os continentes. O local com mais casos é o sudeste asiático, com 34%, seguido da África, com 30% dos casos, e das ilhas do Pacífico, com 21%. Na Europa, ocorrem apenas 4,5% e, nas Américas, apenas 2,9%.[16]
O Brasil é, segundo dados de 2010 do Ministério da Saúde, o 19º país com maior número de casos da doença. Cerca de 73% dos novos casos são curados, 12% a menos do preconizado pela OMS.[25]
História editar
Por conta de seus variados sintomas, a tuberculose não era identificada como uma única doença até à segunda década do século XIX, e não era chamada de tuberculose até ser batizada em 1839 por J.L. Schöenlein. Algumas formas da doença provavelmente eram conhecidas desde a Grécia antiga, senão antes, considerando-se que a doença se originou a partir do primeiro gado domesticado (no qual também se originou a varíola humana) e antigamente não existia vacina.
O bacilo causador da doença, Mycobacterium tuberculosis foi descrito em 24 de março de 1882 por Robert Koch. Ele recebeu em 1905 o Prémio Nobel de medicina por sua descoberta. Koch não acreditava que as tuberculoses bovina e humana fossem similares, o que impediu o reconhecimento do leite infectado como fonte da doença. Mais tarde, esta fonte foi eliminada graças à pasteurização. Koch apresentou um extrato de glicerina com o bacilo da tuberculose como um "remédio" para a doença em 1890, chamando-o de tuberculina. Ele não teve eficácia, porém, foi mais tarde adaptado por von Pirquet para um teste para tuberculose pré-sintomática.
O primeiro sucesso genuíno de vacinação contra a tuberculose foi desenvolvido a partir de linhagens atenuadas da tuberculose bovina, criado pelos franceses Albert Calmette e Camille Guérin em 1906 no Instituto Pasteur. Era a vacina BCG (Bacilo de Calmette e Guerin). Ela foi usada pela primeira vez em humanos em 18 de julho de 1921 na França, apesar de nacionalismos terem impedido a disseminação de seu uso, seja nos Estados Unidos, Reino Unido ou Alemanha até o final da Segunda Guerra Mundial.
A tuberculose causou enorme preocupação pública no século XIX e no início do século XX, como a doença endêmica entre as classes pobres das cidades. Na Inglaterra de 1815, uma entre quatro mortes eram devido à tísica pulmonar; por volta de 1918, uma dentre seis mortes na França ainda era causada pela tuberculose. Depois de ter ficado claro, por volta de 1880, que a doença era contagiosa, a tuberculose se tornou uma doença de notificação obrigatória na Grã-Bretanha; foram feitas campanhas para que não se escarrasse em locais públicos, e as pessoas com a infecção eram "encorajadas" a irem para sanatórios que chegavam a lembrar prisões. Apesar dos "benefícios" do ar fresco e do trabalho apregoados nos sanatórios, 75% dos que neles entravam morriam num prazo de 5 anos (dados de 1908).
A preocupação com a disseminação foi tanta em alguns países, como os EUA, que chegou a surgir um movimento contrário a que se escarrasse em público, exceto em locais com escarradeiras.
Na Europa, as mortes por tuberculose caíram de 500 por 100 000 pessoas em 1850 para 50 em 100 000 por volta de 1950. Melhorias na saúde pública já vinham reduzindo a incidência de tuberculose mesmo antes do surgimento dos antibióticos, apesar de a importância da doença ainda ser grande quando o chamado Medical Research Council da Grã-Bretanha lançou seus primeiros projetos para a doença em 1913.
Somente após 1946, com o desenvolvimento do antibiótico estreptomicina, é que o tratamento, e não apenas a prevenção, se tornaram possíveis. Antes disso, somente a intervenção cirúrgica era possível como tratamento (além dos sanatórios), incluindo a técnica do pneumotórax: provocar o colapso de um pulmão infectado para deixá-lo "descansar" e permitir a cicatrização das lesões, técnica muito habitual mas pouco benéfica, e que foi posta de lado após 1946.
Esperanças de que a doença pudesse ser completamente eliminada foram frustradas desde o surgimento de cepas de bacilos resistentes aos antibióticos nos anos 1980. Por exemplo, os casos de tuberculose no Reino Unido, por volta de 50 000 em 1955, caíram para cerca de 5 500 em 1987, mas em 2001 havia mais de 7 000 casos confirmados. Por conta da eliminação de instalações de tratamento públicas em Nova Iorque nos anos 1970, houve uma ressurgência da doença nos anos 1980. O número daqueles que interrompem seu tratamento é muito alto. Nova Iorque teve que lidar com mais de 20 000 pacientes "desnecessários" com muitas cepas resistentes a muitas das drogas normalmente usadas. O ressurgimento da tuberculose resultou na declaração de uma emergência médica global pela Organização Mundial da Saúde (OMS) em 1993.
Um outro sério agravante foi a epidemia de AIDS pelo mundo, que aumenta em muitas vezes as chances de desenvolvimento de sérias complicações da tuberculose. A tuberculose foi a principal responsável pela morte de pessoas com AIDS no mundo nas últimas décadas.[16]
Sociedade e cultura editar
Ficção editar
A tuberculose influenciou alguns artistas do movimento literário conhecido como Romantismo, como Lord Byron (na Inglaterra) ou Álvares de Azevedo, no Brasil. A aparência pálida, "assombrada" dos que sofriam de tuberculose é vista como influência nos trabalhos de Edgar Allan Poe e nas histórias sobre vampiros. Num período recente, esta estética foi revivida pela subcultura "gótica". No século XIX, a doença ficou conhecida como o "Mal do Século". Também no livro Frei Luís de Sousa, uma das maiores obras românticas portuguesas de Almeida Garret, Maria, filha de dona Madalena de Vilhena e de dom Manuel de Sousa, sofre de tuberculose.
Mimi, a heroína da ópera de Puccini, La Bohème, sofre de tuberculose - o mesmo acontece com Violeta, de "La Traviata" de Verdi, inspirada na obra de Alexandre Dumas, filho, A Dama das Camélias, imortalizando a tuberculose como doença do amor.
No romance da escritora norte-americana Sylvia Plath The Bell Jar, o protagonista Buddy Willard sofre de tuberculose. Também a novela Mundo Fechado de Agustina Bessa-Luís tem, como protagonista, um jovem padecente desse mal. A Montanha Mágica de Thomas Mann, relata uma visita de um jovem, Hans Castorp, a um sanatório em Davos na Suíça, onde está seu primo. No sanatório, Hans descobre estar também com a doença e prolongará aí a sua estadia. No Brasil, no século XX, a doença influenciou muitas obras do poeta modernista Manuel Bandeira, nascido em 1886 e tuberculoso desde os dezoito anos, como o seu poema "Pneumotórax".
Há também a tuberculosa protagonista Satine de Moulin Rouge!, a qual é uma cortesã que se apaixona por um jovem poeta, Christian. No anime/mangá Bleach, escrito por Tite Kubo, o capitão do esquadrão 13 de defesa, Ukitake Juushirou sofre de tuberculose. No livro Crime e castigo escrito por Fiódor Dostoiévski, a personagem Catierina Ivanova sofre de tuberculose, no livro chamada de tísica.
Na série de jogos de luta de videogame Samurai Shodown, um dos personagens: Ukyo Tachibana, sofre de tuberculose, no jogo, ele pode ser visto tossindo constantemente entre as lutas. No jogo eletrônico Red Dead Redemption 2, o protagonista da obra, Arthur Morgan, descobre estar sofrendo de tuberculose durante o capítulo VI. Pelo restante do jogo, Arthur começa a sofrer crises de tosse e tem suas habilidades e aparência afetadas pela doença.
Notificação editar
No Brasil, a tuberculose é uma doença de notificação obrigatória (compulsória), ou seja, qualquer caso confirmado tem que ser obrigatoriamente notificado.[26][27]
Dia Mundial da Tuberculose editar
O Dia Mundial da Tuberculose ou Dia Mundial de Combate à Tuberculose,[28] celebrado em 24 de março de cada ano, foi criado para conscientizar o público sobre a epidemia global de tuberculose e os esforços para eliminar a doença.[29]
Ver também editar
- Meningite
- Mycobacterium bovis, causadora de tuberculose no gado
- Tuberculose pleural
Referências
- ↑ a b c d e f g h i j k l m n o p q r «Tuberculosis Fact sheet N°104». WHO. Outubro de 2015. Consultado em 11 de fevereiro de 2016. Cópia arquivada em 23 de agosto de 2012
- ↑ Ferri, Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders 2nd ed. Philadelphia, PA: Elsevier/Mosby. p. Chapter T. ISBN 0323076998
- ↑ a b c d «Global tuberculosis report». World Health Organization (em inglês). Consultado em 9 de novembro de 2017
- ↑ The Chambers Dictionary. New Delhi: Allied Chambers India Ltd. 1998. 352 páginas. ISBN 978-81-86062-25-8. Cópia arquivada em 6 de setembro de 2015
- ↑ Dolin, [edited by] Gerald L. Mandell, John E. Bennett, Raphael (2010). «250». Mandell, Douglas, and Bennett's principles and practice of infectious diseases 7.ª ed. Philadelphia, PA: Churchill Livingstone/Elsevier. ISBN 978-0-443-06839-3
- ↑ «Basic TB Facts». CDC. 13 de março de 2012. Consultado em 11 de fevereiro de 2016. Cópia arquivada em 6 de fevereiro de 2016
- ↑ a b Konstantinos A (2010). «Testing for tuberculosis». Australian Prescriber. 33 (1): 12–18. Arquivado do original em 4 de agosto de 2010
- ↑ Hawn TR, Day TA, Scriba TJ, Hatherill M, Hanekom WA, Evans TG, Churchyard GJ, Kublin JG, Bekker LG, Self SG (dezembro de 2014). «Tuberculosis vaccines and prevention of infection». Microbiology and Molecular Biology Reviews. 78 (4): 650–71. PMC 4248657 . PMID 25428938. doi:10.1128/MMBR.00021-14
- ↑ Harris, Randall E. (2013). Epidemiology of chronic disease: global perspectives. Burlington, MA: Jones & Bartlett Learning. p. 682. ISBN 9780763780470
- ↑ a b Organization, World Health (2008). Implementing the WHO Stop TB Strategy: a handbook for national TB control programmes. Geneva: World Health Organization. p. 179. ISBN 9789241546676
- ↑ «Tuberculosis». World Health Organization. 2002. Arquivado do original em 17 de junho de 2013
- ↑ Kumar V, Abbas AK, Fausto N, Mitchell RN (2007). Robbins Basic Pathology 8th ed. [S.l.]: Saunders Elsevier. pp. 516–522. ISBN 978-1-4160-2973-1
- ↑ Lawn SD, Zumla AI (julho de 2011). «Tuberculosis». Lancet. 378 (9785): 57–72. PMID 21420161. doi:10.1016/S0140-6736(10)62173-3
- ↑ Jorge, AOC. Princípios de biossegurança em odontologia. Departamento de Odontologia da Universidade de Taubaté. Faculdade de Odontologia de São José dos Campos/UNESP. [Texto da internet]. Disponível em: . UNESP. Acesso em: 19 de agosto de 2010
- ↑ «TUBERCULOSE». PREFEITURA MUNICIPAL DE SAPOPEMA. Consultado em 29 de outubro de 2019
- ↑ a b c d e «Tuberculosis (TB)». www.who.int (em inglês). Consultado em 23 de março de 2024
- ↑ Villar, CMC; Macedo, LA; Monte, LNC; Cortizo, V. Uveíte tuberculosa sem manifestação pulmonar: série de casos. Congresso Aspimed. [Texto da internet] Disponível em: . Congresso Aspimed[ligação inativa]. Acesso em: 17 de agosto de 2010
- ↑ Moçambique: ratos gigantes são treinados para identificar a tuberculose Arquivado em 8 de julho de 2014, no Wayback Machine. publicado pela "Green Savers" (2014)
- ↑ "Ratos Heróis" detetam tuberculose em Maputo publicado pela Deutsche Welle (2013)
- ↑ O encantador de ratos Arquivado em 13 de abril de 2016, no Wayback Machine. por Everton Lopes (2015)
- ↑ Alocilja, Evangelyn C.; Romero-Sandoval, Natalia; Martín, Miguel; Enríquez-Ríos, Natán; Jonapá-Gómez, Letisia; Gómez-Bustamante, Adriana; Bencomo-Alerm, Allied; Muñoz-Jiménez, Sergio G.; Murray, Nathan (dezembro de 2018). «Magnetic Nanoparticle-Based Biosensing Assay Quantitatively Enhances Acid-Fast Bacilli Count in Paucibacillary Pulmonary Tuberculosis». Biosensors (em inglês). 8 (4). 128 páginas. doi:10.3390/bios8040128
- ↑ «Machine learning flags patients at risk of TB comeback». Futurity (em inglês). 15 de fevereiro de 2019. Consultado em 29 de agosto de 2019
- ↑ Bricks, LF. Vacina BCG: via percutânea ou intradérmica?. J. Pediatr. (Rio J.) vol.80 no.2 Porto Alegre Mar./Apr. 2004. Disponível em: Jornal de Pediatria[ligação inativa]. Acesso em: 14 de agosto de 2010
- ↑ El País Brasil. Disponível em http://brasil.elpais.com/brasil/2015/09/01/politica/1441120198_053979.html. Acesso em 15 de maio de 2016.
- ↑ Tuberculose cai, mas país ainda está entre os piores do mundo - Folha de S.Paulo, 25 de março de 2010 (visitado em 25-3-2010)
- ↑ Pereira, SHF. Uso de geoprocessamento na análise espacial da tuberculose na área urbana de Viçosa - MG. Monografia de graduação. Bacharelado em Geografia. Universidade Federal de Viçosa. Viçosa, 2006 [texto da internet]. Disponível em: . UFV. Acesso em: 17 de agosto de 2010
- ↑ Hijjar, MA; Gerhardt, G; Teixeira, GM; Procópio, MJ. Retrospecto do controle da tuberculose no Brasil. Revista Saúde Pública 2007; 41 (supl. 1) 50:58. Disponível em: . Revista de Saúde Pública. Acesso em: 17 de agosto de 2010
- ↑ «24/3 – Dia Mundial de Combate à Tuberculose». Biblioteca Virtual em Saúde – Ministério da Saúde. Consultado em 23 de março de 2023. Cópia arquivada em 30 de dezembro de 2022
- ↑ «Global Tuberculosis Report» (PDF). WHO (em inglês). WHO. 2019. Consultado em 23 de março de 2023
Bibliografia editar
- Core Curriculum on Tuberculosis: What the Clinician Should Know, 4th edition (2000). Publicado pela Division of Tuberculosis Elimination dos EUA. (Internet version acessado em agosto de 2003)
- Joint Tuberculosis Committee of the British Thoracic Society. Control and prevention of tuberculosis in the United Kingdom: Code of Practice 2000. Thorax 2000;55:887-901 (em inglês)(fulltext)
- Chan ED, Iseman MD. Current medical treatment for tuberculosis. (British Medical Journal) 2002;325:1282-6 (Texto completo, em inglês)
- Treatment of Tuberculosis 2003 ATS/CDC/IDSA American Thoracic Society CDC Infectious Diseases Society of America, Formato PDF, em inglês
- Targeted Tuberculin Testing and Treatment of Latent Tuberculosis Infection 2000 ATS/CDC (formato PDF, em inglês) (Atualizações (updates) 2001-2003)
Ligações externas editar
- Organizações
- Organização Mundial de Saúde - Tuberculose página da OMS, apresentando estratégias e ações, monitoramento e avaliação da doença no mundo (em inglês)
- The Stop Tuberculose Partnership Organização Internacional. (em inglês)
- Ministério da Saúde de Portugal
- Ministério da Saúde do Brasil
- Ciência Viva - Tuberculose
- Saúde em Moçambique página oficial
- Rede Brasileira de Pesquisa e Combate à Tuberculose Atividades da rede, dados estatísticos, prevenção, tratamento, estudos clínicos, etc.
- Memória da Tuberculose no sítio da Tuberculose Óssea. Biografia de médicos que combateram a doença no Brasil.
- Tuberculose pulmonar: O que é? Como se adquire?
- Centro de Documentação Bissaya Barreto: Para o Estudo da Assistência à Tuberculose em Coimbra e em Portugal
- Imagens adicionais de raios X
- Atlas de Radiografias do Tórax (chest X-ray Atlas) - Doenças selecionadas|Tuberculose em raios-x (imagens mostrando cavidades, infiltrações, marcas, efusão pleural, nódulos intersticiais de Tuberculose miliar) - da Loyola University, Chicago Stritch School of Medicine ©
- eMedicine Radiology © - imagens de raios-x, tomografias, e ressonância magnética de vários casos de Tuberculose:
- Pulmão; Tuberculose Primária (primary tuberculosis) - opacidade focal, consolidação, efusão pleural, linfoadenopatia, cavidade, nódulo.
- Pulmão com tuberculose pós-primária
- Pulmão com infecção por mycobactérias não tuberculose - cavidade, perda de volume, fibrose, nódulo, broncoestasia, linfadenopatia
- Tuberculose CNS
- Tuberculose gastrointestinal - linfadenopatia, dilação
- Tuberculose no trato Genitourinário - calcificação, granuloma, cavitação, edema, ulceração, abscesso