Usuário:Vini 175/Teste
| Leishmaniose | |
|---|---|
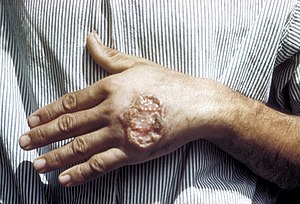
| Leishmaniose cutânea na mão de um adulto. | |
| Classificação e recursos externos | |
| CID-10 | B55 |
| CID-9 | 085 |
| DiseasesDB | 3266 29171 3266 7070 |
| MedlinePlus | 001386 |
| eMedicine | emerg/296 |
introdução
Etiologia
editarCiclo de vida
editarEpidemiologia
editarImunopatogênese
editarA invasão do hospedeiro pelo parasito causador da leishmaniose leva o organismo a desenvolver uma resposta imune contra o protozoário. No entanto, pelo fato de ser um parasito intracelular, invadindo, principalmente, os macrófagos, que são células do sistema mononuclear fagocitário, a resposta imune produzida nem sempre é efetiva no combate ao invasor. Estudos experimentais em murinos ajudam a explicar o mecanismo de resposta do hospedeiro, auxiliando na compreensão do que torna um indivíduo suscetível ou resistente à doença e o que determina a intensidade das manifestações clínicas que ele experimentará após a infecção.[1]
A imunidade mediada por células é fundamental no combate a infecções por microorganismos intracelulares e tem na sua linha de frente os linfócitos T auxiliares (CD4+), que circulam o organismo constantemente em busca de antígenos estranhos expostos por células apresentadoras de antígenos, dentre elas os macrófagos, por meio do complexo principal de histocompatibilidade (MHC). A interação de um linfócito T auxiliar virgem com um antígeno leva essa célula a um processo de diferenciação que a converte (por alteração da expressão gênica) em um dos tipos de linfócitos T efetores, que atuam no combate ao microorganismo. Existem duas subpopulações principais de células efetoras nas quais os linfócitos T podem se diferenciar: os linfócitos T auxiliares do tipo 1 (TH1) e do tipo 2 (TH2).[2] As células TH1 secretam um padrão de citocinas, incluindo altas concentrações de interferon-gama (IFN-γ), que contribui para a ativação de macrófagos, o que é importante na resposta a infecções intracelulares. Por sua vez, o subgrupo das células TH2 não é tão eficiente no combate a patógenos intracelulares, porque estimula a proliferação de linfócitos B e, portanto, induz uma resposta imune baseada na produção de anticorpos, os quais são mais importantes na defesa contra parasitos extracelulares.[3]
Para a leishmaniose cutânea, estudos em camundongos infectados com a espécie L. major demonstraram um modelo indicativo de que quando a resposta imune à infecção é polarizada na diferenciação dos linfócitos T em TH1, que produzem IFN-γ, o indivíduo apresenta manifestações clínicas auto-limitadas, que regridem com o tempo, pois os macrófagos são capacitados a se defenderem contra o parasito, produzindo, entre outras substâncias, o óxido nítrico. Porém, se a resposta pender para a diferenciação em TH2, os animais se tornam altamente suscetíveis à doença, por expressarem citocinas, como a interleucina 4 (IL-4), que falham no combate contra o protozoário. No entanto, estudos em humanos têm demonstrado que o paradigma TH1/TH2 estudado em modelos animais é uma simplificação de um sistema muito complexo de regulação e contra-regulação.[4]
Em geral, a maioria das pessoas infectadas pelas espécies causadoras da leishmaniose visceral (L. donovani e L. infantum/chagasi) jamais desenvolve a doença. Isso parece estar diretamente relacionado à competência do organismo em combater o parasito e impedir o progresso da infecção. Em camundongos experimentalmente infectados com amastigotas, o parasito se multiplica rapidamente no fígado, mas seu crescimento é controlado pela formação de granuloma, resultado de uma resposta imune mediada por células. No entanto, uma parte dos indivíduos infectados desenvolve a doença, provavelmente, porque há uma falha do sistema imune em conter o parasito. Inicialmente, o desenvolvimento da leishmaniose visceral no hospedeiro parecia estar relacionado a uma resposta imune celular polarizada na diferenciação de células T em TH2, entretanto, outros estudos demonstraram um típico aumento da produção de citocinas e quimiocinas pró-inflamatórias, sugerindo que outros mecanismos contribuem para a patogênese da leishmaniose visceral.[5]
TH1
- Resposta celular humoral contra o parasito é desenvolvida pelo sistema imune do hospedeiro
- Murinos: padrão Th1/Th2 (na forma cutânea e visceral)
- Th1: resistência do hospedeiro
- Th2: suscetibilidade
- Mecanismos que determinam a polarização da resposta
- Murinos: padrão Th1/Th2 (na forma cutânea e visceral)
- Relação entre o padrão de resposta e a forma clínica na Leishmaniose Cutânea Americana (Th1, Th2, Th0)
Aspectos clínicos
editarDiagnóstico
editar- métodos de detecção do parasita:
- aspiração de linfonodo
- aspiração de medula óssea
- aspiração esplênica/do baço
- biópsia em outros tecidos
- métodos sorológicos:
- DAT
- IFAT
- ELISA
- outros testes
- imunocromatografia
- KAtex
- teste para detecção de ácidos nucléicos: PCR
- testes para imunidade celular:
- teste da proliferação de linfócitos
- teste intradérmico
Tratamento
editarEm 1912, o médico brasileiro Gaspar Vianna introduziu o uso dos sais de antimônio (Sb) no tratamento da leishmaniose cutânea. Poucas mudanças ocorreram entre essa época e os dias de hoje, tanto que os compostos antimoniais ainda consistem nos medicamentos de primeira linha para o tratamento das diversas apresentações da leishmaniose em humanos. Atualmente, existem dois antimoniais pentavalentes (Sb+5) disponíveis no mercado, o antimoniato de N-metilglucamina (Glucantime®) e o estibogliconato sódico (Pentostam®). No Brasil, a droga de escolha é o Glucantime®, distribuído gratuitamente na rede pública de saúde.
O mecanismo de ação dos antimoniais ainda não está completamente elucidado, mas sabe-se que eles atuam sobre o metabolismo energético do protozoário, inibindo a via glicolítica e a oxidação de ácidos graxos, levando à destruição das formas amastigotas pela inibição da síntese de ATP. A absorção oral dos antimoniais é baixa, por isso a via parenteral (injeção endovenosa ou intramuscular) é preferida. Sua excreção se dá pela urina. Já foram relatadas formas resistentes aos antimoniais.[6]
A anfotericina B, um antibiótico poliênico muito aplicado no combate a doenças causadas por fungos, também é empregada no tratamento da leishmaniose como droga de segunda escolha, quando não há resposta satisfatória após terapia com antimonial pentavalente. Em gestantes, a anfotericina B é o medicamento indicado. A droga age sobre o episterol, precursor do ergosterol, éster que compõe a membrana citoplasmática das formas amastigotas de Leishmania. Sua administração é por via endovenosa. Uma nova formulação, a anfotericina B lipossomal, tem sido aplicada em alguns casos de leishmaniose visceral grave.
Outras drogas têm sido introduzidas no tratamento da leishmaniose, como as pentamidinas e a miltefosine, que vem sendo aplicada na Índia para o manejo da leishmaniose visceral. Aminosidina, interferon-gama, imidazóis e alopurinol são medicamentos, eventualmente, inseridos em esquemas terapêuticos alternativos.
Profilaxia e controle
editarHistórico
editarDescrições de lesões similares à leishmaniose cutânea foram descobertas em placas de argila do século VII a.C., algumas das quais podem ter sido reproduzidas de textos ainda mais antigos, de 1500 a 2500 a.C. Médicos muçulmanos, incluindo Avicena, já no século X, fizeram descrições detalhadas do que foi chamado de "ferida de Balkh".[7] Na América, cerâmicas pré-incas no Peru e no Equador, muitas vezes retratavam rostos humanos com desfigurações muito semelhantes às causadas pela leishmaniose mucocutânea.[8] Textos provenientes do período de colonização espanhola frequentemente mencionam lesões cutâneas em agricultores indígenas que trabalhavam nas encostas orientais dos Andes; a doença era chamada de "doença do vale" ou "doença dos Andes" e, posteriormente, "lepra branca".[9][8]
Médicos indianos denominavam a doença como kala-azar (pronunciada kālā āzār; do sânscrito: kālā = negro e āzār = febre, significando "febre negra"). Em 1756, Alexander Russell, após examinar um paciente turco, fez uma das primeiras e mais detalhadas descrições da doença, até então conhecida como "botão de Alepo", entretanto, não se sabia a causa.[9] A descoberta do organismo é um tanto disputada. O cirurgião do exército britânico na Índia, David D. Cunningham, possivelmente foi quem primeiro observou o parasito, em 1885, mas sem associá-lo à doença.[10][11] Peter Borovsky, um cirurgião militar russo, trabalhando em Tashkent, conduziu uma pesquisa para descobrir a etiologia da ferida comum no oriente, conhecida como "ferida de Sart" e, em 1898, publicou a primeira descrição precisa do agente causador, descrevendo a relação do parasita com o hospedeiro e se referindo corretamente ao organismo como um protozoário. Entretanto, pelo fato de seus resultados terem sido publicados em russo e em um periódico de baixa circulação, não foram reconhecidos durante sua existência.[12]
Em 1901, William Boog Leishman identificou um organismo em esfregaços obtidos do baço de um paciente que tinha morrido da "febre dum-dum", (derivado da cidade de Dum-Dum) e o descreveu como sendo um tripanossomatídeo.[13] Poucos meses depois, o capitão Charles Donovan descobriu o que posteriormente seria chamado de corpúsculos de Leishman-Donovan em esfregaços obtidos de pacientes em Madras.[14] Leishman e Donovan, separadamente, e desconhecendo a publicação de Borovsky, descreveram novamente o parasito no ano de 1903.[15] Mas foi Ronald Ross, no mesmo ano, quem propôs que os corpúsculos de Leishman-Donovan eram os estágios intracelulares do parasita, que foi nomeado de Leishmania donovani.[16] A relação com a doença kala-azar foi primeiramente sugerida por Charles Donovan, mas foi conclusivamente demonstrada por Charles Bentley que descobriu a Leishmania donovani em pacientes com kala-azar.[17] Ainda no mesmo ano, James Homer Wright, nomeou a espécie Helcosoma tropicum (atualmente, Leishmania tropica) isolada de uma paciente armênia portadora da forma cutânea da doença.[15]
As lesões de pele das regiões neotropicais não tinham sido associadas ao parasita Leishmania até 1909, quando Adolpho Lindenberg, independentemente, e a dupla Antonio Carini e Ulysses Paranhos demonstraram os corpúsculos de Leishman-Donovan nas lesões de pacientes com a chamada "úlcera de Bauru" ou "úlcera brava". Naquela época, as obras de abertura de ferrovias a partir da cidade de Bauru, no estado de São Paulo, em direção ao interior do Mato Grosso, acabaram revelando a existência de regiões endêmicas dessa doença no Brasil.[18] Alfonso Splendore, em 1911, demonstrou a presença do parasita nas lesões mucocutâneas da espúndia ou úlcera de Bauru.[8] Em 1912, o médico brasileiro Gaspar Vianna nomeou o parasita causador das leishmanioses cutâneas do Novo Mundo como Leishmania braziliensis.[15]
Referências
- ↑ Neves, DP; Melo AL; Linardi PM; Vitor RWA (2005). Parasitologia Humana 11 ed. São Paulo: Atheneu. p. 47-64
- ↑ Abbas, AK; Lichtman AH (2007). Imunologia Básica - Funções e Distúrbios do Sistema Imunológico 2 ed. Rio de Janeiro: Elsevier. p. 91-114
- ↑ Delves, PJ; Martin SJ; Burton DR; Roitt IM (2011). Roitt's Essential Immunology (em inglês) 12 ed. Oxford: Wiley-Blackwell. p. 227-262
- ↑ Sharma, U; Singh S (2009). «Immunobiology of leishmaniasis». Indian J Exp Biol. 47 (6). pp. 412–423. PMID 19634705
- ↑ Kumar, R; Nylén S (2012). «Immunobiology of visceral leishmaniasis». Front Immunol. 3. 251 páginas. PMC 3418610 . PMID 22912637. doi:10.3389/fimmu.2012.00251
- ↑ Croft, SL; Sundar S; Fairlamb AH (2006). «Drug Resistance in Leishmaniasis». Clin Microbiol Rev. 19 (1). pp. 111–26. PMID 16418526
- ↑ Cox, Francis E G (1996). The Wellcome Trust illustrated history of tropical diseases. London: The Wellcome Trust. pp. 206–217. ISBN 9781869835866
- ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeLainson 2010 - ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeBari 2006 - ↑ Cunningham, DD (1885). On the presence of peculiar parasitic organisms in the tissue of a specimen of Delhi boil. Col: Scientific memoirs officers Medical Sanitary Departments Government India. Calcutá: Printed by the superintendent of government printing, India. pp. 21–31
- ↑ Cox FE (2002). «History of Human Parasitology». Clin. Microbiol. Rev. 15 (4): 595–612. PMC 126866 . PMID 12364371. doi:10.1128/CMR.15.4.595-612.2002
- ↑ Hoare C.A. (1938). «Early discoveries regarding the parasite of oriental sore». Transactions of the Royal Society of Tropical Medicine and Hygiene. 32 (1): 67–92. doi:10.1016/S0035-9203(38)90097-5
- ↑ Leishman, W. B. (1903). «On the possibility of the occurrence of trypanomiasis in India». The British Medical Journal
- ↑ Donovan, C. (1903). «Memoranda: On the possibility of the occurrence of trypanomiasis in India». The British Medical Journal
- ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeRey - ↑ R. Ross (1903). «Further notes on Leishman's bodies». Ibid.: ii: 1401
- ↑ C. A. Bentley (24 December 1903). «Telegram to R. Ross». Ross Archives: 47/157 Verifique data em:
|data=(ajuda) - ↑ Suassuna, I (2006). «Brasileiros pioneiros na história da microbiologia médica 2. Gaspar Vianna (1885-1914)». Rev Para Med. 20 (2). pp. 71–3