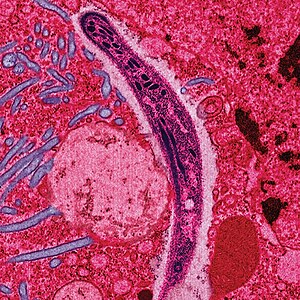
Malária
Malária é uma doença infecciosa transmitida por mosquitos e causada por protozoários parasitários do género Plasmodium.[2] Os sintomas mais comuns são febre, fadiga, vómitos e dores de cabeça.[1] Em casos graves pode causar icterícia, convulsões, coma ou morte.[1] Os sintomas começam-se a manifestar entre 10 e 15 dias após a picada.[2] Quando não é tratada, a doença pode recorrer meses mais tarde.[2] Uma nova infeção geralmente causa sintomas mais ligeiros.[1] No entanto, esta imunidade parcial pode desaparecer no prazo de meses a anos se a pessoa não for continuamente exposta à doença.[1]
| Malária | |
|---|---|
| O parasita Plasmodium ao atravessar o citoplasma de uma célula epitelial da fêmea do mosquito, na forma com que penetra no corpo do ser humano e de outros vertebrados. | |
| Sinónimos | Paludismo, impaludismo, maleita |
| Especialidade | Infectologia |
| Sintomas | Febre, vómitos, dores de cabeça[1] |
| Complicações | Icterícia, convulsões, coma[1] |
| Início habitual | 10–15 dias após exposição[2] |
| Causas | Parasita Plasmodium transmitido por mosquitos[1] |
| Método de diagnóstico | Análises ao sangue, testes de diagnóstico rápido de malária[1] |
| Prevenção | Redes mosquiteiras, repelente de insetos, controlo biológico dos mosquitos, medicação[1] |
| Medicação | Antimaláricos[2] |
| Frequência | 216 milhões (2016)[3] |
| Mortes | 730 500 (2015)[4] |
| Classificação e recursos externos | |
| CID-10 | B50-B54 |
| CID-9 | 084 |
| CID-11 | 1439886552 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| eMedicine | med/1385 emerg/305 ped/1357 |
| MeSH | D008288 |
A doença é geralmente transmitida pela picada de uma fêmea infectada do mosquito Anopheles.[2] A picada introduz no sistema circulatório do hospedeiro os parasitas presentes na sua saliva.[2] Os parasitas depositam-se no fígado, onde se desenvolvem e reproduzem.[1] Existem cinco espécies de Plasmodium que podem infetar os seres humanos.[1] A maior parte das mortes são causadas pelo P. falciparum. As espécies P. vivax, P. ovale e P. malariae geralmente causam formas menos graves de malária que raramente são fatais.[1][2] A espécie P. knowlesi raramente causa a doença em seres humanos.[2] O diagnóstico de malária tem por base análises microscópicas ao sangue que confirmem a presença do parasita ou através de testes de diagnóstico rápido que detectam a presença de antigénios no sangue.[1] Existem também técnicas de diagnóstico que usam a reação em cadeia da polimerase para detectar o ADN do parasita, embora o seu uso nas regiões onde a doença é endémica seja pouco comum devido ao seu elevado custo e complexidade.[5]
A transmissão da doença pode ser combatida através da prevenção das picadas de mosquito. As medidas de prevenção mais comuns são o uso de redes mosquiteiras ou repelente de insetos e medidas de erradicação, como o uso de inseticidas ou o escoamento de águas estagnadas.[1] Estão disponíveis diversos medicamentos para prevenção da malária em viajantes que se desloquem a países onde a doença seja endémica.[2] Em regiões de elevada incidência, está recomendada a administração de sulfadoxina/pirimetamina nas crianças mais novas e em grávidas após o primeiro trimestre.[2] Não existe vacina eficaz contra a malária, apesar de haver esforços no sentido de desenvolver uma.[2] O tratamento recomendado para a malária é uma artemisinina associada a um segundo antimalárico.[1][2] Os antimaláricos são geralmente mefloquina, lumefantrina ou sulfadoxina/pirimetamina.[6] Quando não está disponível artemisinina pode ser usada quinina com doxiciclina.[6] Em áreas onde a doença é comum, recomenda-se que se confirme a presença da doença antes de iniciar o tratamento devido à preocupação com a crescente resistência farmacológica.[2] Vários parasitas desenvolveram resistência a uma série de antimaláricos, como é o caso do P. falciparum resistente o quinino e a resistência a artemisinina em várias partes do Sudeste Asiático.[2]
A malária é endémica em regiões tropicais e subtropicais devido à chuva abundante, temperatura quente e grande quantidade de água estagnada, o que proporciona habitats ideais para as larvas do mosquito. A doença encontra-se disseminada pelas regiões tropicais e subtropicais do planeta ao longo de uma larga faixa em redor do equador,[1] que inclui grande parte da África subsariana, Ásia e América Latina.[2] Em 2016, ocorreram em todo o mundo 216 milhões de casos de malária, que se estima terem sido a causa de 731 000 mortes.[3][4] Cerca de 90% dos casos e das mortes ocorreram em África.[7] Entre 2000 e 2015 a incidência da doença diminuiu 37%.[7][8] A malária está geralmente associada à pobreza e tem um grande impacto negativo no desenvolvimento económico.[9][10] Em África, estima-se que a doença resulte em perdas de 12 mil milhões de dólares por ano devido aos custos com a prestação de cuidados de saúde, baixas de trabalho e impacto no turismo.[11]
Sinais e sintomas editar
Os sinais e sintomas da malária manifestam-se geralmente entre 8 a 25 dias após a infecção.[12] No entanto, os sintomas podem-se manifestar mais tarde em indivíduos que tenham tomado medicação antimalárica de prevenção.[5] As manifestações iniciais da doença, iguais em todas as espécies de malária, são semelhantes aos sintomas da gripe,[13] podendo ainda ser semelhantes aos de outras doenças virais e condições clínicas como a sepse ou gastroenterite.[5] Entre os sinais incluem-se dores de cabeça, febre, calafrios, dores nas articulações, vómitos, anemia hemolítica, icterícia, hemoglobina na urina, lesões na retina e convulsões.[14]
O sintoma clássico da malária são ataques paroxísticos, a ocorrência cíclica de uma sensação súbita de frio intenso seguida por calafrios e posteriormente por febre e sudação. Estes sintomas ocorrem a cada dois dias em infecções por P. vivax e P. ovale e a cada três dias em infecções por P. malariae. A infecção por P. falciparum pode provocar febre recorrente a cada 36-48 horas ou febre menos aguda, mas contínua.[15]
Os casos mais graves de malária são geralmente provocados por P. falciparum, variante que é muitas vezes denominada "malária falciparum". Os sintomas desta variante manifestam-se entre 9 a 30 dias após a infecção.[13] Os indivíduos com ‘’’malária cerebral’’’ apresentam muitas vezes sintomas neurológicos, entre os quais postura anormal, nistagmo, paralisia do olhar conjugado (incapacidade de mover em conjunto os olhos na mesma direção), opistótono, convulsões ou coma.[13]
Complicações editar
Existem diversas complicações graves de malária. Entre elas está o desenvolvimento de ’’stress’’ respiratório, no qual se verifica a necessidade de um esforço cada vez maior para respirar associado a sensação de desconforto psicológico, o qual ocorre em 25% dos adultos e 40% das crianças com malária falciparum aguda. Entre as possíveis causas estão a compensação respiratória da acidose metabólica, edema pulmonar não cardiogénico, pneumonia concomitante e anemia grave. Embora a sua ocorrência seja rara em crianças, entre 5% e 25% dos adultos e 29% das grávidas com casos graves de malária desenvolvem Síndrome do desconforto respiratório do adulto.[16] A co-infecção de malária com VIH aumenta a mortalidade.[17] Pode ainda ocorrer febre da água negra, uma complicação na qual a hemoglobina de glóbulos vermelhos danificados se deposita na urina.[13]
A infecção com P. falciparum pode provocar malária cerebral, uma forma grave de malária que envolve encefalopatia. Manifesta-se através do branqueamento da retina, o que pode constituir um sinal clínico auxiliar para distinguir a malária de outras causas de febre.[18] Pode também ocorrer esplenomegalia, dor de cabeça intensa, hepatomegalia, hipoglicemia ou hemoglobinúria com insuficiência renal.[13] Em casos de malária durante a gravidez, entre as complicações graves estão a morte do feto ou da criança, ou peso à nascença inferior a 2,5 kg,[19] em particular na infecção por P. falciparum, mas também por P. vivax.[20]
Causas editar
Os parasitas da malária pertencem ao género Plasmodium (filo Apicomplexa). No ser humano, a malária é provocada por P. falciparum, P. malariae, P. ovale, P. vivax e P. knowlesi.[21][22] Entre a população infectada, a espécie com maior prevalência é a P. falciparum (~75%), seguida pela P. vivax (~20%).[5] Embora a P. falciparum seja a responsável pela maioria das mortes,[23] existem dados recentes que sugerem que a malária por P. vivax está associada a condições que colocam a vida em risco em igual número com a infecção por P. falciparum.[24] A P. vivax é, em proporção, mais comum fora de África.[25] Estão também documentadas várias infecções humanas com diversas espécies de Plasmodium de origem símia; no entanto, com a exceção da P. knowlesi – uma espécie zoonótica que provoca malária nos macacos[22] – a relevância para a saúde pública destas infecções é apenas residual.[26]
Ciclo de vida do parasita editar
No ciclo de vida do Plasmodium, a fêmea do mosquito Anopheles (o hospedeiro definitivo) transmite a um vertebrado (o hospedeiro secundário, como o ser humano) uma forma infecciosa móvel (denominada esporozoíto), atuando desta forma como vetor. O esporozoíto percorre os vasos sanguíneos até às células hepáticas, nas quais se reproduz assexualmente (através de esquizogonia tecidual), produzindo milhares de merozoítos. Estes últimos irão infectar mais glóbulos vermelhos e dar início a uma série de ciclos de multiplicação assexuada que produzem entre 8 a 24 novos merozoítos infecciosos cada um, até à célula romper e dar início a um novo ciclo de infecção.[27]
Os restantes merozoítos tornam-se gametócitos imaturos, os quais são os precursores dos gâmetas masculinos e femininos. Quando um mosquito pica uma pessoa infectada, os gametócitos são transportados no sangue e amadurecem no sistema digestivo do mosquito. Os gametócitos macho e fêmea fundem-se e formam um oocineto – um zigoto fertilizado móvel. Por sua vez, os oocinetos transformam-se em novos esporozoítos que migram para as glândulas salivares do insecto, prontos a infectar novos vertebrados. Quando o mosquito se alimenta através da picada, os esporozoítos são injectados para a pele através da sua saliva.[28]
Só a fêmea do mosquito é que se alimenta de sangue; os machos alimentam-se do néctar de plantas, pelo que não transmitem a doença. As fêmeas do género Anopheles preferem alimentar-se ao longo da noite, iniciando a procura de uma refeição com o pôr do sol.[29] Os parasitas da malária podem também ser transmitidos através de transfusões de sangue, embora a sua ocorrência seja rara.[30]
Malária recorrente editar
Os sintomas da malária podem ocorrer novamente após períodos sem qualquer sintoma. Dependendo da causa, a recorrência pode ser classificada em recrudescência, recidiva ou reinfecção. A recrudescência verifica-se quando se manifestam novamente sintomas após um período sem qualquer sintoma. É provocada por parasitas no sangue que sobreviveram a um tratamento inadequado ou ineficaz.[31] As recidivas ocorrem quando reaparecem sintomas mesmo após os parasitas terem sido eliminados do sangue, devido à persistência de populações de hipnozoítos adormecidos nas células do fígado. As recidivas ocorrem frequentemente entre 8 a 24 semanas e são mais frequentes nas infecções por P. vivax e P. ovale.[5] Nos casos de malária por P. vivax em regiões de clima temperado, é comum que os hipnozoítos adormeçam durante o inverno, iniciando-se as recidivas no ano seguinte à picada do mosquito.[32] A reinfecção verifica-se quando o parasita que provocou a infecção anterior foi completamente eliminado do corpo, mas foi introduzido um novo parasita. É difícil distinguir a reinfecção da recrudescência, embora a ocorrência de uma nova infecção no prazo de duas semanas após o tratamento da infecção inicial seja normalmente atribuída ao insucesso desse tratamento.[33]
Fisiopatologia editar
A infecção de malária desenvolve-se em duas fases: uma que envolve o fígado (fase exoeritrocítica) e outra que envolve os glóbulos vermelhos, ou eritrócitos (fase eritrocítica). Quando um mosquito infectado perfura a pele de uma pessoa para se alimentar de sangue, os esporozoítos presentes na saliva do mosquito penetram na corrente sanguínea e depositam-se no fígado, onde infectam os hepatócitos, reproduzindo-se assexualmente e sem haver manifestação de sintomas ao longo de 8-30 dias.[34]
Depois de um período de dormência no fígado, estes organismos diferenciam-se para produzir milhares de merozoítos, os quais, após romperem as células hospedeiras, se introduzem na corrente sanguínea e infectam os glóbulos vermelhos, dando início à fase eritrocítica do ciclo de vida.[34] O parasita é capaz de abandonar o fígado sem ser detectado, ao se envolver com a membrana celular da célula hepática do hospedeiro.[35] No interior dos glóbulos vermelhos, os parasitas reproduzem-se novamente, também de forma assexuada, rompendo periodicamente as células hospedeiras para infectar novos glóbulos vermelhos.[34]
Alguns esporozoítos P. vivax não se desenvolvem imediatamente em merozoítos, produzindo em vez disso hipnozoítos que permanecem adormecidos por intervalos de tempo que variam entre alguns meses, geralmente 7 a 10 meses, e vários anos. Após o período de hibernação, os hipnozoítos são reativados e produzem merozoítos. Os hipnozoítos são responsáveis pelos longos períodos de incubação e recidivas tardias em infecções por P. vivax,[32] embora se desconheça ainda a sua existência em casos de P. ovale.[36]
O parasita encontra-se relativamente protegido de ataques do sistema imunitário do corpo, uma vez que durante a maior parte do seu ciclo de vida humano se encontra no interior das células do fígado e dos glóbulos vermelhos, sendo por isso relativamente invisível à vigilância imunitária. No entanto, os glóbulos vermelhos infectados em circulação são destruídos no baço. Para evitar a sua destruição, o parasita P. falciparum introduz proteínas adesivas na superfície dos glóbulos vermelhos infectados, o que faz com que os glóbulos se agarrem às paredes dos vasos sanguíneos mais pequenos e não tenham que percorrer o sistema circulatório e passar pelo baço.[37] O bloqueio dos vasos pode provocar malária placentária.[38] Os glóbulos vermelhos sequestrados podem penetrar na barreira hematoencefálica e provocar malária cerebral.[39]
Resistência genética editar
De acordo com uma revisão de 2005, os elevados níveis de letalidade e morbidade provocados pela malária, especialmente pela espécie P. falciparum, são responsáveis pela maior pressão seletiva sobre o genoma humano da história recente. Algumas características genéticas proporcionam alguma resistência à malária, entre os quais a anemia falciforme, talassemia, deficiência em glucose-6-fosfato desidrogenase e a ausência do antígeno de Duffy nos glóbulos vermelhos.[40][41]
A anemia falciforme provoca um defeito nas moléculas de hemoglobina do sangue. As moléculas de hemoglobina S fazem com que os glóbulos vermelhos assumam uma forma curva semelhante a uma foice (falciforme), em vez da forma bicôncava normal. Devido a esta deformação, a molécula perde alguma da sua eficácia na absorção e libertação de oxigénio. A infeção faz com que os glóbulos vermelhos se curvem ainda mais, sendo por isso removidos de circulação mais cedo, o que por sua vez reduz a frequência com que os parasitas completam o seu ciclo de vida na célula. Os indivíduos homozigóticos (com duas cópias do alelo anormal) desenvolvem anemia falciforme, enquanto que os heterozigóticos (com um alelo anormal e outro normal) apresentam resistência à malária.[41][42]
Insuficiência hepática editar
É pouco comum a ocorrência de insuficiência hepática provocada por malária, sendo geralmente o resultado da coexistência com outras condições que afectam o fígado, como a hepatite viral ou qualquer doença crónica do fígado. A síndrome é por vezes denominada “hepatite malárica”. Embora a sua ocorrência seja ainda considerada rara, a hepatopatia malárica tem vindo a aumentar, sobretudo na Índia e no Sudeste Asiático. A presença de doenças hepáticas em pacientes de malária aumenta a probabilidade de complicações ou morte.[43]
Diagnóstico editar
Devido à natureza não específica dos sintomas, o diagnóstico de malária em regiões onde não seja endémica exige confirmação redobrada e deve levar em conta factores de diagnóstico auxiliares, como o histórico recente de viagens, aumento de volume do baço, febre, número reduzido de plaquetas no sangue e quantidade de bilirrubina no sangue superior ao normal com quantidade normal de glóbulos brancos.[5]
A malária é geralmente confirmada através de exame microscópico de esfregaços ou através de testes de diagnóstico rápido (DRT) baseados na deteção de antígenos.[44][45] A microscopia é o método mais comum na deteção do parasita.[46] No entanto, apesar do seu uso generalizado, o diagnóstico por microscopia tem duas desvantagens: muitos locais, sobretudo em meios rurais, não têm equipamento para a realização do exame e a precisão dos resultados depende da destreza do examinador e da quantidade de parasitas no sangue. A sensibilidade dos esfregaços varia entre 75–90% em condições normais, podendo diminuir até 50%. Os testes de diagnóstico rápido disponíveis são mais precisos a determinar a presença de parasitas da malária do que a análise microscópica, embora a sua sensibilidade e especificidade dependam do fabricante e não sejam capazes de determinar o número de parasitas.[46]
Em regiões onde estejam disponíveis análises de laboratório, deve-se suspeitar a presença de malária em qualquer paciente que manifeste sintomas e que tenha estado numa região onde a malária seja endémica. Em regiões onde não há capacidade de disponibilizar facilmente análise laboratorial, tem vindo a tornar-se rotina usar apenas o histórico de febre subjetiva como indicador de tratamento para malária – um diagnóstico presuntivo que assume que febre corresponde a malária, a não ser que haja prova em contrário. Uma desvantagem desta prática é o sobrediagnóstico de malária e a gestão inadequada de casos de febre sem relação com a malária, o que desperdiça recursos, diminui a confiança no sistema de saúde e aumenta a resistência a fármacos.[47] Embora tenham já sido desenvolvidos testes que têm por base a reação em cadeia da polimerase, não estão ainda difundidos pelas regiões onde a malária é endémica devido à sua complexidade.[5]
Classificação editar
A Organização Mundial de Saúde (OMS) classifica a malária em “grave” ou “não complicada”.[5] Classifica-se como grave quando está presente ‘’qualquer um’’ dos seguintes critérios; caso contrário, é considerada não complicada.[48]
- Alteração do estado de consciência ou coma
- Fraqueza significativa, de tal forma que a pessoa não é capaz de caminhar
- Incapacidade de se alimentar
- Mais de dois episódios de convulsões em menos de 24 horas
- Choque circulatório e Pressão arterial baixa (inferior a 70 mmHg em adultos e 50 mmHg em crianças)
- Respiração profunda (respiração acidótica)
- Icterícia
- Insuficiência renal ou hemoglobina na urina (creatinina sérica > 265 mmol/L ou > 3 mg/dL)
- Hemorragia espontânea, ou hemoglobina inferior a 50 g/L (5 g/dL)
- Edema pulmonar
- Hipoglicemia (glicose inferior a 2,2 mmol/L ou 40 mg/dL)
- Acidose metabólica (bicarbonato plasmático <15 mmol/L)
- Anemia normocítica grave (Hb < 5 g/dL, hematrócrito <15%)
- Hiperlactacidémia (lactato >5 mmol/L)
- Contagem de parasitas no sangue superior a 100 000 por microlitro (µL) em áreas de transmissão de pouca intensidade, ou 250 000 por µL em áreas de transmissão de elevada intensidade
Define-se por malária cerebral a malária P. falciparum grave que apresente sintomas neurológicos, entre os quais coma (inferior a 11 na escala de coma de Glasgow ou superior a 3 na escala de Blantyre), ou coma com duração superior a 30 minutos após uma convulsão.[49]
Prevenção editar
Entre os métodos de prevenção da malária estão a erradicação dos mosquitos, a prevenção de picadas e medicação. A presença de malária numa dada região pressupõe a conjugação de vários factores: elevada densidade populacional humana, elevada densidade populacional de mosquitos ‘’anopheles’’ e elevada taxa de transmissão entre humanos e mosquito e vice-versa. Quando algum destes factores é reduzido de forma significativa, o parasita irá eventualmente desaparecer dessa região, tal como aconteceu na América do Norte, Europa e partes do Médio Oriente. No entanto, a não ser que o parasita seja erradicado à escala global, pode-se voltar a implantar em qualquer uma dessas regiões caso ocorra uma conjugação de factores que proporcione a sua reprodução. Além disso, o custo económico da erradicação do mosquito por pessoa é maior em áreas com menor densidade populacional, o que faz com que seja economicamente inviável em algumas regiões.[50]
Muitos investigadores defendem que, a longo prazo, a prevenção da malária é capaz de representar uma maior relação custo-benefício do que o tratamento da doença. No entanto, as regiões mais pobres e afetadas não dispõem de capital financeiro. Há diferenças significativas entre os custos de controlo (isto é, manter a endemicidade baixa) e os programas de erradicação entre os vários países. Por exemplo, na China, cujo governo anunciou em 2010 um programa estratégico para a eliminação da malária nas províncias, o investimento necessário representa apenas uma pequena parcela dos gastos em saúde. Em contrapartida, um programa semelhante na Tanzânia custaria um quinto do total do orçamento de saúde.[51]
Controlo do mosquito editar
Os métodos usados para reduzir a malária através da diminuição do número de transmissões são denominados controlo de vetores. Em termos de proteção individual, os repelentes de insetos à base de DEET ou Icaridina são os mais eficazes.[52] A vaporização residual de interiores com inseticida e o uso de redes mosquiteiras, às quais é aplicado também inseticida, são outras técnicas de erradicação que têm demonstrado ser altamente eficazes na prevenção de malária em regiões endémicas.[53][54]
Vaporização residual designa uma técnica que consiste na vaporização de inseticida nas paredes interiores de casas em regiões afetadas pela malária. Depois de se alimentarem, muitas espécies de mosquito descansam numa superfície próxima enquanto digerem o sangue. Se as paredes da habitação tiverem sido revestidas com inseticida, é provável que o mosquito morra antes de picar outra pessoa e transferir o parasita da malária.[55] À data de 2006, a Organização Mundial de Saúde recomenda o uso de doze inseticidas para ações de vaporização residual, entre os quais DDT e os piretoides ciflutrina e deltametrina.[56] O uso de pequenas quantidades de DDT para ações de saúde pública é autorizado pela Convenção de Estocolmo para os poluentes orgânicos persistentes, a qual proíbe o seu uso na agricultura.[57] Um dos problemas da vaporização residual é a resistência ao pesticida. Os mosquitos afetados pela vaporização geralmente vivem e descansam no interior das habitações e, devido à irritação provocada pela vaporização, os seus descendentes tendem a viver no exterior, o que significa que serão menos afetados pela técnicas de vaporização residual.[58]
As redes mosquiteiras ajudam a manter os mosquitos afastados de pessoas e reduzem as taxas de infeção e transmissão de malária. No entanto, as redes não constituem uma barreira perfeita e são muitas vezes tratadas com um inseticida próprio para matar o mosquito antes que seja capaz de encontrar uma forma de passar a rede. Estima-se que as redes tratadas com inseticida sejam duas vezes mais eficazes que redes não tratadas e que ofereçam mais 70% de proteção quando comparada com os dados na ausência de qualquer rede.[59] Entre 2000 e 2008, o uso de redes tratadas com inseticida salvou a vida a mais de 250 000 crianças na África Subsariana.[60] Embora as redes com inseticida possam prevenir a malária, só estão presentes em cerca de 13% dos lares nos países subsarianos.[61] O método de uso recomendado é a suspensão de uma rede de grande dimensão por cima do centro da cama, de modo a envolvê-la por completo, e amarrar as pontas. As redes tratadas com piretroides e inseticidas de longa duração proporcionam a proteção pessoal mais eficaz, sobretudo quando usadas desde o anoitecer ao amanhecer.[62] Usando uma ferramenta de edição de gene conhecido como CRISPR/Cas9, em 2015, pesquisadores fizeram uma "vacina genética" que continuamente injetar-se no DNA de mosquitos. Uma vacina deste tipo, conhecida como uma unidade de gene, pode difundir para quase todos os mosquitos numa população em algumas gerações.[63] Um método para prevenir a transmissão da malária que consiste em limitar o acesso de mosquitos a casas, bloqueando aberturas e instalação de tubos "eave" que contêm um tipo único de ataque com mosquiteiro com inseticida que mata os insetos quando eles tentam entrar, recebeu $10,2 milhões de dólares da da Fundação Bill & Melinda Gates em 2015.[64]
Existem outros métodos destinados a reduzir o número de picadas de mosquito e abrandar a disseminação da malária. Uma vez que a larva do mosquito se desenvolve em águas estagnadas, drenar essa água ou acrescentar-lhe substâncias que diminuem o seu desenvolvimento é uma técnica eficaz nalgumas regiões.[65] No entanto, não há qualquer evidência que os aparelhos eletrónicos repelentes de insetos através de ultrassons sejam minimamente eficazes.[66]
Medicação editar
Existem diversos fármacos disponíveis para a prevenção de malária em viajantes que se desloquem para regiões onde a malária é endémica. Muitos destes fármacos são também usados no tratamento da doença. Nos casos em que o parasita ainda seja sensível, pode ser usada cloroquina.[67] No entanto, a maior parte dos Plasmodium é resistente a um ou mais fármacos, pelo que geralmente é necessário recorrer a outros fármacos ou a combinações entre fármacos. Entre estes estão a mefloquina, doxiciclina (disponível em genéricos) ou a combinação de atovaquona e proguanil.[67] A combinação entre doxiciclina e a combinação atovaquona-proguanil é a que é melhor tolerada pelo organismo. A mefloquina está associada a episódios de suicídio, morte e sintomas psiquiátricos.[67]
O efeito protetor não começa imediatamente após a primeira toma, pelo que os viajantes devem começar a tomar os medicamentos entre uma e duas semanas antes da chegada e continuar a tomá-los ao longo de duas semanas após terem deixado a região (à exceção da combinação atovaquona-proguanl, que só necessita de ser iniciada dois dias antes e prolongada por mais sete dias após).[68] O uso de fármacos preventivos não é prático para os residentes em regiões onde existe malária, pelo que o seu uso se restringe a viajantes e turistas de curta estadia. Isto deve-se ao preço dos medicamentos, aos efeitos secundários provocados pelo uso prolongado e à dificuldade em obter antimaláricos fora dos países desenvolvidos.[69] O uso de fármacos preventivos nas regiões onde haja mosquitos podem contribuir para o desenvolvimento de resistência parcial.[70]
Outros métodos editar
Entre as comunidades dos países em vias de desenvolvimento, as campanhas de saúde que promovem a consciencialização para o problema da malária e a importância de medidas de controlo têm-se revelado eficazes para a redução da incidência da doença.[71] Identificar os estágios iniciais de malária pode impedir que a doença se torne fatal. As campanhas alertam também as pessoas no sentido de cobrirem áreas de água estagnada, como tanques ou depósitos, os quais são o meio ideal para a reprodução do mosquito e do parasita.[72] Outra intervenção que tem demonstrado ser eficaz no controlo da malária em grávidas e crianças é a Terapia Preventiva Intermitente, na qual é fornecida medicação antimalárica a estes grupos de risco.[73][74]
Tratamento editar
A malária é tratada com medicação antimalárica. A escolha do fármaco depende do tipo e gravidade da doença. Apesar de geralmente serem também usados medicamentos para baixar a febre, a sua influência no tratamento não é ainda conclusiva.[75]
A malária não complicada pode ser tratada com medicação oral. O tratamento mais eficaz para a infeção por P. falciparum é o uso de artemisinina combinada com outros antimaláricos, denominada Terapia Combinada de Artemisinina ou ACT. A combinação de fármacos diminui as hipóteses de se verificar resistência do parasita a qualquer um dos componentes individuais.[76] Entre os outros antimaláricos com que a artemisinina é combinada estão a amodiaquina, lumefantrina, mefloquina ou sulfadoxina/pirimetamina.[77] Outra combinação recomendada é a associação dihidroartemisinina-piperaquina.[78][79] A ACT é eficaz em 90% dos casos de tratamento de malária sem a presença complicações.[60] Para o tratamento de malária na gravidez, a OMS recomenda o uso de quinino e clindamicina no primeiro trimestre e ACT nos restantes trimestres.[80] Na década de 2000, surgiu no Sudeste Asiático malária parcialmente resistente a artemisinas.[81][82] A infeção por ’P. vivax, P. ovale or P. malariae é geralmente tratada sem necessidade de internamento hospitalar. O tratamento de ’P. vivax requer não só o tratamento das fases sanguíneas (com cloroquina ou ACT), como também da eliminação das formas hepáticas com primaquina.[83]
O tratamento recomendado para a malária grave é a administração intravenosa de fármacos antimaláricos. Em casos graves, o artesunato é superior ao quinino, tanto em crianças como em adultos.[84] O tratamento de malária grave envolve medidas de apoio que são melhor realizadas numa unidade de cuidados intensivos, onde se possa gerir a febre elevada e as convulsões que dela derivam. As unidades hospitalares também permitem monitorizar o esforço respiratório, a descida da quantidade de açúcar no sangue e a descida da quantidade de potássio.[23]
Prognóstico editar
| sem dados <10 0–100 100–500 500–1000 1000–1500 1500–2000 | 2000–2500 2500–2750 2750–3000 3000–3250 3250–3500 ≥3500 |
Quando tratada de forma adequada, uma pessoa com malária pode contar com recuperação total.[85] No entanto, a malária grave pode progredir muito rapidamente e provocar a morte num prazo de horas ou dias.[86] Nos casos mais graves da doença, a taxa de letalidade pode atingir os 20%, mesmo com cuidados intensivos.[5] Têm sido documentados casos de atraso no desenvolvimento a longo prazo de crianças que vivenciaram episódios de malária grave.[87]
Durante a infância, a malária pode provocar anemia ou, no caso de malária cerebral, lesões cerebrais.[87] Alguns dos sobreviventes de malária cerebral apresentam um risco acrescido de défice neurológico e cognitivo e manifestam transtornos emocionais e epilepsia.[88] Quando comparada com grupos placebo em ensaios clínicos, a profilaxia de malária demonstrou melhorar a função cognitiva e o desempenho escolar.[87]
Epidemiologia editar
A Organização Mundial de Saúde estima que em 2010 tenham ocorrido 219 milhões de casos de malária que provocaram a morte a 600 000 pessoas.[5][89] Outras fontes estimaram o número de casos entre 350 e 550 milhões para a malária falciparum[90] e 1,24 milhões de mortes em 2010,[91] uma subida em relação ao milhão de mortes estimado em 1990.[92] A maioria dos casos (65%) ocorre em crianças com idade inferior a 15 anos.[91] Cerca de 125 milhões de grávidas estão em risco de ser infetadas a cada ano. Na África subsariana, estima-se que a malária materna esteja associada à morte de 200 000 crianças anualmente.[19] Tanto a incidência global como a mortalidade que daí resulta têm vindo a diminuir nos últimos anos. De acordo com a OMS, as mortes atribuídas à malária em 2010 correspondem a uma diminuição de cerca de um terço, quando comparadas com a estimativa de 985 000 para o ano 2000, devido em grande parte à disseminação do uso de redes mosquiteiras tratadas com inseticida e da terapia combinada de artemisinina.[60]
♦ Ocorrência de malária resistente à cloroquina
♦ Sem ocorrência de ‘’Plasmodium falciparum ou resistência à cloroquina
♦ Sem malária
A malária é atualmente endémica nas regiões equatoriais, em regiões da América, algumas partes da Ásia e grande parte de África. Entre 85 e 90% das mortes por malária ocorrem na África subsariana.[94] Em 2009, uma estimativa indicou que os países com a maior taxa de mortalidade por cada 100 000 habitantes foram a Costa do Marfim (86,15), Angola (56,93) e o Burkina Faso (50,66).[95] Em 2010, uma outra estimativa indicou que os países com maior taxa de mortalidade foram o Burkina Faso, Moçambique e o Mali.[91] Ainda em 2010, cerca de 100 países possuíam malária endémica.[89][96] Estes países são visitados anualmente por mais de 125 milhões de viajantes internacionais, dos quais mais de 30 000 contraem a doença.[52]
Na Europa e na América do Norte, a doença está praticamente erradicada. Entre 1993 e 2003, a malária provocou a morte a 900 pessoas na Europa.[52] Em 2011 houve apenas 102 casos adquiridos in loco, restritos a cinco países.[97] Em Portugal, os últimos casos de Malária adquirida no país foram diagnosticados em 1959, e desde então a totalidade das ocorrências são casos importados por pessoas que visitaram países tropicais. Em 2011 foram notificados 58 casos importados de Malária.[98]
No Brasil, 97% dos casos ocorrem na região amazónica e pouco menos de 2,9% nas regiões próximas, sendo mais de 80% nas regiões rurais.[99] Em Moçambique, a malária é a principal causa de morte infantil. No entanto, entre 2006 e 2012 o número de casos de malária tem vindo a diminuir significativamente. Em 2006 registaram-se 6,5 milhões de casos, os quais provocaram 5 053 mortes,[100] enquanto que em 2012 se registaram apenas 3,1 milhões de casos e 1 653 mortes.[101] Em Angola, o número de casos também tem vindo a diminuir. Entre 2006 e 2010, registaram-se em média quatro milhões de casos por ano, enquanto que em 2011 se registou pela primeira vez um número inferior a três milhões.[102]
A distribuição geográfica da malária nas regiões de grande dimensão é complexa. Há muitos casos de regiões endémicas e regiões livres de malária que estão muito próximas entre si.[103] A malária é prevalente em regiões tropicais e subtropicais devido à chuva intensa, temperatura elevada constante e humidade elevada, factores que proporcionam água estagnada em abundância propícia à reprodução contínua de larvas de mosquito.[104] Em regiões mais secas, é possível prever com alguma precisão os surtos de malária através da previsão meteorológica da ocorrência de chuva.[105] A malária é mais frequente nas áreas rurais do que em área urbanas. Por exemplo, há várias cidades na bacia do rio Mekong que são livres de malária mas a doença é prevalente em muitas das regiões rurais.[106] Por outro lado, em África a malária está presente tanto em áreas rurais como urbanas, embora o risco seja menor nas maiores cidades.[107] É provável que as alterações climáticas venham a criar novos habitats para o mosquito vetor de malária em regiões mais frias e de maior altitude, provocando alterações na sua distribuição geográfica e o aumento de surtos epidémicos.[108]
História editar
Embora o parasita responsável pela malária falciparum exista há 50 000-100 000 anos, só há cerca de 10 000 anos é que a sua população aumentou, impulsionada pelo desenvolvimento da agricultura e o surgimento das primeiras cidades.[109] A presença de parentes dos parasitas da malária humana em chimpanzés continua a ser comum. Algumas evidências sugerem que a malária falciparum possa ter origem em gorilas.[110]
Desde 2700 a.C., na antiguidade chinesa, que são encontradas ao longo de toda a História escrita referências à febre periódica característica da malária.[111] A malária pode ter contribuído para o declínio do Império Romano,[112] onde era uma doença tão comum que chegou a ser conhecida como "febre romana".[113] Várias regiões do império eram consideradas de risco devido à presença de condições favoráveis aos vetores de malária, como o sul de Itália, a ilha de Sardenha, as lagoas Pontinas, as regiões baixas da costa da Etrúria e a cidade de Roma ao longo do rio Tibre. A presença de água estagnada nas terras alagadas e derivada da agricultura proporcionava aos mosquitos condições ideais de reprodução.[114]
O termo malária tem origem no italiano medieval mala aria, ou "maus ares"; a doença era anteriormente denominada "ague" ou "febre dos pântanos" devido à sua associação com os terrenos alagados.[115] A malária era comum em grande parte da Europa e da América do Norte,[116] onde já não é endémica,[117] embora continuem a ser registados casos importados.[118]
O primeiro progresso significativo na investigação científica da malária deu-se em 1880, data em que Charles Louis Alphonse Laveran, um médico francês que trabalhava no hospital militar de Constantina na Argélia, observou pela primeira vez os parasitas no interior dos glóbulos vermelhos de pessoas infectadas. Laveran propôs que este organismo seria a causa da malária, sendo também a primeira vez que um protista foi identificado como causa de uma doença.[119] Por esta e por descobertas posteriores, em 1907 foi agraciado com o Nobel de Medicina. Um ano mais tarde, Carlos Finlay, um médico cubano que tratava pacientes de febre amarela em Havana, apresentou evidências sólidas que os mosquitos eram os transmissores da doença.[120] Esta descoberta confirmou sugestões anteriores de Josiah C. Nott,[121] e Patrick Manson, considerado o pai da medicina tropical, sobre a transmissão da filaríase.[122]
Em abril de 1894, Patrick Manson e o médico escocês Ronald Ross iniciam uma colaboração ao longo de quatro anos, a qual culminaria em 1898 no momento em que Ross, que trabalhava no hospital geral de Calcutá, demonstra o ciclo de vida completo do parasita da malária nos mosquitos, provando que o mosquito é o vector da malária em humanos ao mostrar que determinadas espécies de mosquitos transmitem malária às aves. Ross isolou parasitas de malária a partir das glândulas salivares dos mosquitos que se tinham alimentado de aves infectadas.[123] Em 1902, Ross foi agraciado com o Nobel de Medicina. Depois de se demitir do Serviço de Medicina indiano, Ross foi admitido na nova Escola de Medicina Tropical em Liverpool, onde administrou campanhas de controlo da malária no Egito, Panamá, Grécia e Maurícia.[124] As descobertas de Finlay e Ross foram confirmadas em 1900 por uma comissão médica presidida por Walter Reed, cujas recomendações foram implementadas durante a construção do canal do Panamá. Esta estratégia pioneira salvou a vida a milhares de trabalhadores e ajudou a definir os métodos usados em futuras campanhas de saúde pública contra a doença.[125]
O primeiro tratamento eficaz para a malária surge a partir da casca do arbusto cinchona, a qual contém quinino. Este arbusto cresce nas encostas dos Andes, sobretudo no Peru. Os índios peruanos faziam uma tintura de cinchona para o tratamento da febre. Descobriu-se que era eficaz contra a malária e, por volta de 1640, foi introduzida pelos Jesuítas na Europa. Em 1677 estava já inscrita na farmacopeia de Londres enquanto tratamento antimalárico.[126] No entanto, foi apenas em 1820 que o princípio ativo, o quinino, foi extraído da casca, isolado e batizado pelos químicos franceses Pierre Joseph Pelletier e Joseph Bienaimé Caventou.[127][128]
O quinino tornou-se o principal medicamento antimalárico até à década de 1920, quando se começaram a desenvolver novos fármacos. Na década de 1940, o quinio é substituído pela cloroquina enquanto tratamento de eleição caso não se verifique resistência, tanto para a malária não complicada como para a malária grave. A cloroquina começou a ser usada no Sudeste Asiático e na América do Sul na década de 1950, e em todo o mundo na década de 1980.[129] A artemisinina, descoberta a partir da planta Artemisia annua pela equipa da cientista chinesa Tu Youyou na década de 1970, tornou-se o tratamento recomendado para a malária falciparum, administrado em associação com outros fármacos.[130]
O Plasmodium vivax foi usado entre 1917 e a década de 40 na malarioterapia – a injeção propositada de parasitas da malária de modo a induzir febre para combater determinadas doenças como a sífilis. Em 1917, o inventor desta técnica, Julius Wagner von Jauregg, recebeu o Nobel de Medicina. No entanto, a técnica era perigosa, matando cerca de 15% dos pacientes, pelo que deixou de ser usada.[131]
O primeiro pesticida usado para a vaporização residual interior foi o DDT.[132] Embora inicialmente fosse usado em exclusivo para combater a malária, rapidamente começou a ser usado também na agricultura. Com o decorrer do tempo, o produto passou a ser usado principalmente para o controlo de pragas em larga escala, o que provocou a resistência dos mosquitos ao pesticida em inúmeras regiões. Durante a década de 1960, aumentou a consciencialização pública do impacto negativo do seu uso indiscriminado, o que levaria na década seguinte à interdição do DDT na agricultura em vários países.[57] Antes do DDT, nas áreas tropicais como o Brasil ou o Egito, a malária era eliminada ou controlada através da remoção ou envenenamento dos habitats de reprodução do mosquito ou dos habitats aquíferos das larvas ao aplicar, por exemplo, o composto altamente tóxico Verde de Paris em águas estagnadas.[133]
A investigação procura ainda uma vacina contra a malária. Os primeiros estudos promissores que demonstraram o potencial para a possibilidade de uma vacina foram realizados em 1967, através da inoculação de ratos com esporozoítos vivos atenuados por radiação, os quais ofereceram proteção significativa perante injeções posteriores com esporozoítos normais. Desde a década de 1970 que tem havido esforços consideráveis no sentido de desenvolver uma estratégia de vacinação semelhante em seres humanos.[134]
Sociedade e cultura editar
Impacto económico editar
A malária não é apenas uma doença associada à pobreza; algumas conclusões sugerem que a própria doença seja uma das causas de pobreza e um entrave significativo ao desenvolvimento económico.[9][10] Embora as regiões mais afetadas sejam as tropicais, a malária atinge também regiões temperadas com alterações sazonais profundas. A doença tem vindo a ser associada a efeitos nefastos muito significativos na economia das regiões onde está disseminada.[135] Em 1995, a comparação do PIB per capita, corrigido pela paridade do poder de compra, entre países com malária e países sem malária indicou uma diferença na proporção de um para cinco (1 526 $ e 8 268 $, respetivamente). No período entre 1965 e 1990, nos países onde a malária era endémica o crescimento económico do PIB ‘’per capita’’ foi, em média, de apenas 0,4% ao ano, em contraste com os 2,4% dos restantes países.[136]
A pobreza pode aumentar o risco de malária, uma vez que aqueles que vivem na pobreza não têm recursos financeiros para prevenir ou tratar a doença. Estima-se que o custo global do impacto da malária em África seja anualmente de 12 mil milhões de dólares. O impacto económico engloba as despesas com cuidados de saúde, dias de trabalho perdidos, dias perdidos na educação, diminuição da produtividade devido às lesões cerebrais e perda de receitas de investimento e de turismo.[11] A doença representa um fardo pesado para alguns países, nos quais é responsável por 30-50% dos internamentos hospitalares, até 50% dos doentes de ambulatório, e até 40% da despesa pública de saúde.[137]
A malária cerebral é uma das principais causas de deficiências neurológicas em crianças africanas.[88] Os estudos comparativos de funções cognitivas antes e após o tratamento para a malária grave continuam a demonstrar a diminuição do desempenho escolar e das capacidades cognitivas, mesmo após o recobro.[87] Assim, a malária grave e cerebral representam consequências sócio-económicas que se prolongam muito para além das consequências imediatas da doença.[138]
Contrafação e falsificação de medicamentos editar
Têm sido encontrados diversas contrafações sofisticadas de medicamentos provenientes de vários países asiáticos como o Camboja,[139] China,[140] Indonésia, Laos, Tailândia e Vietname. Estas falsificações são responsáveis por mortes de outra forma evitáveis nesses países.[141] A OMS refere que há estudos que estimam que até 40% dos medicamentos de malária à base de artesunato sejam contrafeitos, sobretudo na região do Grande Mekong, tendo implantado um sistema de alerta rápido que permite que a informação sobre medicamentos contrafeitos seja rapidamente reportada às autoridades dos países aderentes.[142] Não existe um método eficaz que permita aos médicos ou à população em geral detectar medicamentos de contrafação sem a ajuda de um laboratório. As farmacêuticas combatem o aumento de fármacos falsificados com o recurso a novas tecnologias que ofereçam maior segurança desde a fonte à distribuição.[143]
Outro problema de saúde clínica e pública é a proliferação de medicamentos antimaláricos de qualidade inferior, os quais resultam da concentração inapropriada de ingredientes, contaminação com outros fármacos ou impurezas tóxicas, ingredientes de fraca qualidade, pouca estabilidade e embalamento inadequado.[144] Um estudo de 2012 demonstrou que cerca de um terço dos medicamentos antimaláricos no Sudeste Asiático e na África subsariana ou eram falsificados ou não passavam nos exames químicos e padrões de embalagem.[145]
Estratégias de erradicação editar
Têm sido realizadas diversas tentativas notáveis com o intuito de eliminar o parasita de várias partes do mundo, ou de o erradicar por completo. Em 2006, a organização Malaria No More anunciou o objetivo de erradicar a malária de África em 2015.[146] Existem várias vacinas em fase de ensaio clínico, destinadas a proporcionar proteção para as crianças de regiões endémicas e reduzir a velocidade de transmissão da doença. Em 2012, o Fundo Global de luta contra a SIDA, Tuberculose e Malária distribuiu 230 milhões de redes tratadas com inseticida destinadas a impedir a transmissão através da picada do mosquito.[147] A norte-americana Fundação Clinton tem trabalhado para gerir a procura e estabilizar preços no mercado da artemisinina.[148] Outros projetos, como o Projeto do Atlas da Malária, estão focados na análise de dados climáticos e meteorológicos que permitam prever a propagação de malária com base na disponibilidade de habitats para os vectores de parasitas.[149]
A malária já foi erradicada ou bastante reduzida em determinadas regiões. A doença já foi comum nos Estados Unidos e na Europa do sul, mas as iniciativas de controlo de vectores em conjunto com a monitorização e tratamento de indivíduos infetados, proporcionaram a sua erradicação. Para tal contribuíram vários factores: a drenagem de terrenos alagados para agricultura, diversas alterações nas práticas de gestão de recursos hídricos, generalização do saneamento e uso de janelas de vidro e redes mosquiteiras nas habitações.[150] Os mesmos métodos permitiram erradicar a malária da maior parte dos Estados Unidos no início do século XX, restando apenas nalguns focos no Sul, tendo sido erradicada por completo na década de 1950 com recurso a DDT.[151] No Suriname, a doença foi erradicada da capital e regiões costeiras em 1955 através de um programa que consistia em três medidas: controlo de vectores através do uso de DDT e vaporização residual; recolha regular de amostras de sangue da população para identificar casos da doença; e tratamento com quimioterapia para todos os infetados.[152] O Butão tem implementada uma estratégia agressiva de erradicação, tendo conseguido entre 1994 e 2010 uma redução de 98,7% dos casos confirmados através de microscopia. Estas metas foram conseguidas com recurso a técnicas de controlo de vectores, como a vaporização residual em áreas de risco e através da distribuição de redes tratadas com pesticidas, auxiliadas pelo desenvolvimento económico e melhoria no acesso a serviços de saúde.[153]
Investigação editar
A imunidade (ou, mais precisamente, a tolerância imunológica) à malária P. falciparum pode ocorrer naturalmente, mas apenas enquanto resposta a anos de infeções repetidas.[154] Um indivíduo pode ser protegido contra uma infeção P. falciparum se receber cerca de mil picadas de mosquitos contaminados com uma versão não infetiva do parasita, inoculada por raio X.[155] Não está ainda disponível qualquer vacina para a malária, embora estejam a ser desenvolvidas.[156] A natureza extremamente polimórfica de muitas das proteínas P. falciparum representa um desafio significativo para a criação de uma eventual vacina. Os candidatos a vacina que têm por alvo os antígenos nos gâmetas, zigotos ou oocinetos no sistema digestivo do mosquito pretendem bloquear a transmissão de malária. Estas vacinas induzem anticorpos no sangue humano; quando o mosquito se alimenta do sangue de um indivíduo inoculado, os anticorpos impedem o parasita de concluir o seu desenvolvimento no mosquito.[157] Outros candidatos, que têm como alvo a fase sanguínea do ciclo de vida do parasita, têm-se mostrado inadequadas.[158] Por exemplo, a SPf66 foi amplamente testada em áreas endémicas na década de 1990, mas os ensaios clínicos demonstraram não ser suficientemente eficaz.[159] Estão em desenvolvimento potenciais vacinas que têm por alvo a fase pré-eritrócita do ciclo de vida do parasita, sendo a RTS,S a principal candidata;[155] estando previsto o seu licenciamento em 2015.[160] Está também a ser desenvolvida uma vacina atenuada pré-eritrocíta denominada PfSPZ que usa esporozoítos completos para induzir uma resposta imune.[161] Em 2006, a OMS delineou uma orientação ("Malaria Vaccine Technology Roadmap") em que um dos principais objetivos para 2015 é o "desenvolvimento e licenciamento de uma vacina de primeira geração contra a malária que tenha uma eficácia de proteção superior a 50% contra a forma grave da doença e a morte, e cuja duração seja superior a um ano."[162]
Os parasitas de malária contêm apicoplastos, organelas geralmente presentes nas plantas, completos com o seu próprio genoma. Pensa-se que estes apicoplastos se tenham formado a partir da endossimbiose de algas e desempenham um papel crucial em vários aspetos do metabolismo do parasita, como por exemplo na biossíntese de ácidos gordos. Foram identificadas mais de 400 proteínas produzidas pelos apicoplastos, e que estão agora a ser investigadas enquanto possíveis alvos de novos fármacos antimaláricos.[163] O plasmodium também fabrica moléculas de odor atrativo, chamados terpenos. Ele faz isso usando uma organela semelhante ao cloroplasto, como aquele que as plantas usam para captar a luz solar. A versão do parasita da malária não pode capturar luz, mas ele ainda pode fabricar perfume.[164] Os parasitas, no laboratório, produzem esses perfumes e os mosquitos são atraídos por eles. Os cientistas estão tentando descobrir se essas substâncias químicas também aparecem na respiração dos seres humanos infectados. Se o fizerem, o objetivo dos cientistas é criar um bafômetro para a malária, em vez de o exame de sangue usado hoje.[165]
Com o aparecimento de cada vez mais parasitas Plasmodium resistentes, estão a ser desenvolvidas novas estratégias para combater a disseminação da malária. Uma destas estratégias consiste na introdução de adutos sintéticos de aminoácidos piridoxais, que são recolhidos pelo parasita e interferem com a sua capacidade de criar vitaminas B essenciais.[166][167] Estão também a despertar interesse os fármacos antimaláricos à base de complexos sintéticos de base metálica.[168][169]
Outra estratégia de controlo de vetores não química envolve a manipulação genética de mosquitos de malária. O progresso na tecnologia de engenharia genética tornou possível introduzir ADN externo no genoma do mosquito, diminuindo a sua esperança de vida ou tornando-o mais resistente ao parasita da malária.[59] A técnica do inseto estéril é um método de controlo genético pelo qual são criadas grandes quantidades de mosquitos machos estéreis, que depois são libertados. O acasalamento com fêmeas reduz a população em estado selvagem na geração seguinte, e a libertação sucessiva eventualmente erradica a população-alvo.[59]
Em 2017, dois pesquisadores da Stanford criaram a centrífuga de papel que pode revolucionar como infecções como malária e HIV são detectadas nos países em desenvolvimento.[170]
Em animais editar
Estão identificadas cerca de 200 espécies parasíticas de Plasmodium capazes de infetar aves, répteis e outros mamíferos,[171] e cerca de 30 espécies que infetam naturalmente outros primatas para além do ser humano.[172] Alguns dos parasitas de malária que afetam outros primatas funcionam como organismos modelo para os parasitas humanos; por exemplo o P. coatneyi é um modelo para o P. falciparum e o P. cynomolgi para o P. vivax. As técnicas de diagnóstico usadas para detectar parasitas em primatas são semelhantes às usadas para detectar em humanos.[173] Os parasitas de malária que afetam roedores são amplamente usados como modelos na investigação, como por exemplo o P. berghei.[174] A malária aviária afeta principalmente as espécies da ordem dos Passeriformes, e constitui uma ameaça significativa para as aves de arquipélagos como as Galápagos ou o Havai. Sabe-se, por exemplo, que o parasita P. relictum desempenha um papel na limitação da distribuição e abundância das aves endémicas do Havai. Prevê-se que o aquecimento global aumente a prevalência e distribuição mundial da malária aviária, à medida que a subida da temperatura proporciona condições ótimas para a reprodução do parasita.[175]
Referências
- ↑ a b c d e f g h i j k l m n o p Caraballo H (2014). «Emergency department management of mosquito-borne illness: Malaria, dengue, and west nile virus». Emergency Medicine Practice. 16 (5). Cópia arquivada em 1 de agosto de 2016
- ↑ a b c d e f g h i j k l m n o p «Malaria Fact sheet N°94». WHO. Março de 2014. Consultado em 28 de agosto de 2014. Cópia arquivada em 3 de setembro de 2014
- ↑ a b World Malaria Report 2017 (PDF). [S.l.]: WHO. 2017. ISBN 978-92-4-156552-3
- ↑ a b GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
- ↑ a b c d e f g h i j Nadjm B, Behrens RH (2012). «Malaria: An update for physicians». Infectious Disease Clinics of North America. 26 (2): 243–59. PMID 22632637. doi:10.1016/j.idc.2012.03.010
- ↑ a b Organization, World Health (2010). Guidelines for the treatment of malaria 2nd ed. Geneva: World Health Organization. p. ix. ISBN 978-92-4-154792-5
- ↑ a b «Malaria Fact sheet N°94». WHO. Consultado em 2 de fevereiro de 2016. Cópia arquivada em 3 de setembro de 2014
- ↑ WHO (2014). World Malaria Report 2014. Geneva, Switzerland: World Health Organization. pp. 32–42. ISBN 978-92-4-156483-0
- ↑ a b Gollin D, Zimmermann C (agosto de 2007). Malaria: Disease Impacts and Long-Run Income Differences (PDF). [S.l.]: Institute for the Study of Labor
- ↑ a b Worrall E, Basu S, Hanson K (2005). «Is malaria a disease of poverty? A review of the literature». Tropical Health and Medicine. 10 (10): 1047–59. PMID 16185240. doi:10.1111/j.1365-3156.2005.01476.x
- ↑ a b Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). «Malaria». Lancet. 365 (9469): 1487–98. PMID 15850634. doi:10.1016/S0140-6736(05)66420-3
- ↑ a b Fairhurst RM, Wellems TE (2010). «Chapter 275. Plasmodium species (malaria)». In: Mandell GL, Bennett JE, Dolin R (eds). Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 2 7th ed. Philadelphia, Pennsylvania: Churchill Livingstone/Elsevier. pp. 3437–3462. ISBN 978-0-443-06839-3
- ↑ a b c d e Bartoloni A, Zammarchi L (2012). «Clinical aspects of uncomplicated and severe malaria». Mediterranean Journal of Hematology and Infectious Diseases. 4 (1): e2012026. PMC 3375727 . PMID 22708041. doi:10.4084/MJHID.2012.026
- ↑ Beare NA, Taylor TE, Harding SP, Lewallen S, Molyneux ME (2006). «Malarial retinopathy: A newly established diagnostic sign in severe malaria». American Journal of Tropical Medicine and Hygiene. 75 (5): 790–7. PMC 2367432 . PMID 17123967
- ↑ Ferri FF (2009). «Chapter 332. Protozoal infections». Ferri's Color Atlas and Text of Clinical Medicine. [S.l.]: Elsevier Health Sciences. p. 1159. ISBN 978-1-4160-4919-7
- ↑ Taylor WR, Hanson J, Turner GD, White NJ, Dondorp AM (2012). «Respiratory manifestations of malaria». Chest. 142 (2): 492–505. PMID 22871759. doi:10.1378/chest.11-2655
- ↑ Korenromp E, Williams B, de Vlas S, Gouws E, Gilks C, Ghys P, Nahlen B (2005). «Malaria attributable to the HIV-1 epidemic, sub-Saharan Africa». Emerging Infectious Diseases. 11 (9): 1410–9. PMC 3310631 . PMID 16229771. doi:10.3201/eid1109.050337
- ↑ Beare NA, Lewallen S, Taylor TE, Molyneux ME (2011). «Redefining cerebral malaria by including malaria retinopathy». Future Microbiology. 6 (3): 349–55. PMC 3139111 . PMID 21449844. doi:10.2217/fmb.11.3
- ↑ a b Hartman TK, Rogerson SJ, Fischer PR (2010). «The impact of maternal malaria on newborns». Annals of Tropical Paediatrics. 30 (4): 271–82. PMID 21118620. doi:10.1179/146532810X12858955921032
- ↑ Rijken MJ, McGready R, Boel ME, Poespoprodjo R, Singh N, Syafruddin D, Rogerson S, Nosten F (2012). «Malaria in pregnancy in the Asia-Pacific region». Lancet Infectious Diseases. 12 (1): 75–88. PMID 22192132. doi:10.1016/S1473-3099(11)70315-2
- ↑ Mueller I, Zimmerman PA, Reeder JC (2007). «Plasmodium malariae and Plasmodium ovale—the "bashful" malaria parasites». Trends in Parasitology. 23 (6): 278–83. PMC 3728836 . PMID 17459775. doi:10.1016/j.pt.2007.04.009
- ↑ a b Collins WE (2012). «Plasmodium knowlesi: A malaria parasite of monkeys and humans». Annual Review of Entomology. 57: 107–21. PMID 22149265. doi:10.1146/annurev-ento-121510-133540
- ↑ a b Sarkar PK, Ahluwalia G, Vijayan VK, Talwar A (2009). «Critical care aspects of malaria». Journal of Intensive Care Medicine. 25 (2): 93–103. PMID 20018606. doi:10.1177/0885066609356052
- ↑ Baird JK (2013). «Evidence and implications of mortality associated with acute Plasmodium vivax malaria». Clinical Microbiology Reviews. 26 (1): 36–57. PMC 3553673 . PMID 23297258. doi:10.1128/CMR.00074-12
- ↑ Arnott A, Barry AE, Reeder JC (2012). «Understanding the population genetics of Plasmodium vivax is essential for malaria control and elimination». Malaria Journal. 11: 14. PMC 3298510 . PMID 22233585. doi:10.1186/1475-2875-11-14
- ↑ Collins WE, Barnwell JW (2009). «Plasmodium knowlesi: finally being recognized». Journal of Infectious Diseases. 199 (8): 1107–8. PMID 19284287. doi:10.1086/597415
- ↑ Schlagenhauf-Lawlor 2008, pp. 70–1
- ↑ Cowman AF, Berry D, Baum J (2012). «The cellular and molecular basis for malaria parasite invasion of the human red blood cell». Journal of Cell Biology. 198 (6): 961–71. PMC 3444787 . PMID 22986493. doi:10.1083/jcb.201206112
- ↑ Arrow KJ, Panosian C, Gelband H, Institute of Medicine (U.S.). Committee on the Economics of Antimalarial Drugs (2004). Saving Lives, Buying Time: Economics of Malaria Drugs in an Age of Resistance. [S.l.]: National Academies Press. p. 141. ISBN 978-0-309-09218-0
- ↑ Owusu-Ofori AK, Parry C, Bates I (2010). «Transfusion-transmitted malaria in countries where malaria is endemic: A review of the literature from sub-Saharan Africa». Clinical Infectious Diseases. 51 (10): 1192–8. PMID 20929356. doi:10.1086/656806
- ↑ WHO 2010, p. vi
- ↑ a b White NJ (2011). «Determinants of relapse periodicity in Plasmodium vivax malaria». Malaria Journal. 10: 297. PMC 3228849 . PMID 21989376. doi:10.1186/1475-2875-10-297
- ↑ WHO 2010, p. 17
- ↑ a b c Bledsoe GH (2005). «Malaria primer for clinicians in the United States». Southern Medical Journal. 98 (12): 1197–204; quiz 1205, 1230. PMID 16440920. doi:10.1097/01.smj.0000189904.50838.eb
- ↑ Vaughan AM, Aly AS, Kappe SH (2008). «Malaria parasite pre-erythrocytic stage infection: Gliding and hiding». Cell Host & Microbe. 4 (3): 209–18. PMC 2610487 . PMID 18779047. doi:10.1016/j.chom.2008.08.010
- ↑ Richter J, Franken G, Mehlhorn H, Labisch A, Häussinger D (2010). «What is the evidence for the existence of Plasmodium ovale hypnozoites?». Parasitology Research. 107 (6): 1285–90. PMID 20922429. doi:10.1007/s00436-010-2071-z
- ↑ Tilley L, Dixon MW, Kirk K (2011). «The Plasmodium falciparum-infected red blood cell». International Journal of Biochemistry and Cell Biology. 43 (6): 839–42. PMID 21458590. doi:10.1016/j.biocel.2011.03.012
- ↑ Mens PF, Bojtor EC, Schallig HDFH (2012). «Molecular interactions in the placenta during malaria infection». European Journal of Obstetrics & Gynecology and Reproductive Biology. 152 (2): 126–32. PMID 20933151. doi:10.1016/j.ejogrb.2010.05.013
- ↑ Rénia L, Wu Howland S, Claser C, Charlotte Gruner A, Suwanarusk R, Hui Teo T, Russell B, Ng LF (2012). «Cerebral malaria: mysteries at the blood-brain barrier». Virulence. 3 (2): 193–201. PMC 3396698 . PMID 22460644. doi:10.4161/viru.19013
- ↑ Kwiatkowski DP (2005). «How malaria has affected the human genome and what human genetics can teach us about malaria». American Journal of Human Genetics. 77 (2): 171–92. PMC 1224522 . PMID 16001361. doi:10.1086/432519
- ↑ a b Hedrick PW (2011). «Population genetics of malaria resistance in humans». Heredity. 107 (4): 283–304. PMC 3182497 . PMID 21427751. doi:10.1038/hdy.2011.16
- ↑ Weatherall DJ (2008). «Genetic variation and susceptibility to infection: The red cell and malaria». British Journal of Haematology. 141 (3): 276–86. PMID 18410566. doi:10.1111/j.1365-2141.2008.07085.x
- ↑ Bhalla A, Suri V, Singh V (2006). «Malarial hepatopathy». Journal of Postgraduate Medicine. 52 (4): 315–20. PMID 17102560
- ↑ Abba K, Deeks JJ, Olliaro P, Naing CM, Jackson SM, Takwoingi Y, Donegan S, Garner P (2011). Abba, Katharine, ed. «Rapid diagnostic tests for diagnosing uncomplicated P. falciparum malaria in endemic countries». Cochrane Database of Systematic Reviews (7): CD008122. PMID 21735422. doi:10.1002/14651858.CD008122.pub2
- ↑ Kattenberg JH, Ochodo EA, Boer KR, Schallig HD, Mens PF, Leeflang MM (2011). «Systematic review and meta-analysis: Rapid diagnostic tests versus placental histology, microscopy and PCR for malaria in pregnant women». Malaria Journal. 10: 321. PMC 3228868 . PMID 22035448. doi:10.1186/1475-2875-10-321
- ↑ a b Wilson ML (2012). «Malaria rapid diagnostic tests». Clinical Infectious Diseases. 54 (11): 1637–41. PMID 22550113. doi:10.1093/cid/cis228
- ↑ Perkins MD, Bell DR (2008). «Working without a blindfold: The critical role of diagnostics in malaria control». Malaria Journal. 1 (Suppl 1): S5. PMC 2604880 . PMID 19091039. doi:10.1186/1475-2875-7-S1-S5
- ↑ WHO 2010, p. 35
- ↑ WHO 2010, p. v
- ↑ World Health Organization (1958). «Malaria». The First Ten Years of the World Health Organization (PDF). [S.l.]: World Health Organization. pp. 172–87. Consultado em 4 de janeiro de 2014. Arquivado do original (PDF) em 8 de julho de 2011
- ↑ Sabot O, Cohen JM, Hsiang MS, Kahn JG, Basu S, Tang L, Zheng B, Gao Q, Zou L, Tatarsky A, Aboobakar S, Usas J, Barrett S, Cohen JL, Jamison DT, Feachem RG (2010). «Costs and financial feasibility of malaria elimination». Lancet. 376 (9752): 1604–15. PMC 3044845 . PMID 21035839. doi:10.1016/S0140-6736(10)61355-4
- ↑ a b c Kajfasz P (2009). «Malaria prevention». International Maritime Health. 60 (1–2): 67–70. PMID 20205131
- ↑ Lengeler C (2004). Lengeler, Christian, ed. «Insecticide-treated bed nets and curtains for preventing malaria». Cochrane Database of Systematic Reviews (2): CD000363. PMID 15106149. doi:10.1002/14651858.CD000363.pub2
- ↑ Tanser FC, Lengeler C, Sharp BL (2010). Lengeler, Christian, ed. «Indoor residual spraying for preventing malaria». Cochrane Database of Systematic Reviews (4): CD006657. PMID 20393950. doi:10.1002/14651858.CD006657.pub2
- ↑ Enayati A, Hemingway J (2010). «Malaria management: Past, present, and future». Annual Review of Entomology. 55: 569–91. PMID 19754246. doi:10.1146/annurev-ento-112408-085423
- ↑ Indoor Residual Spraying: Use of Indoor Residual Spraying for Scaling Up Global Malaria Control and Elimination. WHO Position Statement (PDF). [S.l.]: World Health Organization. 2006
- ↑ a b van den Berg H (2009). «Global status of DDT and its alternatives for use in vector control to prevent disease». Environmental Health Perspectives. 117 (11): 1656–63. PMC 2801202 . PMID 20049114. doi:10.1289/ehp.0900785
- ↑ Pates H, Curtis C (2005). «Mosquito behaviour and vector control». Annual Review of Entomology. 50: 53–70. PMID 15355233. doi:10.1146/annurev.ento.50.071803.130439
- ↑ a b c Raghavendra K, Barik TK, Reddy BP, Sharma P, Dash AP (2011). «Malaria vector control: From past to future». Parasitology Research. 108 (4): 757–79. PMID 21229263. doi:10.1007/s00436-010-2232-0
- ↑ a b c Howitt P, Darzi A, Yang GZ, Ashrafian H, Atun R, Barlow J, Blakemore A, Bull AM, Car J, Conteh L, Cooke GS, Ford N, Gregson SA, Kerr K, King D, Kulendran M, Malkin RA, Majeed A, Matlin S, Merrifield R, Penfold HA, Reid SD, Smith PC, Stevens MM, Templeton MR, Vincent C, Wilson E (2012). «Technologies for global health». The Lancet. 380 (9840): 507–35. PMID 22857974. doi:10.1016/S0140-6736(12)61127-1
- ↑ Miller JM, Korenromp EL, Nahlen BL, W Steketee R (2007). «Estimating the number of insecticide-treated nets required by African households to reach continent-wide malaria coverage targets». Journal of the American Medical Association. 297 (20): 2241–50. PMID 17519414. doi:10.1001/jama.297.20.2241
- ↑ Schlagenhauf-Lawlor 2008, pp. 215
- ↑ Mosquitoes engineered to zap ability to carry malaria por TINA HESMAN SAEY (2015)
- ↑ Researchers receive $10.2 million to study new malaria-prevention method por Sara LaJeunesse "PennState News" (2015)
- ↑ Tusting, LS; Thwing, J; Sinclair, D; Fillinger, U; Gimnig, J; Bonner, KE; Bottomley, C; Lindsay, SW (29 de agosto de 2013). «Mosquito larval source management for controlling malaria.». The Cochrane database of systematic reviews. 8: CD008923. PMID 23986463
- ↑ Enayati AA, Hemingway J, Garner P. (2007). Enayati, Ahmadali, ed. «Electronic mosquito repellents for preventing mosquito bites and malaria infection» (PDF). Cochrane Database of Systematic Reviews (2): CD005434. PMID 17443590. doi:10.1002/14651858.CD005434.pub2
- ↑ a b c Jacquerioz FA, Croft AM (2009). Jacquerioz FA, ed. «Drugs for preventing malaria in travellers». Cochrane Database of Systematic Reviews (4): CD006491. PMID 19821371. doi:10.1002/14651858.CD006491.pub2
- ↑ Freedman DO (2008). «Clinical practice. Malaria prevention in short-term travelers». New England Journal of Medicine. 359 (6): 603–12. PMID 18687641. doi:10.1056/NEJMcp0803572
- ↑ Fernando SD, Rodrigo C, Rajapakse S (2011). «Chemoprophylaxis in malaria: Drugs, evidence of efficacy and costs». Asian Pacific Journal of Tropical Medicine. 4 (4): 330–36. PMID 21771482. doi:10.1016/S1995-7645(11)60098-9
- ↑ Turschner S, Efferth T (2009). «Drug resistance in Plasmodium: Natural products in the fight against malaria». Mini Reviews in Medicinal Chemistry. 9 (2): 206–14. PMID 19200025. doi:10.2174/138955709787316074
- ↑ Lalloo DG, Olukoya P, Olliaro P (2006). «Malaria in adolescence: Burden of disease, consequences, and opportunities for intervention». Lancet Infectious Diseases. 6 (12): 780–93. PMID 17123898. doi:10.1016/S1473-3099(06)70655-7
- ↑ Mehlhorn H, ed. (2008). «Disease Control, Methods». Encyclopedia of Parasitology 3rd ed. Springer. pp. 362–6. ISBN 978-3-540-48997-9
- ↑ Bardají A, Bassat Q, Alonso PL, Menéndez C (2012). «Intermittent preventive treatment of malaria in pregnant women and infants: making best use of the available evidence». Expert Opinion on Pharmacotherapy. 13 (12): 1719–36. PMID 22775553. doi:10.1517/14656566.2012.703651
- ↑ Meremikwu MM, Donegan S, Sinclair D, Esu E, Oringanje C (2012). Meremikwu, Martin M, ed. «Intermittent preventive treatment for malaria in children living in areas with seasonal transmission». Cochrane Database of Systematic Reviews. 2 (2): CD003756. PMID 22336792. doi:10.1002/14651858.CD003756.pub4
- ↑ Meremikwu MM, Odigwe CC, Akudo Nwagbara B, Udoh EE (2012). Meremikwu, Martin M, ed. «Antipyretic measures for treating fever in malaria». Cochrane Database of Systematic Reviews. 9: CD002151. PMID 22972057. doi:10.1002/14651858.CD002151.pub2
- ↑ Kokwaro G (2009). «Ongoing challenges in the management of malaria». Malaria Journal. 8 (Suppl 1): S2. PMC 2760237 . PMID 19818169. doi:10.1186/1475-2875-8-S1-S2
- ↑ WHO 2010, pp. 75–86
- ↑ WHO 2010, p. 21
- ↑ Keating GM (2012). «Dihydroartemisinin/piperaquine: A review of its use in the treatment of uncomplicated Plasmodium falciparum malaria». Drugs. 72 (7): 937–61. PMID 22515619. doi:10.2165/11203910-000000000-00000
- ↑ Manyando C, Kayentao K, D'Alessandro U, Okafor HU, Juma E, Hamed K (2011). «A systematic review of the safety and efficacy of artemether-lumefantrine against uncomplicated Plasmodium falciparum malaria during pregnancy». Malaria Journal. 11: 141. PMC 3405476 . PMID 22548983. doi:10.1186/1475-2875-11-141
- ↑ O'Brien C, Henrich PP, Passi N, Fidock DA (2011). «Recent clinical and molecular insights into emerging artemisinin resistance in Plasmodium falciparum». Current Opinion in Infectious Diseases. 24 (6): 570–7. PMC 3268008 . PMID 22001944. doi:10.1097/QCO.0b013e32834cd3ed
- ↑ Fairhurst RM, Nayyar GM, Breman JG, Hallett R, Vennerstrom JL, Duong S, Ringwald P, Wellems TE, Plowe CV, Dondorp AM (2012). «Artemisinin-resistant malaria: research challenges, opportunities, and public health implications». American Journal of Tropical Medicine and Hygiene. 87 (2): 231–41. PMC 3414557 . PMID 22855752. doi:10.4269/ajtmh.2012.12-0025
- ↑ Waters NC, Edstein MD (2012). «8-Aminoquinolines: Primaquine and tafenoquine». In: Staines HM, Krishna S (eds). Treatment and Prevention of Malaria: Antimalarial Drug Chemistry, Action and Use. [S.l.]: Springer. pp. 69–93. ISBN 978-3-0346-0479-6
- ↑ Sinclair D, Donegan S, Isba R, Lalloo DG (2012). Sinclair, David, ed. «Artesunate versus quinine for treating severe malaria». Cochrane Database of Systematic Reviews. 6: CD005967. PMID 22696354. doi:10.1002/14651858.CD005967.pub4
- ↑ «Frequently Asked Questions (FAQs): If I get malaria, will I have it for the rest of my life?». US Centers for Disease Control and Prevention. 8 de fevereiro de 2010. Consultado em 14 de maio de 2012
- ↑ Trampuz A, Jereb M, Muzlovic I, Prabhu R (2003). «Clinical review: Severe malaria». Critical Care. 7 (4): 315–23. PMC 270697 . PMID 12930555. doi:10.1186/cc2183
- ↑ a b c d Fernando SD, Rodrigo C, Rajapakse S (2010). «The 'hidden' burden of malaria: Cognitive impairment following infection». Malaria Journal. 9: 366. PMC 3018393 . PMID 21171998. doi:10.1186/1475-2875-9-366
- ↑ a b Idro R, Marsh K, John CC, Newton CRJ (2010). «Cerebral malaria: Mechanisms of brain injury and strategies for improved neuro-cognitive outcome». Pediatric Research. 68 (4): 267–74. PMC 3056312 . PMID 20606600. doi:10.1203/PDR.0b013e3181eee738
- ↑ a b World Malaria Report 2012 (PDF). [S.l.]: World Health Organization
- ↑ Olupot-Olupot P, Maitland, K (2013). «Management of severe malaria: Results from recent trials». Advances in Experimental Medicine and Biology. Advances in Experimental Medicine and Biology. 764: 241–50. ISBN 978-1-4614-4725-2. PMID 23654072. doi:10.1007/978-1-4614-4726-9_20
- ↑ a b c Murray CJ, Rosenfeld LC, Lim SS, Andrews KG, Foreman KJ, Haring D, Fullman N, Naghavi M, Lozano R, Lopez AD (2012). «Global malaria mortality between 1980 and 2010: A systematic analysis». Lancet. 379 (9814): 413–31. PMID 22305225. doi:10.1016/S0140-6736(12)60034-8
- ↑ Lozano R; et al. (2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: A systematic analysis for the Global Burden of Disease Study 2010». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
- ↑ «Malaria». US Centers for Disease Control and Prevention. 15 de abril de 2010. Consultado em 2 de maio de 2012
- ↑ Layne SP. «Principles of Infectious Disease Epidemiology» (PDF). EPI 220. UCLA Department of Epidemiology. Consultado em 15 de junho de 2007. Arquivado do original (PDF) em 20 de fevereiro de 2006
- ↑ Provost C (25 de abril de 2011). «World Malaria Day: Which countries are the hardest hit? Get the full data». The Guardian. Consultado em 3 de maio de 2012
- ↑ Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood BM, Sabot O, Rodriguez MH, Abeyasinghe RR, Ghebreyesus TA, Snow RW (2010). «Shrinking the malaria map: progress and prospects». Lancet. 376 (9752): 1566–78. PMC 3044848 . PMID 21035842. doi:10.1016/S0140-6736(10)61270-6
- ↑ Organização Mundial de Saúde. «Malaria: Elimination from the WHO European Region by 2015»
- ↑ Público. «Saúde assegura que Portugal só tem casos "importados" de malária»
- ↑ «Malária». Consultado em 20 de novembro de 2012. Cópia arquivada em 6 de agosto de 2013
- ↑ TSF (24 de abril de 2011). «Casos de malária em Moçambique baixaram 50 por cento em quatro anos»
- ↑ Organização Mundial de Saúde (29 de abril de 2013). «Moçambique celebra o Dia Mundial de Luta Contra a Malária». Consultado em 15 de novembro de 2018. Arquivado do original em 3 de março de 2016
- ↑ Jornal Sol (5 de maio de 2012). «Malária é a principal causa de morte e absentismo»
- ↑ Greenwood B, Mutabingwa T (2002). «Malaria in 2002». Nature. 415 (6872): 670–2. PMID 11832954. doi:10.1038/415670a
- ↑ Jamieson A, Toovey S, Maurel M (2006). Malaria: A Traveller's Guide. [S.l.]: Struik. p. 30. ISBN 978-1-77007-353-1
- ↑ Abeku TA (2007). «Response to malaria epidemics in Africa». Emerging Infectious Diseases. 14 (5): 681–6. PMC 2738452 . PMID 17553244. doi:10.3201/eid1305.061333
- ↑ Cui L, Yan G, Sattabongkot J, Cao Y, Chen B, Chen X, Fan Q, Fang Q, Jongwutiwes S, Parker D, Sirichaisinthop J, Kyaw MP, Su XZ, Yang H, Yang Z, Wang B, Xu J, Zheng B, Zhong D, Zhou G (2012). «Malaria in the Greater Mekong Subregion: Heterogeneity and complexity». Acta Tropica. 121 (3): 227–39. PMC 3132579 . PMID 21382335. doi:10.1016/j.actatropica.2011.02.016
- ↑ Machault V, Vignolles C, Borchi F, Vounatsou P, Pages F, Briolant S, Lacaux JP, Rogier C (2011). «The use of remotely sensed environmental data in the study of malaria» (PDF). Geospatial Health. 5 (2): 151–68. PMID 21590665. Consultado em 4 de janeiro de 2014. Arquivado do original (PDF) em 12 de março de 2013
- ↑ Ash, Neville; Ashgar Fazel (2007). «Biodiversity». In: Programa das Nações Unidas para o Meio Ambiente. Global Environment Outlook 4. [S.l.: s.n.] pp. 167–168. ISBN 978-92-807-2836-1
- ↑ Harper K, Armelagos G (2011). «The changing disease-scape in the third epidemiological transition». International Journal of Environmental Research and Public Health. 7 (2): 675–97. PMC 2872288 . PMID 20616997. doi:10.3390/ijerph7020675
- ↑ Prugnolle F, Durand P, Ollomo B, Duval L, Ariey F, Arnathau C, Gonzalez JP, Leroy E, Renaud F (2011). Manchester, Marianne, ed. «A fresh look at the origin of Plasmodium falciparum, the most malignant malaria agent». PLoS Pathogens. 7 (2): e1001283. PMC 3044689 . PMID 21383971. doi:10.1371/journal.ppat.1001283
- ↑ Cox F (2002). «History of human parasitology». Clinical Microbiology Reviews. 15 (4): 595–612. PMC 126866 . PMID 12364371. doi:10.1128/CMR.15.4.595-612.2002
- ↑ «DNA clues to malaria in ancient Rome». BBC News. 20 de fevereiro de 2001, in reference to Sallares R, Gomzi S (2001). «Biomolecular archaeology of malaria». Ancient Biomolecules. 3 (3): 195–213. OCLC 538284457
- ↑ Sallares R (2002). Malaria and Rome: A History of Malaria in Ancient Italy. [S.l.]: Oxford University Press. ISBN 978-0-19-924850-6. doi:10.1093/acprof:oso/9780199248506.001.0001
- ↑ Hays JN (2005). Epidemics and Pandemics: Their Impacts on Human History. Santa Barbara, California: ABC-CLIO. p. 11. ISBN 978-1-85109-658-9
- ↑ Reiter P (2000). «From Shakespeare to Defoe: Malaria in England in the Little Ice Age». Emerging Infectious Diseases. 6 (1): 1–11. PMC 2627969 . PMID 10653562. doi:10.3201/eid0601.000101
- ↑ Lindemann M (1999). Medicine and Society in Early Modern Europe. [S.l.]: Cambridge University Press. p. 62. ISBN 978-0-521-42354-0
- ↑ Gratz NG, World Health Organization (2006). The Vector- and Rodent-borne Diseases of Europe and North America: Their Distribution and Public Health Burden. [S.l.]: Cambridge University Press. p. 33. ISBN 978-0-521-85447-4
- ↑ Webb Jr JLA (2009). Humanity's Burden: A Global History of Malaria. [S.l.]: Cambridge University Press. ISBN 978-0-521-67012-8
- ↑ «The Nobel Prize in Physiology or Medicine 1907: Alphonse Laveran». The Nobel Foundation. Consultado em 14 de maio de 2012
- ↑ Tan SY, Sung H (2008). «Carlos Juan Finlay (1833–1915): Of mosquitoes and yellow fever» (PDF). Singapore Medical Journal. 49 (5): 370–1. PMID 18465043
- ↑ Chernin E (1983). «Josiah Clark Nott, insects, and yellow fever». Bulletin of the New York Academy of Medicine. 59 (9): 790–802. PMC 1911699 . PMID 6140039
- ↑ Chernin E (1977). «Patrick Manson (1844–1922) and the transmission of filariasis». American Journal of Tropical Medicine and Hygiene. 26 (5 Pt 2 Suppl): 1065–70. PMID 20786
- ↑ «The Nobel Prize in Physiology or Medicine 1902: Ronald Ross». The Nobel Foundation. Consultado em 14 de maio de 2012
- ↑ «Ross and the Discovery that Mosquitoes Transmit Malaria Parasites». CDC Malaria website. Consultado em 14 de junho de 2012. Cópia arquivada em 2 de junho de 2007
- ↑ Simmons JS (1979). Malaria in Panama. [S.l.]: Ayer Publishing. ISBN 978-0-405-10628-6
- ↑ Kaufman TS, Rúveda EA (2005). «The quest for quinine: Those who won the battles and those who won the war». Angewandte Chemie (International Edition in English). 44 (6): 854–85. PMID 15669029. doi:10.1002/anie.200400663
- ↑ Pelletier PJ, Caventou JB (1820). «Des recherches chimiques sur les Quinquinas» [Chemical research on quinquinas]. Annales de Chimie et de Physique (em francês). 15: 337–65
- ↑ Kyle R, Shampe M (1974). «Discoverers of quinine». Journal of the American Medical Association. 229 (4): 462. PMID 4600403. doi:10.1001/jama.229.4.462
- ↑ Achan J, Talisuna AO, Erhart A, Yeka A, Tibenderana JK, Baliraine FN, Rosenthal PJ, D'Alessandro U (2011). «Quinine, an old anti-malarial drug in a modern world: Role in the treatment of malaria». Malaria Journal. 10 (1): 144. PMC 3121651 . PMID 21609473. doi:10.1186/1475-2875-10-144
- ↑ Hsu E (2006). «Reflections on the 'discovery' of the antimalarial qinghao». British Journal of Clinical Pharmacology. 61 (3): 666–70. PMC 1885105 . PMID 16722826. doi:10.1111/j.1365-2125.2006.02673.x
- ↑ Vogel V (2013). «Malaria as a Lifesaving Therapy». Science. 342 (6159): 684–687. doi:10.1126/science.342.6159.684
- ↑ «Eradication of Malaria in the United States (1947–1951)». US Centers for Disease Control and Prevention. 8 de fevereiro de 2010. Consultado em 2 de maio de 2012
- ↑ Killeen G, Fillinger U, Kiche I, Gouagna L, Knols B (2002). «Eradication of Anopheles gambiae from Brazil: Lessons for malaria control in Africa?». Lancet Infectious Diseases. 2 (10): 618–27. PMID 12383612. doi:10.1016/S1473-3099(02)00397-3
- ↑ Vanderberg JP (2009). «Reflections on early malaria vaccine studies, the first successful human malaria vaccination, and beyond». Vaccine. 27 (1): 2–9. PMC 2637529 . PMID 18973784. doi:10.1016/j.vaccine.2008.10.028
- ↑ Humphreys M (2001). Malaria: Poverty, Race, and Public Health in the United States. [S.l.]: Johns Hopkins University Press. p. 256. ISBN 0-8018-6637-5
- ↑ Sachs J, Malaney P (2002). «The economic and social burden of malaria». Nature. 415 (6872): 680–5. PMID 11832956. doi:10.1038/415680a
- ↑ Roll Back Malaria WHO partnership (2003). «Economic costs of malaria» (PDF). WHO. Consultado em 4 de janeiro de 2014. Arquivado do original (PDF) em 29 de dezembro de 2009
- ↑ Ricci F (2012). «Social implications of malaria and their relationships with poverty». Mediterranean Journal of Hematology and Infectious Diseases. 4 (1): e2012048. PMC 3435125 . PMID 22973492. doi:10.4084/MJHID.2012.048
- ↑ Lon CT, Tsuyuoka R, Phanouvong S, Nivanna N, Socheat D, Sokhan C, Blum N, Christophel EM, Smine A (2006). «Counterfeit and substandard antimalarial drugs in Cambodia». Transactions of the Royal Society of Tropical Medicine and Hygiene. 100 (11): 1019–24. PMID 16765399. doi:10.1016/j.trstmh.2006.01.003
- ↑ Newton PN, Fernández FM, Plançon A, Mildenhall DC, Green MD, Ziyong L, Christophel EM, Phanouvong S, Howells S, McIntosh E, Laurin P, Blum N, Hampton CY, Faure K, Nyadong L, Soong CW, Santoso B, Zhiguang W, Newton J, Palmer K (2008). «A collaborative epidemiological investigation into the criminal fake artesunate trade in South East Asia». PLoS Medicine. 5 (2): e32. PMC 2235893 . PMID 18271620. doi:10.1371/journal.pmed.0050032
- ↑ Newton PN Green MD, Fernández FM, Day NPJ, White NJ (2006). «Counterfeit anti-infective drugs». Lancet Infectious Diseases. 6 (9): 602–13. PMID 16931411. doi:10.1016/S1473-3099(06)70581-3
- ↑ Parry J (2005). «WHO combats counterfeit malaria drugs in Asia». British Medical Journal. 330 (7499): 1044. PMC 557259 . PMID 15879383. doi:10.1136/bmj.330.7499.1044-d
- ↑ Gautam CS, Utreja A, Singal GL (2009). «Spurious and counterfeit drugs: A growing industry in the developing world». Postgraduate Medical Journal. 85 (1003): 251–6. PMID 19520877. doi:10.1136/pgmj.2008.073213
- ↑ Caudron J-M, Ford N, Henkens M, Macé, Kidle-Monroe R, Pinel J (2008). «Substandard medicines in resource-poor settings: A problem that can no longer be ignored». Tropical Medicine & International Health. 13 (8): 1062–72. PMID 18631318. doi:10.1111/j.1365-3156.2008.02106.x
- ↑ Nayyar GML, Breman JG, Newton PN, Herrington J (2012). «Poor-quality antimalarial drugs in southeast Asia and sub-Saharan Africa». Lancet Infectious Diseases. 12 (6): 488–96. PMID 22632187. doi:10.1016/S1473-3099(12)70064-6
- ↑ Strom S (1 de abril de 2011). «Mission Accomplished, Nonprofits Go Out of Business». The New York Times. nytimes.com. OCLC 292231852. Consultado em 9 de maio de 2012
- ↑ «Fighting AIDS, Tuberculosis and Malaria». The Global Fund. Consultado em 9 de maio de 2012. Arquivado do original em 3 de julho de 2011
- ↑ Schoofs M (17 de julho de 2008). «Clinton foundation sets up malaria-drug price plan». Wall Street Journal. Consultado em 14 de maio de 2012
- ↑ Guerra CA, Hay SI, Lucioparedes LS, Gikandi PW, Tatem AJ, Noor AM, Snow RW (2007). «Assembling a global database of malaria parasite prevalence for the Malaria Atlas Project». Malaria Journal. 6 (6): 17. PMC 1805762 . PMID 17306022. doi:10.1186/1475-2875-6-17
- ↑ Meade MS, Emch M. (2010). Medical Geography 3rd ed. [S.l.]: Guilford Press. pp. 120–3. ISBN 978-1-60623-016-9
- ↑ Williams LL (1963). «Malaria eradication in the United States». American Journal of Public Health and the Nation's Health. 53 (1): 17–21. PMC 1253858 . PMID 14000898. doi:10.2105/AJPH.53.1.17
- ↑ Breeveld FJV, Vreden SGS, Grobusch MP (2012). «History of malaria research and its contribution to the malaria control success in Suriname: A review». Malaria Journal. 11: 95. PMC 3337231 . PMID 22458802. doi:10.1186/1475-2875-11-95
- ↑ Yangzom T, Gueye CS, Namgay R, Galappaththy GN, Thimasarn K, Gosling R, Murugasampillay S, Dev V (2012). «Malaria control in Bhutan: Case study of a country embarking on elimination». Malaria Journal. 11: 9. PMC 3278342 . PMID 22230355. doi:10.1186/1475-2875-11-9
- ↑ Tran TM, Samal B, Kirkness E, Crompton PD (2012). «Systems immunology of human malaria». Trends in Parasitology. 28 (6): 248–57. PMC 3361535 . PMID 22592005. doi:10.1016/j.pt.2012.03.006
- ↑ a b Hill AVS (2011). «Vaccines against malaria». Philosophical Transactions of the Royal Society B. 366 (1579): 2806–14. PMC 3146776 . PMID 21893544. doi:10.1098/rstb.2011.0091
- ↑ Geels MJ, Imoukhuede EB, Imbault N, van Schooten H, McWade T, Troye-Blomberg M, Dobbelaer R, Craig AG, Leroy O (2011). «European Vaccine Initiative: Lessons from developing malaria vaccines» (PDF). Expert Review of Vaccines. 10 (12): 1697–708. PMID 22085173. doi:10.1586/erv.11.158. Consultado em 4 de janeiro de 2014. Arquivado do original (PDF) em 9 de junho de 2013
- ↑ Crompton PD, Pierce SK, Miller LH (2010). «Advances and challenges in malaria vaccine development». Journal of Clinical Investigation. 120 (12): 4168–78. PMC 2994342 . PMID 21123952. doi:10.1172/JCI44423
- ↑ Graves P, Gelband H (2006). Graves PM, ed. «Vaccines for preventing malaria (blood-stage)». Cochrane Database of Systematic Reviews (4): CD006199. PMID 17054281. doi:10.1002/14651858.CD006199
- ↑ Graves P, Gelband H (2006). Graves PM, ed. «Vaccines for preventing malaria (SPf66)». Cochrane Database of Systematic Reviews (2): CD005966. PMID 16625647. doi:10.1002/14651858.CD005966
- ↑ Riley EM, Stewart VA (2013). «Immune mechanisms in malaria: New insights in vaccine development». Nature Medicine. 19 (2): 168–78. PMID 23389617. doi:10.1038/nm.3083
- ↑ Hoffman SL, Billingsley PF, James E, Richman A, Loyevsky M, Li T, Chakravarty S, Gunasekera A, Chattopadhyay R, Li M, Stafford R, Ahumada A, Epstein JE, Sedegah M, Reyes S, Richie TL, Lyke KE, Edelman R, Laurens MB, Plowe CV, Sim BK (2010). «Development of a metabolically active, non-replicating sporozoite vaccine to prevent Plasmodium falciparum malaria». Human Vaccines. 6 (1): 97–106. PMID 19946222. doi:10.4161/hv.6.1.10396
- ↑ Malaria Vaccine Advisory Committee (2006). Malaria Vaccine Technology Roadmap (PDF). [S.l.]: PATH Malaria Vaccine Initiative (MVI). p. 2. Consultado em 4 de janeiro de 2014. Arquivado do original (PDF) em 13 de maio de 2013
- ↑ Kalanon M, McFadden GI (2010). «Malaria, Plasmodium falciparum and its apicoplast». Biochemical Society Transactions. 38 (3): 775–82. PMID 20491664. doi:10.1042/BST0380775
- ↑ Malaria Parasites Produce Volatile Mosquito Attractants por Megan Kelly et al, estudo foi publicado na revista mBio
- ↑ Malaria Parasite Attracts Mosquitoes with Perfume por Christopher Intagliata em 24-mar-2015 na revista "ScientificAmerican"
- ↑ Müller IB, Hyde JE, Wrenger C (2010). «Vitamin B metabolism in Plasmodium falciparum as a source of drug targets». Trends in Parasitology. 26 (1): 35–43. PMID 19939733. doi:10.1016/j.pt.2009.10.006
- ↑ Du Q, Wang H, Xie J (2011). «Thiamin (vitamin B1) biosynthesis and regulation: A rich source of antimicrobial drug targets?». International Journal of Biological Sciences. 7 (1): 41–52. PMC 3020362 . PMID 21234302. doi:10.7150/ijbs.7.41
- ↑ Biot C, Castro W, Botté CY, Navarro M (2012). «The therapeutic potential of metal-based antimalarial agents: Implications for the mechanism of action». Dalton Transactions. 41 (21): 6335–49. PMID 22362072. doi:10.1039/C2DT12247B
- ↑ Roux C, Biot C (2012). «Ferrocene-based antimalarials». Future Medicinal Chemistry. 4 (6): 783–97. PMID 22530641. doi:10.4155/fmc.12.26
- ↑ This low-cost paper centrifuge may one day save countless lives Used to detect various blood infections, the 'paperfuge' can be made for less than 20 cents. por Michael D'Estries, publicado em Nature (2017)
- ↑ Rich SM, Ayala FJ. (2006). «Evolutionary origins of human malaria parasites». In: Dronamraju KR, Arese P. Malaria: Genetic and Evolutionary Aspects. New York, New York: Springer. pp. 125–46. ISBN 978-0-387-28294-7
- ↑ Baird JK. (2009). «Malaria zoonoses». Travel Medicine and Infectious Disease. 7 (5): 269–77. PMID 19747661. doi:10.1016/j.tmaid.2009.06.004
- ↑ Ameri M (2010). «Laboratory diagnosis of malaria in nonhuman primates». Veterinary Clinical Pathology. 39 (1): 5–19. PMID 20456124. doi:10.1111/j.1939-165X.2010.00217.x
- ↑ Mlambo G, Kumar N. (2008). «Transgenic rodent Plasmodium berghei parasites as tools for assessment of functional immunogenicity and optimization of human malaria vaccines». Eukaryotic Cell. 7 (11): 1875–9. PMC 2583535 . PMID 18806208. doi:10.1128/EC.00242-08
- ↑ Lapointe DA, Atkinson CT, Samuel MD (2012). «Ecology and conservation biology of avian malaria». Annals of the New York Academy of Sciences. 1249: 211–26. PMID 22320256. doi:10.1111/j.1749-6632.2011.06431.x
Bibliografia editar
- WHO (2010). Guidelines for the Treatment of Malaria (PDF) 2nd ed. [S.l.]: World Health Organization. ISBN 978-9-2415-4792-5
- Schlagenhauf-Lawlor P (2008). Travelers' Malaria. [S.l.]: PMPH-USA. ISBN 978-1-55009-336-0
Ligações externas editar
- (em inglês) Recursos sobre a malária no sítio da Organização Mundial de Saúde
- "Malária" material do curso de Medicina da Universidade Federal Fluminense
- DUTRA, Araripe Pacheco. Malária: Informações para Profissionais de Saúde. SUCEM – Superintendência de Controle de Endemias do Estado de São Paulo
- Manual do Controlo da Malária - ADPP Angola
- Malária - As indesejáveis visitas nocturnas - uma radionovela da Deutsche Welle sobre a prevenção da doença do projecto Learning by Ear - Aprender de Ouvido
- Malaria Atlas Project
- (em inglês) Malaria Foudation