Reação de Grignard
A reação de Grignard é uma reação química organometálica na qual haletos de alquila, vinila, ou arila-magnésio (reagentes de Grignard) adicionados a um grupo carbonila em um aldeído ou cetona.[1][2] Esta reação é uma importante ferramenta para a formação de ligações carbono-carbono.[3][4] A reação de um haleto orgânico com magnésio não é uma reação de Grignard, mas fornece um reagente de Grignard.[5]
As reações e reagentes de Grignard foram descobertos e são nomeados em homenagem ao químico francês François Auguste Victor Grignard (Universidade de Nancy, França), que os publicou em 1900 e foi agraciado com o prêmio Nobel de Química de 1912 por este trabalho.[6] Reagentes de Grignard são similares aos reagentes organolítio porque ambos são nucleófilos fortes que podem formar novas ligações carbono-carbono. A nucleofilicidade aumenta se o substituinte alquilo for substituído por um grupo amida. Estes haletos amido magnésio são chamados bases de Hauser.
É uma reação importante na formação de álcoois a partir de, por exemplo, cetonas. Também é muito utilizado nas reações de substituição, pois é um nucleófilo muito forte, conseguindo deslocar diversos grupos abandonadores que geralmente não seriam considerados para reações de substituição. Mas sua maior importância se dá ao fato de que é possível preparar diversos reagentes de Grignard, desde cadeias carbônicas saturadas até cadeias complexas contendo diversos grupos funcionais, como cetonas, aldeídos, aminas, etc. Com isso se introduz no substrato uma nova ligação carbono-carbono, uma cadeia carbônica de tamanho qualquer e novos grupos funcionais que levam a diversas reações com o material de partida.
Devido às diversas possibilidades de cadeias serem adicionadas a um substrato qualquer, os reagentes de Grignard são muito utilizados na química orgânica no processo de retrossíntese de uma infinidade de moléculas complexas, como na síntese de fármacos.
Mecanismo da reação
editarO reagente de Grignard funciona como um nucleófilo, atacando o átomo de carbono eletrofílico que está presente na ligação polar de um grupo carbonila. A adição do reagente de Grignard ao carbonilo geralmente ocorre através de um estado de transição de anel de seis membros.[7]
No entanto, com reagentes de Grignard impedidos, a reação pode prosseguir através de transferência de um único elétron. Caminhos semelhantes são assumidos para outras reações de reagentes de Grignard, e.g., na formação de carbono–fósforo, carbono–estanho, carbono–silício, carbono–boro e outras ligações carbono–heteroátomo.
A reação de Grignard pode ser descrita pelo mecanismo genérico abaixo representado.
Produção do reagente de Grignard
editarOs reagentes de Grignard são formados reagindo o haleto de alquila ou de arila apropriado com o metal magnésio. A reação é conduzida por adicionar-se o haleto orgânico a uma suspensão de em solvente do tipo éter, um ácido extremamente fraco, para evitar a reação de neutralização entre o reagente de Grignard e qualquer doador de próton, pois esse reagente tem um caráter altamente básico. O solvente do tipo éter provê os ligantes requeridos para estabilizar o composto organomagnésio. Evidência empírica sugere que a reação ocorre na superfície do metal. A reação processa-se através de transferência de elétron único:[8][9][10] Na reação de formação de Grignard, radicais podem ser convertidos em carbânions através de uma transferência de segundo elétron.[11][12]
- R−X + Mg → R−X•− + Mg•+
- R−X•− → R• + X−
- R• + Mg•+ → RMg+
- RMg+ + X− → RMgX
A reação de formação do Grignard é exotérmica, mas devido à camada de óxido presente no magnésio, o começo da reação é por vezes retardado. Para iniciar a reação é geralmente necessário raspar o magnésio, agitar fortemente a mistura com pedaços de vidro, ou adicionar pequenas quantidades de iodeto, iodeto de metila ou 1,2-dibromoetano. Todos estes métodos enfraquecem a camada de óxido e expõem o magnésio ao haleto. Devido sua reatividade com ácidos, inclusive os mais fracos, como a própria água do ar, esse reagente é preparado somente no momento de ser utilizado e mesmo em local apropriado sua estocagem não é indicada.
Uma limitação dos reagentes de Grignard é que eles não reagem prontamente com haletos de alquilo via um mecanismo SN2. Por outro lado, participam prontamente em reações de transmetalação:
- RMgX + AlX → AlR + MgX2
Para este propósito, os reagentes de Grignard comercialmente disponíveis são especialmente úteis porque esta rota evita o problema com iniciação.[13]
Condições de reação
editarNas reações envolvendo reagentes de Grignard, é importante excluir a água e o ar, que rapidamente destroem o reagente por protonólise ou oxidação.[14] Uma vez que a maioria das reações de Grignard são conduzidas em éter dietílico ou tetraidrofurano anidro, as reações laterais com o ar são limitadas pela cobertura protetora proporcionada pelos vapores do solvente. As preparações em pequena escala ou quantitativas devem ser conduzidas sob atmosferas de nitrogênio ou argônio, usando técnicas sem ar. Embora os reagentes ainda precisem estar secos, a aplicação de ultrassom pode permitir que os reagentes de Grignard se formem em solventes úmidos, ativando o magnésio de forma que consuma a água.[15]
O haleto orgânico
editarAs reações de Grignard geralmente começam lentamente. Como é comum para as reações envolvendo sólidos e solução, o início segue um período de indução durante o qual o magnésio reativo se expõe aos reagentes orgânicos. Após este período de indução, as reações podem ser altamente exotérmicas. Brometo e iodeto de alquila e arila são comuns, com cloretos sendo também vistos. No entanto, fluoretos geralmente não são reativos, exceto com magnésio especialmente ativado (através de metais de Rieke).
Magnésio
editarAs reações típicas de Grignard envolvem o uso de fita de magnésio. Todo o magnésio é revestido com uma camada passiva de óxido de magnésio, a qual inibe reações com o haleto orgânico. Especialmente magnésio ativado, tal como magnésio de Rieke, contorna esse problema.[16] A camada de óxido pode ser rompida pelo uso de ultrassom,[17] ou pela adição de umas poucas gotas de iodo ou 1,2-diiodoetano.
Solvente
editarA maioria das reações de Grignard são conduzidas em solventes do tipo éter, especialmente éter dietílico e THF. Com o diéter quelante dioxano, alguns reagentes de Grignard sofrem uma reação de redistribuição resultando em compostos diorganomagnésio (R = grupo orgânico, X = haleto):
- 2 RMgX + dioxano R2Mg + MgX2(dioxano)
Esta reação é conhecida como o equilíbrio de Schlenk.
Testando os reagentes de Grignard
editarDevido aos reagentes de Grignard serem tão sensíveis à umidade e oxigênio, muitos métodos foram desenvolvidos para testar a qualidade de um lote. Testes típicos envolvem titulações com reagentes próticos anidros e pesáveis, e.g. mentol na presença de um indicador de cor. A interação do reagente de Grignard com fenantrolina ou 2,2'-bipiridina causa uma mudança de cor.[18][19][20]
Iniciação
editarMuitos métodos foram desenvolvidos para iniciar reações lentas de Grignard. Esses métodos enfraquecem a camada passivante de MgO, expondo assim magnésio altamente reativo ao haleto orgânico. Os métodos mecânicos incluem o esmagamento das peças de Mg in situ, agitação rápida e sonicação[21] da suspensão. Iodo, iodeto de metila e 1,2-dibromoetano são agentes comuns de ativação. O uso de 1,2-dibromoetano é particularmente vantajoso dado que sua ação pode ser monitorada pela observação de bolhas de etileno. Além disso, os produtos secundários são inócuos:
- Mg + BrC2H4Br → C2H4 + MgBr2
A quantidade de Mg consumida por esses agentes ativadores geralmente é insignificante. Uma pequena quantidade de cloreto de mercúrio irá amalgamar a superfície do metal, permitindo que ele reaja.
Produção industrial
editarReagentes de Grignard são produzidos na indústria para uso in situ ou para comercialização. Tal como acontece com a escala de bancada, o principal problema é a iniciação; uma porção de um lote anterior de reagente de Grignard é frequentemente usada como iniciador. As reações de Grignard são exotérmicas, e essa exotermicidade deve ser considerada quando uma reação é aumentada de laboratório para planta de produção.[22]
Muitos reagentes de Grignard tais como brometo de metil-magnésio, cloreto de metil-magnésio, brometo de fenilmagnésio e brometo de alilmagnésio são disponíveis comercialmente como soluções em tetrahidrofurano ou éter dietílico.
Reação de transferência de Mg (permuta halogênio–Mg)
editarUma preparação alternativa dos reagentes de Grignard envolve a transferência de Mg de um reagente pré-formado de Grignard a um haleto orgânico. Este método oferece a vantagem da transferência de Mg tolerar muitos grupos funcionais. Uma reação típica envolve cloreto de isopropilmagnésio e brometos ou iodetos de arilo.[23]
Reações de reagentes de Grignard
editarCom compostos carbonila
editarReagentes de Grignard reagem com uma variedade de derivados carbonila.[24]
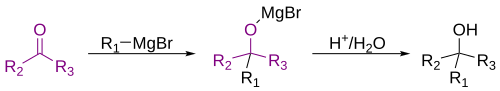
A mais comum aplicação de reagentes de Grignard é a alquilação de aldeídos e cetonas, i.e. a reação de Grignard:[25]
Note que a função acetal (uma carbonila protegida) não reage.
Tais reações usualmente envolvem um processo ácido aquoso, embora este passo raramente seja mostrado em esquemas de reação. Nos casos em que o reagente de Grignard é adicionando a um aldeído ou a uma cetona proquiral, o modelo Felkin-Anh ou a regra de Cram pode geralmente prever qual estereoisômero será formado. Com 1,3-dicetonas facilmente desprotonadas e substratos ácidos relacionados, o reagente de Grignard RMgX funciona meramente como uma base. fornecendo o ânion enolato e liberando o alcano RH.
Reagentes de Grignard são nucleófilos em substituições nucleofílicas alifáticas por exemplo com haletos de alquila como um passo chave na produção industrial de Naproxeno:
Reações como uma base
editarReagentes de Grignard servem como uma base para substratos próticos (este esquema não mostra condições de trabalho, que geralmente incluem água). Os reagentes de Grignard são básicos e reagem com álcoois, fenóis, etc, para dar alcóxidos (ROMgBr). O derivado de fenóxido é suscetível à formilação paraformaldeído para dar salicilaldeído.[26]
Formação de ligações a B, Si, P, Sn
editarComo compostos organolítio, reagentes de Grignard são úteis para formar ligações carbono–heteroátomo.
Reação com haletos de metal de transição
editarReagentes de Grignard reagem com muitos eletrófilos baseados em metal. Por exemplo, eles sofrem transmetalação com cloreto de cádmio (CdCl2) resultando em dialquilcádmio:[27]
- 2 RMgX + CdCl2 → R2Cd + 2 Mg(X)Cl
Reagentes dialquilcádmio são usados para a preparação de cetones de haletos de acila:
- 2 R'C(O)Cl + R2Cd → 2 R'C(O)R + CdCl2
Com haletos orgânicos
editarReagentes de Grignard tipicamente não reagem com haletos orgânicos, em contraste com sua alta reatividade com outros halogenetos do grupo principal. Na presença de catalisadores metálicos, entretanto, reagentes de Grignard participam nas reações de acoplamento C-C. Por exemplo, brometo de nonilmagnésio reage com p-clorobenzoato de metila resultando em ácido p-nonilbenzóico, na presença de ’’tris’’(acetilacetonato)ferro(III) (Fe(acac)3), após processamento com NaOH para hidrolisar o éster, como mostrado a seguir. Sem o Fe(acac)3, o reagente de Grignard atacaria o grupo éster sobre haleto de arila.[28]
Para o acoplamento de haletos de arila com reagente de Grignard arila, cloreto de níquel em tetraidrofurano (THF) também é um bom catalisador. Além disso, um catalisador eficaz para os acoplamentos de halogenetos de alquilo é o tetraclorocuprato de dilítio (Li2CuCl4), preparado por misturar-se cloreto de lítio (LiCl) e cloreto de cobre (II) (CuCl2) em THF. O acoplamento Kumada-Corriu resulta em acesso a estirenos [substituído].
Oxidação
editarO tratamento de reagente de Grignard com oxigênio resulta o organoperóxido magnésio. A hidrólise deste material rende hidroperóxidos ou álcoois. Essas reações envolvem radicais intermediários.
A oxidação simples dos reagentes de Grignard para dar álcoois é de pouca importância prática, pois os rendimentos geralmente são pobres. Em contraste, a sequência de dois passos via um borano (vide supra) que é posteriormente oxidado ao álcool com peróxido de hidrogênio é de utilidade sintética.
A utilidade sintética das oxidações de Grignard pode ser aumentada por uma reação de reagentes de Grignard com oxigênio na presença de um alceno a um álcool etileno estendido.[29] Esta modificação requer Grignards aril ou vinil. Adicionar apenas o Grignard e o alceno não resulta em uma reação que demonstre que a presença de oxigênio é essencial. O único inconveniente é a exigência de pelo menos dois equivalentes de Grignard, embora isso possa ser parcialmente contornado pelo uso de um sistema duplo de Grignard com um Grignard reduzido barato, tal como brometo de n-butilmagnésio.
Eliminação
editarNa síntese de olefina de Boord, a adição de magnésio a certos β-haloéteres resulta em uma reação de eliminação do alceno. Esta reação pode limitar a utilidade das reações de Grignard.
Degradação de reagentes de Grignard
editarNuma determinada época, a formação e hidrólise dos reagentes de Grignard foi utilizada na determinação do número de átomos de halogênio em um composto orgânico.[30] No uso moderno, a degradação de Grignard é utilizada na análise química de certos triacilgliceróis.[31]
Uso industrial
editarUm exemplo da reação de Grignard é uma etapa chave na produção industrial (não-estereospecífica) de Tamoxifeno[32] (Atualmente usado para o tratamento de câncer de mama de receptor positivo ao estrogênio em mulheres):[33]
Galeria
editar-
Pedaços de fita de magnésio são colocadas em um frasco.
-
Tetraidrofurano e um pequeno pedaço de iodo são adicionados.
-
Uma solução de brometo de alquilo é adicionada durante o aquecimento.
-
Após a conclusão da adição, a mistura é aquecida por um tempo.
-
A formação do reagente de Grignard está completa. Uma pequena quantidade de magnésio ainda permanece no frasco.
-
O reagente de Grignard assim preparado é resfriado a 0°C antes da adição do composto de carbonilo. A solução torna-se turva à medida que o reagente de Grignard precipita.
-
Uma solução de composto de carbonilo é adicionada ao reagente de Grignard.
-
A solução é aquecida até a temperatura ambiente. Neste ponto, a reação está completa.
Referências
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, ISBN 0-471-72091-7 6th ed. , New York: Wiley-Interscience
- ↑ Chapter 19: Carboxylic Acids. Organic Chemistry 4e Carey. mhhe.com
- ↑ Shirley, D. A. (1954). «The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium». Org. React. 8: 28–58
- ↑ Huryn, D. M. (1991). «Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions». In: Trost, B. M.; Fleming, I. Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. [S.l.]: Elsevier Science. pp. 49–75. ISBN 978-0-08-052349-1. doi:10.1016/B978-0-08-052349-1.00002-0
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). ISBN 0-9678550-9-8. doi:10.1351/goldbook.
- ↑ Grignard, V. (1900). «Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hydrocabures». Compt. Rend. 130: 1322–25
- ↑ Maruyama, K.; Katagiri, T. (1989). «Mechanism of the Grignard reaction». J. Phys. Org. Chem. 2 (3): 205–213. doi:10.1002/poc.610020303
- ↑ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley & Sons: New York, 2000; pp 185–275. ISBN 0-471-99908-3.
- ↑ Advanced Organic chemistry Part B: Reactions and Synthesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983
- ↑ Rogers, H. R.; Hill, C. L.; Fujiwara, Y.; Rogers, R. J.; Mitchell, H. L.; Whitesides, G. M. (1980). «Mechanism of formation of Grignard reagents. Kinetics of reaction of alkyl halides in diethyl ether with magnesium». Journal of the American Chemical Society. 102 (1). 217 páginas. doi:10.1021/ja00521a034
- ↑ De Boer, H.J.R.; Akkerman, O.S; Bickelhaupt, F. (1988). «Carbanions as intermediates in the synthesis of Grignard Reagents». Angew. Chem. Int. Ed. 27 (5): 687–89. doi:10.1002/anie.198806871
- ↑ Van Klink, G.P.M.; de Boer, H.J.R; Schat, G.; Akkerman, O.S.; Bickelhaupt, F.; Spek, A. (2002). «Carbanions as Intermediates in the Formation of Grignard Reagents». Organometallics. 21 (10): 2119–35. doi:10.1021/om011083a
- ↑ Silverman, G. S., Rakita, P. E. (eds.) (1996) Handbook of Grignard Reagents. CRC Press. ISBN 0824795458
- ↑ Goebel, M. T.; Marvel, C. S. (1933). «The Oxidation of Grignard Reagents». Journal of the American Chemical Society. 55 (4): 1693–1696. doi:10.1021/ja01331a065
- ↑ Smith, David H. (1999). «Grignard Reactions in "Wet" Ether». Journal of Chemical Education. 76 (10). 1427 páginas. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427
- ↑ Lai Yee Hing (1981). «Grignard Reagents from Chemically Activated Magnesium». Synthesis. 1981 (8): 585–604. doi:10.1055/s-1981-29537
- ↑ Clayden, Jonathan; Greeves, Nick (2005). Organic chemistry. Oxford: Oxford Univ. Press. 212 páginas. ISBN 978-0-19-850346-0
- ↑ Krasovskiy, Arkady; Knochel, Paul. «Convenient Titration Method for Organometallic Zinc, Magnesium, and Lanthanide Reagents». Synthesis. 2006: 890–891. doi:10.1055/s-2006-926345
- ↑ Ho-Shen Lin & Leo A. Paquette; A Convenient Method for Determining the Concentration of Grignard Reagents; Synthetic Communications, Volume 24, 1994 - Issue 17. Pages 2503-2506.
- ↑ Shun-Ichi Murahashi; Ruthenium in Organic Synthesis; John Wiley & Sons, 2006. pg 131-132
- ↑ Smith, David H. (1999). «Grignard Reactions in "Wet" Ether». Journal of Chemical Education. 76 (10). 1427 páginas. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427
- ↑ Philip E. Rakita (1996). «5. Safe Handling Practices of Industrial Scale Grignard Ragents». In: Gary S. Silverman; Philip E. Rakita. Handbook of Grignard reagents (Google Books excerpt). [S.l.]: CRC Press. pp. 79–88. ISBN 0-8247-9545-8
- ↑ Knochel, P.; Dohle, W.; Gommermann, N.; Kneisel, F. F.; Kopp, F.; Korn, T.; Sapountzis, I.; Vu, V. A. (2003). «Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange». Angewandte Chemie International Edition. 42: 4302–4320. PMID 14502700. doi:10.1002/anie.200300579
- ↑ Henry Gilman and R. H. Kirby (1941). «Butyric acid, α-methyl-». Org. Synth.; Coll. Vol., 1
- ↑ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O.; Vallance, Claire; Wood, Bryan R. (1997). «Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin» (PDF). Acta Chemica Scandinavica. 51: 1096–1103. doi:10.3891/acta.chem.scand.51-1096. Consultado em 26 de novembro de 2009
- ↑ Peters, D. G.; Ji, C. (2006). «A Multistep Synthesis for an Advanced Undergraduate Organic Chemistry Laboratory». Journal of Chemical Education. 83 (2). 290 páginas. doi:10.1021/ed083p290
- ↑ «Unit 12 Aldehydes, Ketones and Carboxylic Acids». Chemistry Part II Textbook for class XII (PDF). 2. India: National Council of Educational Research and Training. 2010. 355 páginas. ISBN 81-7450-716-7
- ↑ A. Fürstner, A. Leitner, G. Seidel (2004). «4-Nonylbenzoic Acid». Org. Synth. 81: 33–42
- ↑ Youhei Nobe; Kyohei Arayama; Hirokazu Urabe (2005). «Air-Assisted Addition of Grignard Reagents to Olefins. A Simple Protocol for a Three-Component Coupling Process Yielding Alcohols». J. Am. Chem. Soc. 127 (51): 18006–18007. PMID 16366543. doi:10.1021/ja055732b
- ↑ Steinkopf, Wilhelm; V. Petersdorff, Hans-JüRgen (1940). «Studien in der Thiophenreihe. LI. Atophanartige Derivate des Dithienyls und Diphenyls». Justus Liebigs Ann. Chem. 543: 119–128. doi:10.1002/jlac.19405430110
- ↑ Myher JJ; Kuksis A (fevereiro de 1979). «Stereospecific analysis of triacylglycerols via racemic phosphatidylcholines and phospholipase C». Can. J. Biochem. 57 (2): 117–24. PMID 455112. doi:10.1139/o79-015
- ↑ Richey, Herman Glenn (2000). Grignard Reagents: New Developments. [S.l.]: Wiley. ISBN 0471999083
- ↑ Jordan VC (1993). «Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer». Br J Pharmacol. 110 (2): 507–17. PMC 2175926 . PMID 8242225. doi:10.1111/j.1476-5381.1993.tb13840.x